
БХ
.pdfсреди них принадлежит антибиотикам – разнообразным по химическому строению органическим соединениям, синтезируемым микроорганизмами.
Они проявляют эффект на различных стадиях:
•на стадии репликации (ингибиторы репликации)
Актинотимицин Д – встраивается в молекулу ДНК и блокирует синтез новой ДНК; Новобиацин – ингибирует ДНК-топоизомеразу;
•на стадии транскрипции (ингибиторы транскрипции)
Рифамицин – блокирует ДНК-зависимую РНК-полимеразу;
•на стадии трансляции (ингибиторы трансляции)
Тетрациклин, левомицетин – связывают либо малую, либо большую субъединицу рибосомы и тем самым блокируют синтез белка;
74. Гем, основные этапы биосинтеза. Возможные нарушения обмена порфинов, приводящие к ослаблению синтеза гема. Гемоглобин, его структура. Гетерогенность гемоглобинов. Свойства гемоглобина: кооперативное взаимодействие субъединиц. Виды гемоглобина (Hb P, Hb F, Hb A). Формы гемоглобина: оксигемоглобин, карбгемоглобин, метгемоглобин, карбоксигемоглобин. Функции гемоглобина. Влияние 2,3-дифосфоглицерата эритроцита на процесс оксигенации. Патологии гемоглобина – гемоглобинозы.
Гем является небелковой частью многих гемопротеинов:
•гемоглобин (до 85% общего количества гема организма), локализованный в эритроцитах и клетках костного мозга,
•миоглобин скелетных мышц и миокарда (до 17%),
•цитохромы дыхательной цепи,
•ферменты цитохромоксидаза, цитохром P450, гомогентизатоксидаза, миелопероксидаза, каталаза и глутатионпероксидаза, тиреопероксидаза – менее 1 %.
Гем состоит из иона двухвалентного железа и порфирина.
Воснове структуры порфиринов находится порфирин. Порфирин представляет собой четыре пиррольных кольца, связанных между собой метеновыми мостиками.
Взависимости от структуры заместителей в кольцах пирролов различают несколько типов порфиринов: протопорфирины, этиопорфирины, мезопорфирины и копропорфирины.
Протопорфирины – предшественники всех других типов порфиринов. Гемы разных белков могут содержать разные типы порфиринов. В геме гемоглобина находится протопорфирин IX, который имеет 4 метильных, 2 винильных радикала и 2 остатка пропионовой кислоты. Железо в геме находится в восстановленном состоянии (Fe2+) и связано двумя ковалентными и двумя координационнымии связями с атомами азота пиррольных колец. При окислении железа гем превращается в гематин (Fe3+). Наибольшее количество гема содержат эритроциты, заполненные гемоглобином, мышечные клетки, имеющие миоглобин, и клетки печени из-за высокого содержания в них цитохрома P450.
Синтез гема
Синтез белковой части и гема протекают отдельно. Глобин (белковая часть) синтезируется на рибосомах. Гем синтезируется отдельно в митохондриях и цитоплазме. Присоединение глобина к гему происходит на последней стадии синтеза гемоглобина.
Вещества, необходимые для синтеза гема:
1) Глицин
2) Сукцинил-КоА
3) Железо
4) Витамины (В6, В12)
Первая реакция синтеза гема - образование 5-аминолевулиновой кислоты из глицина и сукцинилКоА (образуется в ЦТК) идѐт в матриксе митохондрий. Эту реакцию катализирует пиридоксальзависимый (В6) фермент аминолевулинатсинтаза.
151

Из митохондрий 5-аминолевулиновая кислота поступает в цитоплазму. В цитоплазме проходят промежуточные этапы синтеза гема: соединение 2-x молекул 5-аминолевулиновой кислоты в молекулу порфобилиногена под действием фермента аминолевулинатдегидратазы.
Далее в цитоплазме под действием порфобилиногендезоминазы 4 молекулы порфобилиногена конденсируются с образованием гидроксиметилбилана.
Далее ферменты изомераза и дегидратаза образуют замкнутый цикл из четырех пиррольных колец, связанных между собой метиленовыми груп-
пами с образованием уропорфириногена III, который в дальнейшем декарбоксилируется с образованием копропорфириногена III. (Гидроксиметилбилан может также неферментативно превращаться в уропорфириноген I, который декарбоксилируется в копропорфириноген I.)
Из цитоплазмы копропорфириноген III опять поступает в митохондрии, где проходят заключительные реакции синтеза гема, в результате которых копропорфириноген III превращается в протопорфирин IX, соединяющийся под действием феррохелатазы с Fe2+ (источником является ферритин) и образует гем.
152
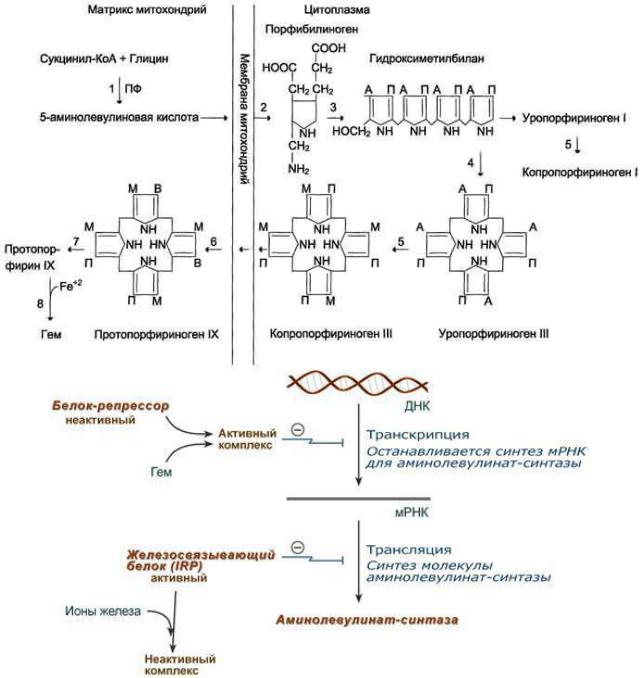
Регуляция синтеза гема
1)Fe2+ индуцирует синтез аминолевулинатсинтазы.
2)Положительным модулятором аминолевулинатсинтазы является гипоксия тканей.
3)Стероидные гормоны и некоторые лекарства (барбитураты, диклофенак, сульфаниламиды, эстрогены) являются индукторами синтеза аминолевулинатсинтазы (в печени).
4)Аминолевулинатсинтаза и аминолевулинатдегидратаза ингибируются по принципу обратной связи гемом.
Ещё один вариант (более развернутый) 1. Гем:
напрямую оказывает отрицательный аллостерический эффект на фермент, влияет на транскрипцию фермента. После взаимодействия с молекулой белка-репрессора формирует активный репрессорный комплекс, связывается с ДНК и подавляет транскрипцию, мРНК для фермента не образуется и синтез фермента прекращается.
2. Ионы железа. Их достаточное количество оказывает положительный эффект при синтезе молекулы аминолевулинатсинтазы.
В клетке имеется железосвязывающий белок (англ. IRP, iron-responsive element-binding proteins –
белок, связывающий железочувствительный элемент), который в отсутствии ионов железа обладает
153
сродством к железочувствительному участку IRE (англ. ironresponsive element) на матричной РНК фермента. Это связывание блокирует трансляцию мРНК в рибосоме, т.е. подавляет синтез белковой цепи.
При наличии ионов железа они связываются с железосвязывающим белком, образуя с ним неактивный комплекс, и это инициирует синтез фермента.
3.Положительным модулятором аминолевулинатсинтазы служит внутриклеточная гипоксия, которая в эритропоэтических тканях индуцирует синтез фермента.
4.В печени повышению активности аминолевулинатсинтазы способствуют различные соединения, усиливающие работу микросомальной системы окисления (жирорастворимые вещества, стероиды) – при этом возрастает потребление гема для образования цитохрома Р450, и снижается внутриклеточная концентрация свободного гема. В результате происходит усиление синтеза фермента.
Сам гем является индуктором синтеза α- и β-цепей гемоглобина.
Нарушения обмена порфиринов.
Порфирии – это группа гетерогенных наследственных заболеваний, возникающих в результате нарушения синтеза гема и повышения содержания порфиринов и их предшественников в организме. Выделяют наследственные и приобретенные формы порфирии.
Приобретенные формы порфирий носят токсический характер и вызываются действием гексахлорбензола, солей свинца и других тяжелых металлов (ингибирование порфобилиногенсинтазы, феррохелатазы и др.), лекарственными препаратами (антигрибковый антибиотик гризеофульфин).
При наследственных формах дефект фермента имеется во всех клетках организма, но проявляется только в одном типе клеток. Можно выделить две большие группы порфирий:
1.Печеночные – группа заболеваний с аутосомнодоминантными нарушениями ферментов различных этапов синтеза протопорфирина IX.
Наиболее ярким заболеванием этой группы является перемежающаяся острая порфирия, при которой у гетерозигот активность уропорфириноген-I-синтазы снижена на 50%. В результате больные экскретируют с мочой большие количества порфобилиногена и аминолевулиновой кислоты. На свету порфобилиноген окисляется в окрашенные соединения, и моча темнеет. Симптомами заболевания являются острые боли в животе, нервно-психические расстройства (полиневриты, тетрапарез, галлюцинации), сердечно-сосудистые нарушения.
2.Эритропоэтические – аутосомно-рецессивные нарушения некоторых ферментов синтеза протопорфирина IX в эритроидных клетках. При этом при синтезе уропорфириногенов баланс реакций смещается в сторону синтеза уропорфириногена I. Примером может служить болезнь Гюнтера (частота <1:1000000), при которой развиваются высокая фоточувствительность кожи (ожоги под солнечным светом) и ее поражение, гемолиз, эритродонтия (окрашивание зубов в красный цвет), разрушение хрящей, в том числе носа и ушей.
Для талассемий характерно снижение синтеза α-цепей гемоглобина (α-талассемия) или β-цепей (β-талассемия). Это приводит к нарушению эритропоэза, гемолизу и тяжелым анемиям.
Гемоглобин, его структура.
Гемоглобин входит в состав группы белков гемопротеины, которые сами являются подвидом хромопротеинов и подразделяются на неферментативные белки (гемоглобин, миоглобин) и ферменты (цитохромы, каталаза, пероксидаза). Небелковой частью их является гем – структура, включающая в себя порфириновое кольцо (состоящее из 4 пиррольных колец) и иона Fe2+. Железо связывается с порфириновым кольцом двумя координационными и двумя ковалентными связями.
Гемоглобин представляет собой белок, включающий 4 гемсодержащие белковые субъединицы. Между собой протомеры соединяются гидрофобными, ионными, водородными связями, при этом они взаимодействуют не произвольно, а определенным участком – контактной поверхностью.
154
Белковые субъединицы в нормальном гемоглобине могут быть представлены различными типами полипептидных цепей: α, β, γ, δ, ε, ξ (соответственно, греч. - альфа, бета, гамма, дельта, эпсилон, кси). В состав молекулы гемоглобина входят по две цепи двух разных типов.
Гем соединяется с белковой субъединицей, во-первых, через остаток гистидина координационной связью железа, во-вторых, через гидрофобные связи пиррольных колец и гидрофобных аминокислот. Гем располагается как бы "в кармане" своей цепи и формируется гемсодержащий протомер.
Нормальные формы гемоглобина
Существует несколько нормальных вариантов гемоглобина:
•HbР (primitive) – примитивный гемоглобин, содержит 2ξ- и 2ε-цепи, встречается в эмбрионе между 7-12 неделями жизни,
•HbF (foetal) – фетальный гемоглобин, содержит 2α- и 2γ-цепи, появляется через 12 недель внутриутробного развития и является основным после 3 месяцев,
•HbA (adult) – гемоглобин взрослых, доля составляет 98%, содержит 2α- и 2β-цепи, у плода появляется через 3 месяца жизни и к рождению составляет 80% всего гемоглобина,
•HbA2 – гемоглобин взрослых, доля составляет 2%, содержит 2α- и 2δ-цепи,
•HbO2 – оксигемоглобин, образуется при связывании кислорода в легких, в легочных венах его 9498% от всего количества гемоглобина,
•HbCO2 – карбогемоглобин, образуется при связывании углекислого газа в тканях, в венозной крови составляет 15-20% от всего количества гемоглобина.
•HbCO - карбоксигемоглобин прочное соединение гемоглобина и угарного газа. Избыток карбоксигемоглобина в крови приводит к кислородному голоданию, головокружению, тошноте, рвоте или даже смерти, так как угарный газ, связанный с гемоглобином, лишает его возможности присоединять
ксебе кислород.
Патологические формы гемоглобина
•*HbS – гемоглобин серповидно-клеточной анемии.
•MetHb – метгемоглобин, форма гемоглобина, включающая трехвалентный ион железа вместо двухвалентного. Такая форма образуется спонтанно, при взаимодействии молекулы O2 и гемового Fe2+, но обычно ферментативных мощностей клетки хватает на его восстановление. При использовании сульфаниламидов, употреблении нитрита натрия и нитратов пищевых продуктов, при недостаточности аскорбиновой кислоты ускоряется переход Fe2+ в Fe3+. Образующийся metHb не способен связывать кислород и возникает гипоксиятканей. Для восстановления Fe3+ в Fe2+ в клинике используют аскорбиновую кислоту и метиленовую синь.
•Hb-CO – карбоксигемоглобин, образуется при наличии СО (угарный газ) во вдыхаемом воздухе. Он постоянно присутствует в крови в малых концентрациях, но его доля может колебаться от условий
иобраза жизни.
•HbA1С – гликозилированный гемоглобин. Концентрация его нарастает при хронической гипергликемии и является хорошим скрининговым показателем уровня глюкозы крови за длительный период времени (время жизни эритроцита, 3-4 месяца).
*HbS – гемоглобин серповидно-клеточной анемии. При этом нарушении в ДНК в результате точковой мутации триплет ЦТТ заменен на триплет ЦАТ, что влечет за собой включение в 6-м положении β-цепи вместо глутамата аминокислоты валина. Изменение свойств β-цепи влечет изменение свойств всей молекулы и формирование на поверхности гемоглобина "липкого" участка. При дезоксигенации гемоглобина участок "раскрывается" и связывает одну молекулу дезоксигемоглобина S с другими подобными. Результатом является полимеризация гемоглобиновых молекул и образование крупных белковых тяжей, вызывающих деформацию эритроцитов и, при прохождении ими капилляров, гемолиз. *
Функции гемоглобина
Главными функциями гемоглобина являются дыхательная и буферная.
1. Дыхательная функция. Один моль гемоглобина может связать до 4 молей кислорода, а 1 г гемоглобина может связать 1,345 мл кислорода. Кислородная емкость крови ‒ это максимальное количество кислорода, которое может быть связано 1 мл крови. Насыщение гемоглобина кислородом составляет 96‒98%. Связывание кислорода происходит в процессе так называемой оксигенации, а не истинного окисления. Железо в оксигемоглобине остается двухвалентным.
2. Участие гемоглобина в регуляции рН крови (буферная функция) связано с его ролью в транспорте кислорода и углекислого газа.
Гетерогенность гемоглобина
155
Различают 3 типа гетерогенности: эмбриональная, обусловленная наличием минорных Hb, генетическая.
1)Эмбриональная. В эритроцитах плода наибольшую часть составляет фетальный гемоглобин HbF. У него две α цепи как у HbA и две γ цепи, -α2γ2. γ цепи отличаются от β цепей иной последовательностью 37 аминокислот. Сродство к О2 у HbF значительно выше, чем у HbА. Поэтому HbF обеспечивает доставку О2 эмбриону из системы кровообращения матери. После рождения HbF начинает исчезать и через 4-6 месяцев не обнаруживается.
2)В эритроцитах взрослого кроме основного HbА1α2β2 имеются минорные гемоглобины, составляющие 5-10% от общего количества гемоглобина:
а) HbА2 составляет 2,5%, имеет 2α и 2δ (дельта) цепи α2δ2. δ цепи отличаются от β цепей последовательностью 10 аминокислот.
б) HbА1b - 3-6%, HbА1c - 1%, образуются в результате глюкозилирования N концевых остатков валина β цепей. При диабете количество этих гемоглобинов повышается.
3)Генетическая гетерогенность связана с точечными мутациями в одном из генов, кодирующих синтез α,β,γ или δ цепей. Выявлено 300 вариантов гемоглобина, они называются аномальные Hb.
Кооперативное взаимодействие
Взаимовлияние протомеров олигомерного белка друг на друга называется кооперативное взаимодействие.
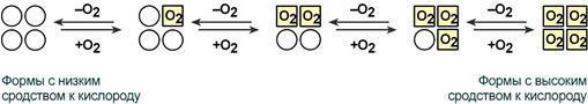
В легких такое взаимодействие субъединиц гемоглобина повышает его сродство к кислороду и ускоряет присоединение кислорода в 300 раз. В тканях идет обратный процесс, сродство снижается и ускорение отдачи кислорода также 300-кратное. Объясняется такой феномен тем, что в легких при присоединении первой молекулы кислорода к железу (за счет 6-й координационной связи) атом железа втягивается в плоскость гема, кислород остается вне плоскости. Это вызывает перемещение участка белковой цепи и изменение конформации первого протомера. Такой измененный протомер влияет на другие субъединицы и облегчает связывание кислорода со второй субъединицей. Это меняет конформацию второй субъединицы, облегчая присоединение последующих молекул кислорода и изменение других протомеров.
Дезоксиформа гемоглобина обозначается как Т-форма, напряженная (англ. tense), она обладает существенно более низким сродством к кислороду. Оксигенированная форма, или R-форма (англ. relaxed), обладает высоким сродством к кислороду.
Изменение рН среды
Влияние рН на сродство гемоглобина к кислороду носит название эффекта Бора. При закислении среды сродство снижается, при защелачивании – повышается. При повышении концентрации протонов (закисление среды) в тканях возрастает освобождение кислорода из оксигемоглобина. В легких после удаления угольной кислоты (в виде СО2) из крови и одновременном увеличении концентрации кислорода высвобождаются ионы Н+ из гемоглобина.
Изменение сродства гемоглобина к кислороду в тканях и в легких при изменении концентрации ионов H+ и О2 обусловлено конформационными перестройками глобиновой части молекулы. В тканях молекула О2 отрывается от железа и ионы водорода присоединяются к остаткам гистидина (глобиновой части), образуя восстановленный гемоглобин (H-Hb) с низким сродством к кислороду.
В легких поступающий в больших количествах кислород "вытесняет" ион водорода из связи с остатком гистидина гемоглобиновой молекулы.
156

Роль 2,3-дифосфоглицерата
2,3-Дифосфоглицерат образуется в эритроцитах из 1,3-дифосфоглицерата, промежуточного метаболита гликолиза, в реакциях, получивших название шунт Раппопорта.
2,3-Дифосфоглицерат располагается в центральной полости тетрамера дезоксигемоглобина и связывается с β-цепями, образуя поперечный солевой мостик между атомами кислорода 2,3-дифосфогли- церата и аминогруппами концевого валина обеих β-цепей, также аминогруппами радикалов лизина и гистидина.
Функция 2,3-дифосфоглицерата заключается в снижении сродства гемоглобина к кислороду, что имеет особенное значение при подъеме на высоту и при нехватке кислорода во вдыхаемом воздухе. В этих условиях связывание кислорода с гемоглобином в легких не нарушается, так как концентрация его относительно высока. Однако в тканях за счет 2,3-дифосфоглицерата отдача кислорода возрастает в 2 раза.
Гемоглобинозы
Биологическая активность белков находится в прямой зависимости от сохранности ПСБ (первичная структура белка). При замене хотя бы одной аминокислоты могут возникнуть различные патологии. Например, при даже незначительных изменениях в ППЦ (полипептидная цепь) Hb возникают аномальные гемоглобинозы. Их около 200.
Гемоглобинозы делятся на две основные группы:
1)гемоглобинопатии;
2)талассемии.
Гемоглобинопатии – в их основе наследственное изменение структуры какой-либо цепи Hb. Например, серповидно-клеточная анемия (в основном в странах Южной Америки, Африки, Юго-Во- сточной Азии). Эритроциты в условиях низкого парциального давления принимают форму серпа. HbS после отдачи О2 превращается в плохо растворимую форму и выпадает в осадок в виде
157
веретенообразных кристаллов, которые деформируют клетку и приводят к массивному гемолизу. Болезнь протекает остро, и дети погибают в раннем возрасте. Причиной данной патологии является мутация в молекуле ДНК, кодирующей синтез -цепи Hb, где происходит замена только 1-ой аминокислоты – глу на вал в 6-м положении.
Талассемии – в основе – генетическое нарушение синтеза какой-либо ППЦ Hb. При нарушении синтеза b-цепи возникают b-талассемии. Наряду с HbА1 до 15% HbА2 и до 60% HbF – происходит гиперплазия и разрушение костного мозга, поражение печени, селезенки, деформация черепа, тяжелая гемолитическая анемия. Эритроциты приобретают форму мишени.
75. Распад гема. Билирубин как продукт распада гема. Метаболизм билирубина. Нарушение его обмена. Желтухи и их биологическая диагностика.
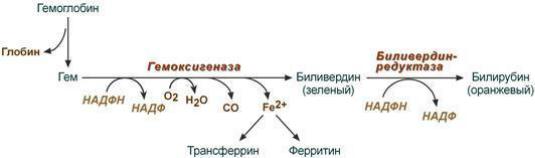
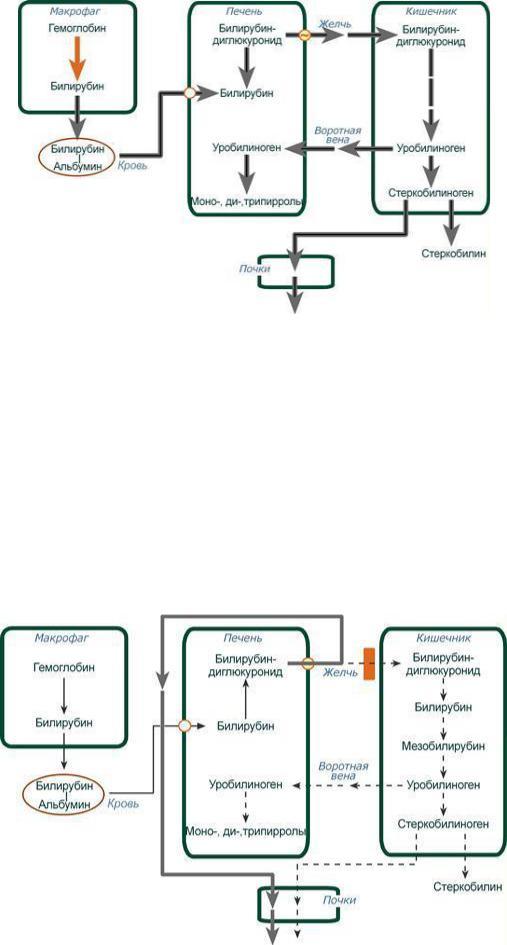
Средний срок жизни эритроцитов составляет 90-120 суток. После этого они разрушаются в кровяном русле или селезенке. Гаптоглобин связывает и транспортирует свободный гемоглобин А; Гемопексин переносит свободный гем, порфирин. Связывает гемсодержащие белки и переносит их в печень для разрушения. Катаболизм гемоглобина начинается в ЭПС костного мозга, селезенки и печени.
Первая реакция катаболизма гема происходит при участии НAДФН-зависимого ферментативного комплекса гемоксигеназы (находится в мембране эндоплазматической сети, в области микросомальных ц.п.э.). Фермент катализирует расщепление связи между двумя пиррольными кольцами, содержащих винильные остатки, - таким образом, раскрывается структура кольца. В ходе реакции образуются линейный тетрапиррол - биливердин (пигмент жѐлтого цвета). Гем индуцирует транскрипцию гена гемоксигеназы, абсолютно специфичной по отношению к гему. Ионы железа, освободившиеся при распаде гема, могут быть использованы для синтеза новых молекул гемоглобина или для синтеза других железосодержащих белков. Биливердин восстанавливается до билирубина НAДФН-зависимым ферментом биливердинредуктазой. Билирубин образуется не только при распаде гемоглобина, но также при катаболизме других гемсодержащих белков.
Билирубин, образованный в клетках РЭС (селезѐнки и костного мозга), плохо растворим в воде, по крови транспортируется в комплексе с белком плазмы крови альбумином. Эту форму билирубина называют неконъюгированным (непрямым, свободным, несвязанным, токсичным) билирубином.
С током крови комплекс «билирубин-альбумин» доставляется в печень. В гладкой эндоплазматической сети гепатоцитов к билирубину присоединяются остатки глюкуроновой кислоты под действием УДФ-глюкуронилтрансферазы – реакции конъюгации. Билирубин имеет 2 карбоксильные группы, поэтому может соединяться с 2 молекулами глюкуроновой кислоты, образуя хорошо растворимый в воде конъюгат - диглюкуронид билирубина (конъюгированный, прямой, нетоксичный, связанный).
Индукторами синтеза УДФ-глюкуронилтрансфераз служат некоторые лекарственные препараты, например, фенобарбитал.
Прямой билирубин с желчью поступает в кишечник, где гидролизуется специфическими бактериальными ферментами βглюкуронидазами, которые расщепляют связь между билирубином и остатком глюкуроновой кислоты. Освободившийся в ходе этой реакции билирубин под действием кишечной микрофлоры восстанавливается с образованием группы бесцветных тетрапиррольных соединений - уробилиногенов. Основная часть уробилиногена выделяется с калом из организма, часть уробилиногена в толстой кишке всасывается и с током крови поступает в почке и выделяется с мочой в форме уробилина (3-4 мг/ сут). В норме большая часть бесцветных уробилиногенов, образующихся в толстой кишке, под действием кишечной микрофлоры окисляется в прямой кишке до пигмента коричневого цвета уробилина и удаляется с калом. Цвет кала обусловлен присутствием уробилина (стеркобилина) (200-300 мг/сут).
158
Деградация прямого билирубина (коротко)
1)В кишечнике прямой билирубин отщепляет УДФ-глюкуроновую кислоту с образованием мезобилирубина
2)Кишечная микрофлора восстанавливает мезобилирубин до уробилиногена
3)Часть уробилиногена(т.е. истинный уробилин) поступает в печень и разрушается до пиррольных соединений
4)Остальной уробилиноген восстанавливается в толстом кишечнике до стеркобилиногена (небольшая часть всасывается и выводится почками)
5)О2 воздуха превращает стеркобилиноген в стеркобилин
При распаде 1 г гемоглобина образуется 35 мг билирубина, а в сутки у взрослого человека - примерно 250-350 мг билирубина. В норме соотношение прямого и непрямого билирубина в крови 1:3 (25% и 75%)
Концентрация общего билирубина в крови здорового человека составляет 1,7-17 мкмоль/л (0,1-1 мг/дл).
Билирубин – токсичное, жирорастворимое вещество, способное разобщать окислительное фосфорилирование в клетках. Особенно чувствительны к нему клетки нервной ткани.
Билирубин и его метаболиты называются желчными пигментами.
Ситуации, при которых в крови накапливается билирубин, в зависимости от причины делятся на
три вида:
•Гемолитические – в результате гемолиза при избыточном превращении гемоглобина в билирубин.
•Печеночно-клеточные – когда печень не в состоянии обезвредить билирубин,
•Механические – если билирубин не может попасть из печени в кишечник из-за механического перекрытия желчевыводящих путей.
Внорме билирубин и его фракции находятся в крови в концентрации не более 20 мкмоль/л, но накопление билирубина в крови свыше 43 мкмоль/л ведет к связыванию его эластическими волокнами кожи и конъюнктивы, что проявляется в виде желтухи. Поскольку свободный билирубин липофилен, то он легко накапливается в подкожном жире и нервной ткани. Последнее очень опасно для детей, особенно для новорожденнных, т.к. происходит резкое нарушение окислительного фосфорилирования
иобразования АТФ в нейронах.
Итак, врожденные и приобретенные нарушения метаболизма и экскреции билирубина носят название гипербилирубинемий (желтух).
ЖЕЛТУХИ
Гипербилирубинемия проявляется в виде желтух – желтой пигментации кожи и слизистых.
Выделяют 3 вида желтух:
o Гемолитическую (надпеченочную) желтуху; o Паренхиматозную (печеночную) желтуху;
o Механическую или обтурационную желтуху.
Гемолитическая (надпеченочная) желтуха – ускоренное образование билирубина в результате усиления внутрисосудистого гемолиза любого происхождения – сепсис, лучевое поражение, несовместимость крови по AB0 или резус-фактору, дефект глюкозо-6-фосфатдегидрогеназы пентозофосфатного пути, отравление гемолитическими ядами (хлорбензол, яд кобры), малярия. У новорожденных желтуха может развиться как симптом гемолитической болезни новорожденного.
Гепатоциты усиленно переводят избыток непрямого билирубина в связанную форму, секретируют его в желчь, в результате в кале увеличивается содержание стеркобилина, интенсивно его окрашивая.
Гемолитические состояния, независимо от причины, имеют характерные проявления – синдром гемолиза.
Биохимическими маркерами синдрома являются:
•Гипербилирубинемия за счет повышения содержания в крови свободного (непрямого) билирубина.
•Интенсивная окраска мочи, обусловленная накоплением в ней пигмента стеркобилина (билирубина и уробилина нет).
•Насыщенный цвет кала за счет увеличенного содержания в нем стеркобилина.
•Низкий уровень гаптоглобина в крови.
•Повышение в сыворотке крови активности лактатдегидрогеназы-5 (из эритроцитов).
159
Механическая (подпеченочная) желтуха развивается вследствие снижения оттока желчи при непроходимости желчного протока (закупорка желчного протока опухолями, желчными камнями). При этом происходит растяжение желчных капилляров, увеличивается проницаемость их стенок и не имеющий оттока в кишечник прямой билирубин поступает в кровь, развивается гипербилирубинемия.
Биохимическими маркерами синдрома холестаза (в "чистом" виде, без повреждения гепатоцитов)
являются:
•Гипербилирубинемия за счёт связанного (прямого) билирубина.
•В моче высокий уровень билирубина (коричневый цвет, цвет темного пива) и снижено количество стеркобилина, уробилина нет.
•В кале практически отсутствует стеркобилин (обесцвеченность, серовато-белое окрашивание).
•Повышение в сыворотке крови активности ферментов, специфичных для желчных канальцев – щелочная фосфатаза (желчный изофермент), 5′-нуклеотидаза, γ-глутамилтранспепти- даза.
•Уменьшение концентрации альбуминов и увеличение содержания α2-, β- и γ-глобулинов в сыворотке крови (протеинограмма для механической желтухи).
Паренхиматозная (печеночно-клеточная) желтуха – причиной может быть нарушение на всех трех стадиях превращения билирубина в печени:
1)извлечение билирубина из крови печеночными клетками,
2)конъюгирование билирубина,
160
