
книги / Теория химических реакторов введение в основной курс
..pdfДиффузия в порах протекает за счет разности концентраций вещества на поверхности гранулы и в центре зерна катализатора. Величина внутреннего потока при стационарном режиме также будет постоянна.
Следует заметить, что фазовое состояние смеси компонентов существенно зависит от их состава. В частности, для процессов гидроочистки и риформинга нефтяных фракций средняя молекулярная масса смеси компонентов внутри пор значительно меньше, чем снаружи гранулы катализатора. Поэтому при наступлении условий конденсации части вещества в жидкую фазу снаружи гранулы, например из-за снижения температуры, внутри пор может сохраняться парообразное состояние компонентов.
Наиболее интенсивно реакции, в том числе и реакции уплотнения с образованием смол, протекают в зоне наиболее высокой концентрации исходных компонентов, т.е. на поверхности или при входе компонентов в поры катализатора. В связи с этим в некоторых случаях наличие жидкой фазы на поверхности гранул может иметь положительное значение, поскольку она может способствовать промыванию входов в поры за счет растворения образующихся смолистых соединений.
Количество вещества, переносимого из «ядра потока» к внешней (out) поверхности сферической гранулы катализатора радиусом R, определяется по уравнению
gout 4 R2 c C0 (Ц0 Ц 1 ) 4 R2 c C0 1 Ц(1) , (158)
где βс – суммарный коэффициент массопереноса; Ц0 = 1 (концентрация в «ядре потока»); Ц(1) – безразмерная концентрация при ρ = 1.
Поскольку, как было сказано ранее, через гранулу катализатора практически нет сквозного протока реагента, в центре зерна образуется застойная зона, время пребывания реагента в которой не определено и может достигать значительной величины. В связи с этим концентрация реагента в центре зерна для рас-
101
сматриваемой химической реакции теоретически может быть близкой к равновесной (уравнение (14) при τ → ∞; k ≠ 0):
С(0) = const; соответственно, Ц(0) = const. |
(159) |
В связи с этим можно сделать обоснованное предположение, что в центре зерна (при ρ = 0) первая производная концентрации по радиусу будет равна нулю:
|
0 |
0 , а также |
|
0. |
(160) |
Cr |
Ц 0 |
Последнее равенство будет далее использовано в качестве одного из краевых условий для определения свободных коэффициентов при нахождении частного решения дифференциального уравнения (157).
Средняя величина градиента концентрации по зерну катализатора может быть оценена как
CR Cr 0 . |
(161) |
R |
|
Однако для составления уравнения баланса на границе зерна катализатора главным является значение градиента концентрации только в приповерхностном слое зерна, которое обеспечивает диффузионное поглощение всего потока вещества, поступающего из «ядра потока».
Записывая уравнение для внутреннего диффузионного потока в виде
|
dC |
|
|
|
4 R2 пDef |
C |
dЦ(1) |
|
(162) |
|
gint 4 R2 пDef |
R |
|
0 |
|
|
|||||
|
dr r R |
|
|
R |
d |
1 |
|
|||
и учитывая, что при стационарном режиме |
gout gint , |
можно за- |
||||||||
писать уравнение баланса на границе зерна: |
|
|
|
|
||||||
|
1 Ц(1) |
|
|
п |
Def dЦ(1) . |
|
|
(163) |
||
|
c |
|
|
Rd |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
102

Это же уравнение после перегруппировки:
1 Ц(1) |
dЦ(1) |
, |
(164) |
||
d |
|||||
|
|
|
|
||
где |
|
|
|
|
|
|
пDef . |
|
(165) |
||
|
c R |
|
|
||
Выражение (164), наряду с (160), является вторым краевым условием для решения дифференциального уравнения второго порядка (157).
7.2. Решение дифференциального уравнения баланса для сферической гранулы пористого катализатора
Рассмотрим вариант уравнения (157) при n = 1. После перестановкислагаемыхигруппировкипостоянныхоноприобретаетвид
d 2 Ц( ) 2 dЦ( ) 2 Ц( ) 0, d 2 d
где
2 R2ks a .
Def п
(166)
(167)
Уравнение (166) значительно упрощается при подстановке z = Ц·ρ.
Отсюда
Ц |
|
|
z |
|
|
z |
|
; Ц |
|
|
z |
|
|
2z |
|
|
2z |
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
2 |
|
|
2 |
|
|
3 . |
(168) |
||||||||
|
|
|
||||||||||||||||
После подстановки значений производных в уравнение (166) получим
z 2 z 0 . |
(169) |
103

Решение этого уравнения с использованием операционного метода приведено в примере 20 из приложения 3:
z( ) A exp( ) |
|
B |
exp( ) |
|
||
|
||||||
2 |
|
|
2 |
(170) |
||
A exp( ) |
|
B |
exp( ) . |
|||
|
|
|||||
|
|
|||||
2 |
|
|
2 |
|
||
Это решение содержит неизвестные постоянные А и В. Для их определениясгруппируемслагаемыеследующимобразом:
D A2 2B ; E A2 2B .
Тогда
z( ) D exp( ) E exp( ),
Ц( ) z( ) D exp( ) E exp( ) ,
Ц D exp( ) E exp( )
D exp( ) E exp( ) .
2
(171)
(172)
(173)
(174)
Используя условие (160) для последнего уравнения, найдем соотношение постоянных D и E:
D E exp( 2 ) ( 1) . |
(175) |
1 |
|
При ρ = 0 можно получить: D = –E. Возвращаясь к выражению (173), путем замены постоянной Е на –D получаем уравнение, описывающее зависимость внутренней концентрации реагента от радиуса гранулы катализатора:
104

|
Ц( ) |
D exp( ) D exp( ) |
|
|||||
|
|
|
|
|
|
|
|
(176) |
|
2D exp( ) exp( ) |
|
2D |
|
||||
|
|
sh( ). |
|
|||||
|
|
2 |
|
|
|
|||
|
|
|
|
|
|
|||
Для определения постоянной D используем второе граничное условие (164). Первая производная Ц(ρ) при использовании для дифференцирования выражения (176):
|
2D |
ch( ) sh( ) . |
(177) |
Ц ( ) |
2 |
После подстановки в уравнение (164) выражений для Ц(ρ) (176) и ее первой производной (177) при ρ = 1 и перегруппировки получаем
D |
1 |
|
2 (1 )sh( ) ch( ) . |
(178) |
Заменяя постоянную D в уравнении (176) на ее найденное значение, получаем окончательное уравнение (Зельдовича), описывающее зависимость концентрации компонента от внутренней координаты и параметров протекающих процессов:
sh( ) |
1 |
|
|
|||
Ц( ) |
|
|
|
. |
(179) |
|
|
(1 )sh( ) ch( ) |
|||||
|
|
|
|
|||
7.3. Анализ работы пористого катализатора
Уравнение Зельдовича (179), описывающее распределение концентрации реагента по радиусу сферического зерна пористого катализатора, выведено на основании ряда ограничений, которые, безусловно, не позволяют рассмотреть многие частные варианты, тем не менее оно дает возможность провести анализ достаточно большой группы факторов, влияющих в целом на химический процесс.
105
Распределение концентрации по радиусу гранулы катализатора зависит от двух комплексных безразмерных величин χ и α, являющихся функциями от нескольких физико-химических параметров процесса. Таким образом, определив влияние на процесс в целом каждого из критериев, можно легко понять влияние на него любого параметра, входящего в эти критерии.
Рассмотрим типичный пример работы гранулы пористого
катализатора при значениях параметров: χп = 0,5; R = 1·10–3 м;
βс = 1·104 м/с; Def = 1·10–7 м2/с; ks = 1·10–8 м/с; γ = 1000 кг/м3; а = 100 000 м2/кг (рис. 32).
|
Расчетная концентрация на |
|
поверхности зерна Ц(1) = 0,365. |
|
Концентрация в диапазоне значе- |
|
ний ρ от 0,01 до 0,00001 остается |
|
постоянной величиной, равной |
|
0,037. Следовательно, первая про- |
|
изводная концентрации от безраз- |
Рис. 32. Распределение |
мерного радиуса ρ при приближе- |
нии его к нулю равна нулю, как это |
|
концентрации реагента |
и принималось ранее при выводе |
по радиусу зерна катализатора |
|
|
уравнения (157). |
Движущая сила процесса массопередачи вещества из потока, омывающего гранулу, к ее поверхности равна разности концентраций в этих двух точках и составляет 1 – 0,365 = 0,635 (в безразмерном выражении). По уравнению (158) может быть легко рассчитана производительностьоднойгранулыкакмикрореактора.
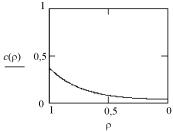
Рассмотрим влияние на эти выходные параметры критериев χ и α. Расчет выполнен при значении α = 0,5, которое получается при подстановке принятых ранее значений параметров. В идентификаторах кривых цифры соответствуют заданной величине критерия Зельдовича – Тиле χ. Результаты расчета демонстрируют сильное влияние критерия χ как на поверхностную концентрацию Ц(1), так и на распределение концентрации реагентов по радиусу гранулы (рис. 33).
106
Одновременно изменяется и эффективность использования внутренней поверхности – при значении χ = 10 уже при ρ = 0,5 концентрация реагента в порах практически равна нулю, т.е. внутренняя поверхность пор используется только наполови-
ну, более глубоко реагенты не |
|
|
проникают. При увеличении χ |
Рис. 33. Влияние критерия |
|
увеличивается также движущая |
||
Зельдовича – Тиле на распределе- |
||
сила процесса внешней массо- |
ние компонента по радиусу зерна |
|
передачи – разность (1 – Ц(1)). |
|
В свою очередь, критерий χ увеличивается при увеличении константы скорости реакции ks, плотности катализатора γ, удельной поверхности катализатора a и радиуса гранулы катализатора R в квадрате, а также при уменьшении пористости зерна χп и коэффициента эффективной диффузии Def в порах катализатора.
1
0 0
20
1
z
Рис. 34. Трехмерное изображение функции Зельдовича: по вертикальной оси аппликат (на заднем плане) – значение безразмерной концентрации Ц(ρ) (от 0 до 1); по оси абсцисс (вправо от оси аппликат) – безразмерный радиус ρ (от 0 до 1); по оси ординат (влево от оси аппликат) – критерий
Зельдовича(Тиле) χ(от0 до20); значениеα= 0,055
107
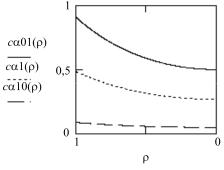
Влияние критерия α на распределение компонента представлено на рис. 35. Расчет выполнен при χ = 2. Цифры в идентификаторах кривых соответствуют значению критерия α. Характер влияния этого параметра внешне совпадает с предыдущим. С другой стороны, значение α увеличивается при возрастании χп или/и коэффициента эффективной диффузии Def, а также при уменьшении коэффициента внешнего массопереноса βс или/и радиуса зерна катализатора R.
Рис. 35. Влияние критерия α на распределение компонента
При большой величине α, что соответствует наименьшему значению коэффициента массопереноса, концентрация реагента по всей длине пор близка к нулю, следовательно, внутренняя поверхность катализатора не работает (см. рис. 35) из-за недостатка сырья. Химическая реакция протекает только на внешней поверхности зерна катализатора. Ранее нами было указано, что она составляет незначительную долю общей поверхности. Этот режим характерен для «быстрых» реакций или возникает в результате полного закупоривания пор катализатора в процессе работы реактора. Иногда такая ситуация может возникнуть из-за слишком медленного движения газа вокруг гранул катализатора в состоянии глубоко ламинарного режима. Такая же ситуация возникает при слишком малой концентрации реагента в сырье. Последнее характерно при проведении реакций в реакторах с неподвижным слоем
108
катализатора: по мере исчерпания сырья его концентрация постепенно уменьшается, что приводит к постепенной смене кинетического режима по длине реактора.
7.4. Кинетические режимы химического процесса на пористом катализаторе
Ранее нами было сделано предположение о влиянии фазового состояния смеси реагентов на характер протекающего химического процесса. Это влияние не ограничивается возможностью промывки входных отверстий в поры катализатора. Существенное влияние на процессы оказывает изменение коэффициента эффективной диффузии.
Для оценки влияния параметра Def рассмотрим три типичных углеводорода (бензол, циклогексан, n-гептан), помещенных в модельную среду: фракцию 200–350 оС западносургутской нефти
(БII + БIII), находящуюся при температуре 623 К в жидком или газообразном состоянии. Вязкость фракции при 350 оС вычислена
на основании справочных данных методом интерполяции и составляет 0,892 сП.
Для жидкого состояния оценку коэффициента диффузии компонента А в растворителе В выполним по уравнению Вильке – Ченга [13]:
D0 |
7,4 10 18 (Ф MB )1/2 T |
, |
(180) |
AB |
V 0,6 |
|
|
|
B A |
|
|
где индекс В относится к растворителю; М – молекулярная масса растворителя; ηВ – вязкость растворителя, сП; VА – мольный объем растворенного вещества (см3/моль) в точке кипения; Ф – параметр ассоциации растворителя (при высокой температуре примем его за 1); Т – температура, К.
Мольныеобъемыопределимпо аддитивномуметодуШредера. Коэффициент диффузии молекул А в среде В в парообразном состоянии определим по методу Фуллера – Шлеттера – Гид-
дингса по уравнению
109

D |
|
10 |
|
T |
|
MA |
MB / MA |
MB |
1 |
|
(181) |
|
|
|
, |
||||||||||
|
|
|
|
3 |
|
1,75 |
|
|
|
2 |
|
|
AB |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
1 |
2 |
|
|
|
|
|
|
|
|
|
P VA 3 |
VB 3 |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
где МА и МВ – молекулярные массы; Р – давление, атм (принято
30 атм).
Результаты расчета представлены в табл. 6.
Таблица 6
Коэффициенты диффузии углеводородов в различных средах
Углеводород |
|
D, м2/с |
Отношение |
|
А в жидком В |
|
А в газообразном В |
газ/жидкость |
|
|
|
|
|
|
Бензол |
4,79·10–9 |
|
290·10–9 |
60,5 |
ц-Гексан |
4,23·10–9 |
|
270·10–9 |
63,8 |
n-Гептан |
3,42·10–9 |
|
232·10–9 |
67,8 |
Начальные концентрации реагента в газообразном и жидком состояниях также существенно отличаются. Среднее значение молекулярной массы для выбранной фракции, рассчитанное по формулам Крэга и Воинова, составляет 196. Для n-гептана М = 100. Пусть исходное мольное содержание n-гептана в парообразном состоянии было 10 %. При давлении 30 атм и температуре 623 К в 1 м3 смеси может находиться примерно 587 г-моль вещества в газообразном состоянии (уравнение Менделеева – Клапейрона). Таким образом, для гептана С0г = 58,7 моль/м3. Плотность фракции при 350 оС около 575 кг/м3. Примесь гептана изменит эту величину незначительно. Следовательно, в 1 м3 жидкого раствора содержится 575 000/196 = 2936 г-моль углеводородов. На долю гептана (С0ж) приходится более 300 г-моль/м3.
На рис. 36 показано, как распределяется концентрация реагента по радиусу зерна катализатора при параметрах процесса, соответствующих рис. 32, кроме коэффициентов диффузии, которые
110
