
Методы мол-ген иссл
.pdf1 |
2 |
3 |
4 |
Спин-колонки |
Любые |
Быстрый, простой и |
Дорогой, срав- |
|
|
безопасный. Можно |
нительно невы- |
|
|
менять фильтры и от- |
сокий выход |
|
|
делять геномную ДНК |
|
|
|
от плазмидной или |
|
|
|
РНК. |
|
Высаливание |
Кровь, |
Бюджетный, безопас- |
Может занять |
|
культура |
ные реагенты |
много времени |
|
клеток, го- |
|
|
|
могенат |
|
|
Ферменты |
Любые |
Прост, безопасен, |
Дороже по |
|
|
дает хорошее каче- |
расходным |
|
|
ство и выход НК |
материалам, |
|
|
|
иногда требу- |
|
|
|
ет длительной |
|
|
|
инкубации |
Фенол- |
Любые |
Хороший выход и |
Токсичные ре- |
хлороформ |
|
качество НК |
агенты, дли- |
|
|
|
тельность |
Магнитные ча- |
Любые |
Прост, быстр, точен, |
Требуется |
стицы |
|
безопасен |
настройка |
|
|
|
магнитного |
|
|
|
прибора |
Стеклянные |
Любые |
Можно комбиниро- |
Загрязнение |
бусины |
|
вать с нетоксичными |
итогового |
|
|
буферами, хороший |
элюата |
|
|
выход |
бусинами |
Chelex-100 |
Любые |
Быстрый, |
Не удаляет |
|
|
экономичный, |
примеси доста- |
|
|
безопасный |
точно для |
|
|
|
дальнейшего |
|
|
|
использования |
|
|
|
с применением |
|
|
|
многих других |
|
|
|
методов |
SmartExtraction |
Любые |
Нет необходимости в |
|
|
|
большом количестве |
|
|
|
оборудования, не ток- |
|
|
|
сичен, хороший выход |
|
Ферментативное |
Любые |
Быстрый, недорогой |
Для |
температурно- |
|
|
небольшого |
зависимое |
|
|
количества |
|
|
|
образца |
Фильтровальная |
Любые |
Экономичен, прост, |
Не работает с |
бумага |
|
безопасен, хороший |
малыми объе- |
|
|
выход |
мами |
12
1.Экспресс-методы (используются для выделения ДНК) базируются на температурном лизисе клеток и последующем центрифугировании, в результате которого нерастворимые компоненты осаждаются на дне пробирки, а надосадочная жидкость (супернатант), содержащая ДНК, используется для проведения ПЦР.
Метод прост в использовании, занимает не более 10-15 минут, обеспечивает максимальный выход ДНК, но малоэффективен при работе с материалом, содержащим высокое количество примесей и ингибиторов ПЦР. Кроме того, метод не может быть использован для выделения РНК, так как РНКазы устойчивы к нагреванию.
При необходимости использования экспресс-методов со «сложными» образцами возможно введение дополнительных способов очистки и концентрации материала, например в случае избытка слизи в пробе (для мокроты и эякулята, бронхоальвеолярного лаважа, промывных вод бронхов, трахеального смыва, синовиальной и плевральной жидкости) целесообразными являются предварительная отмывка и обработка муколитиками.
Более эффективным методом выделения и очистки нуклеиновых кислот (НК) при работе с таким материалом может быть использование сорбентов или сильных хаотропных агентов.
2.Сорбентные методы выделения – дифференциальная сорбция нуклеиновых кислот (допустимо выделение как ДНК, так и РНК) на твердом носителе (чаще всего: силикагель с повышенным отрицательным зарядом или модифицированной поверхностью, стеклянные бусы, диатомовая земля, стеклянное «молоко» и т. д.). Нуклеиновая кислота обратимо связывается со стеклом в присутствии высокой концентрации хаотропных солей (например гуанидин тиоцианат). Ингибиторы и другие компоненты клинического материала остаются в растворе. Кроме хаотропных солей в лизирующем буфере чаще всего присутствуют детергенты, которые способствуют растворению и лизису белков. С помощью центрифугирования силика с НК осаждается, а супернатант c ингибиторами ПЦР удаляется. Серия последующих отмывок обеспечивает получение высокоочищенного препарата НК.
Актуальная на данный момент модификация сорбентного метода – выделение на магнитных частицах в ручном или автоматическом режимах. Использование магнитных твердых носителей имеет ряд преимуществ по сравнению с немагнитными сепарационными методами.
В основе магнитных частиц (магнетит или маггемит): железосодержащие минералы, на поверхность которых нанесено кремнеземное покрытие (могут быть задействованы функциональные группы - например, гидроксильные). Нуклеиновые кислоты связываются с кремниевым покрытием в присутствии хаотропных солей, например хлорида гуанидина. Он нарушает целостность молекулы ДНК, что приводит к потере гидрофобности и связыванию нуклеиновых кислот. Магнитные частицы с нуклеиновыми кислотами на поверхности отделяются от клеточного лизата путем создания магнитного
13
поля внешним магнитом со стороны дна пробирки. Таким образом, частицы собираются на дне, а остальной раствор можно легко удалить. После промывки и инкубации при 65 °C нуклеиновые кислоты отделяются от магнитных частиц и могут быть использованы в дальнейших экспериментах. Метод отличается быстротой и достаточно высоким выходом нуклеиновых кислот надлежащего качества. Он хорош для автоматизации высокопроизводительных процессов, поскольку не требует центрифугирования и большого количества оборудования
Вцелом сорбентные методы обеспечивают высокую степень очистки нуклеиновых кислот, но могут быть сопряжены с потерями (особенно в случае низкого содержания в образце – «низкокопийный образец») вследствие необратимой сорбции на носителе или в процессе нескольких промывок. Кроме того, остаточное количество сорбента в конечном растворе ДНК может ингибировать ферментативные реакции ПЦР.
3. Спиртовое осаждение (преципитация) – агрегация НК (как ДНК,
так и РНК) в присутствии соли и спирта. После осаждения спиртом НК отделяется от раствора центрифугированием. Осадок, содержащий целевую НК, неоднократно промывается спиртами и концентрируется центрифугированием. На завершающем этапе процедуры происходит растворение НК в водном буфере, часто в процессе нагревания до 55–65 °С для лучшего растворения осадка. Преимуществом данной технологии является возможность работы со «сложными» образцами, выделять в равной степени как ДНК, так и РНК, однако спиртовое осаждение приводит к преципитации не только НК, но и белков, что в свою очередь затрудняет получение чистого препарата. Наиболее простым путем решения проблемы с нежелательными примесями является уменьшение объема анализируемого образца, однако такой подход неприменим, если необходимо получить результат с максимальной чувствительностью. Для обеспечения качества процесса выделения важно учитывать не только «сложность» материала для исследования и, исходя из этого, подбирать наиболее эффективный метод экстракции, но и особенности целевой нуклеиновой кислоты.
ДНК является достаточно стабильным субстратом, медленнее разрушается под действием ДНКаз, лучше сохраняется при транспортировке и хранении образца и допускает применение длительных методик выделения с использованием большой партии образцов. Напротив, РНК – нестабильный продукт, легко деградирует в условиях длительной транспортировки и хранения без дополнительной стабилизации в специальных средах.
Вусловиях неавтоматизированных методик экстракции выделение нестабилизированной РНК лучше проводить небольшими партиями, исходя, например, из емкости имеющихся в ПЦР-лаборатории центрифуг, чтобы избежать деградации РНК в промежутках между этапами отмывок и центрифугирования.
14
Таким образом, к выбору метода подготовки пробы к ПЦР следует подходить с пониманием целей проведения предполагаемых анализов и особенностей материала для исследования.
4. Выделение ДНК фенол-хлороформом известно еще с 1998 года. Метод оказался чрезвычайно полезен при работе со «сложными» вариантами начального материала, например, тканями, в которых много разных органических соединений. Так, многие лекарственные растения, например, широко распространенный тысячелистник обыкновенный, содержат дубильные вещества и смолы, поэтому «классический» подход к выделению в этом случае не сработает.
Принцип метода достаточно прост: после лизирования к образцу добавляют фенол-хлороформ-изоамиловый спирт. Фенол разрушает белки, изоамиловый спирт помогает в осаждении ДНК, а хлороформ увеличивает плотность органической примеси и предотвращает переход фенола в водную фазу, где он может нарушить целостность молекул ДНК. При перемешивании на дно пробирки оседают в первую очередь гидрофобные клеточные компоненты, например, белки. ДНК в водной части переносится в другую пробирку для дальнейшего использования или, например, концентрирования переосаждением в спирте.
При выделении РНК метод остается прежним с одним отличием: в нем используется фенол с кислым pH (например, 4), в то время как при выделении смеси ДНК и РНК используют фенол с pH=8. При значении pH=4 ДНК остается на границе водной и фенольной фаз, а РНК — в водной фазе
Выделение нуклеиновых кислот из замороженной крови стандартным методом фенольно-хлороформной экстракции можно рассмотреть на примере набора для выделения ДНК ООО НПФ «АТГ-Биотех».
1.Приготовить стоковый раствор протеиназы К. Для этого в пробирку, содержащую 15 мг протеиназы К, добавить по 750 мкл деионизованной воды и перемешать до полного растворения фермента. Раствор разлить на аликвоты объемом 20 - 40 мкл и хранить при -20 °С.
2.Размороженные образцы крови встряхнуть на вихревом смесителе и поставить в лед. Раствор 1 (2-х лизирующий буферный раствор) прогреть при комнатной температуре (18-25°С) до полного растворения осадка. Если исследуемый материал представляет собой жидкий раствор (кровь, сыворотку, экстракт), в полипропиленовую пробирку вместимостью 1,5 мл внести 50 мкл крови и 50 мкл охлажденной во льду деионизованной воды, перемешать на вихревом смесителе в течение 3-5 сек. В пробирку добавить 100 мкл Раствор 1 (2-х лизирующий буферный раствор) и 4 мкл стокового раствора протеиназы К до конечной концентрации 200 мкг/мл. Перемешать на вихревом смесителе в течение 3-5 сек.
3.Если исследуемый материал представляет собой пятна биологических жидкостей (крови) на твердом носителе, материал-носитель поместить в чистую полипропиленовую пробирку вместимостью 1,5 мл и добавить
15
100 мкл деионизованной воды, 100 мкл Раствора 1 (2-х лизирующий буферный раствор) и 4 мкл стокового раствора протеиназы К до конечной концентрации 200 мкг/мл. Плавно перемешать в течение 3-5 сек при комнатной температуре, сбросить капли на вихревом смесителе.
Примечание. При лизисе спермальных клеток в лизирующий раствор следует добавлять 9 мкл раствора 8 (2М р-меркаптоэтанола) до конечной концентрации 80 мМ.
4.Пробирки инкубировать в термостате при 55оС в течение 1 ч.
5.Добавить 200 мкл (равный объем) Раствора 2 (смесь фенола с хлороформом), перемешать на вихревом смесителе в течение 10 сек и центрифугировать при комнатной температуре в течение 5 мин при 10000 - 12000 об/мин (10000 - 13000 g). Внимание! Растворы 2 (смесь фенола с хлороформом) и 3 (хлороформ) находятся под слоем буферного раствора. Для выделения ДНК необходимо использовать нижнюю (органическую) фазу.
6.Отобрать верхнюю (водную) фазу и внести ее в полипропиленовую пробирку вместимостью 1,5 мл. В эту пробирку добавить 200 мкл (равный объем) Раствора 3 (хлороформ).
7.Перемешать на вихревом смесителе в течение 3-5 сек и центрифугировать при комнатной температуре в течение 2 мин при 10000 - 12000 об/мин
(10000 - 13000 g).
8.Отобрать водную фазу (200 мкл) и внести ее в полипропиленовую пробирку вместимостью 1,5 мл. В эту пробирку добавить 40 мкл (1/5 объема водной фазы) Раствора 4 (ацетат аммония) и 720 мкл (3 объема) Раствора 5 (спирт этиловый 96%). Перемешать на вихревом смесителе в течение 3- 5 сек.
9.Инкубировать при -20°С в течение 40 мин.
10.Центрифугировать при комнатной температуре в течение 15 мин при
12000 об/мин (13000 g).
11.Супернатант удалить. В пробирку внести 100 мкл Раствора 6 (спирт этиловый 75%).
12.Центрифугировать в течение 1 мин при комнатной температуре при
12000 об/мин (13000 g).
13.Супернатант удалить. Осадок подсушить на воздухе в течение 15 мин.
14.Растворить осадок в 50 мкл Раствора 7 (ТЕ-буфер). Раствор ДНК хранить при -20°С.
5.Спин-колонки - это модифицированные пробирки, в которых объем пробирки разделен фильтром из силиката (кремнозема). Ранее уже было показано, что ДНК связывается с силикатом в присутствии холотропных солей; этот принцип и был использован в процессе создания спин-колонок. Новый подход задействовал простые и доступные материалы и позволял выделять нуклеиновые кислоты достаточно высокого качества. Впервые использование кремнезема (силиката) при работе с ДНК описали в 1979 г. Б. Фогельштейн и Д. Гиллеспи. Они показали, что в буферном растворе, содержащем
16
NaCl, нуклеиновые кислоты могут связываться с поверхностью кремнезема. Соответственно, «заякоренные» таким образом молекулы ДНК можно отмыть от примесей и дальше «открепить» от носителя при помощи элюирующего буфера или дистиллированной воды.
Суть метода заключается в связывании молекул нуклеиновых кислот с иммобилизованным кремнием в колонке. Образец сперва подвергают лизису (и здесь все стандартно), а после лизат взаимодействует с кремнием в спинколонке. Для прохождения лизата через кремниевый фильтр пробирку центрифугируют. Затем следуют этапы промывки, далее нуклеиновые кислоты элюируют. Весомым достоинством метода в настоящее время стала возможность использовать разные фильтры, которые способны отделять друг от друга геномную и плазмидную ДНК, а также РНК.
6. Использование стеклянных бусин необходим при получение длинных неповрежденных фрагментов ДНК. Одним из подходов, позволяющих минимизировать повреждения, является использование стекляных бусин. Они добавляются в образец после лизиса одновременно с добавлением спирта. Геномная ДНК прикрепляется к ним, как и в случае со спинколонками, в присутствии хаотропных солей, вот только гладкая поверхность бусин позволяет линейной ДНК оборачиваться вокруг, сохраняя свою целостность.
Захват ДНК на поверхности стеклянных шариков упрощает этапы промывки и элюирования, устраняя необходимость в длительных этапах сушки. Держатель не дает шарикам соскользнуть, тогда как растворы быстро и эффективно удаляются из образца при вращении пробирки. После окончания всех этапов промывки ДНК удаляется с поверхности шариков нагреванием до 56°C.
17
3.ПОЛИМЕРАЗНАЯ ЦЕПНАЯ РЕАКЦИЯ
ПРИГОТОВЛЕНИЕ РЕАКЦИОННЫХ СМЕСЕЙ ДЛЯ АМПЛИФИКАЦИИ
Для проведения реакции амплификации необходимо приготовить реакционную смесь и внести в нее анализируемый образец ДНК. При этом важно учитывать некоторые особенности отжига праймеров. В анализируемом биологическом образце присутствуют разнообразные молекулы ДНК, к которым используемые в реакции праймеры имеют частичную, а в некоторых случаях значительную, гомологию. Кроме того, праймеры могут отжигаться друг с другом, образуя праймер-димеры. И то, и другое приводит к значительному расходу праймеров на синтез побочных (неспецифических) продуктов реакции и, как следствие, значительно уменьшает чувствительность системы. Это затрудняет или делает невозможным учет результатов реакции при проведении электрофореза.
Компоненты реакционной смеси
Для проведения полимеразной цепной реакции необходимо наличие в реакционной смеси ряда компонентов:
Праймеры - искусственно синтезированные олигонуклеотиды, имеющие, как правило, размер от 15 до 30 п.н., идентичные соответствующим участкам ДНК-мишени. Они играют ключевую роль в образовании продуктов реакции амплификации. Правильно подобранные праймеры обеспечивают специфичность и чувствительность тест-системы и должны отвечать следующим критериям:
-быть специфичными - особое внимание уделяют 3'-концам праймеров, так как именно с них Taq-полимераза начинает достраивать комплементарную цепь ДНК. При недостаточной специфичности праймеров в процессе ПЦР будут образовываться продукты, которые, с одной стороны, могут быть идентифицированы как ложноположительный результат, а с другой стороны, на процессы их накопления будут расходоваться компоненты реакционной смеси, что приведет к значительной потере чувствительности реакции как таковой;
-не должны образовывать димеры и петли – устойчивые двойные цепи – при отжиге праймеров самих на себя или друг с другом;
-область отжига праймеров должна находиться вне зон мутаций, делеций или инсерций в пределах видовой или иной специфичности, взятой в качестве критерия при выборе праймеров. При попадании в такую зону не происходит отжига праймеров и, как следствие, возникает ложноотрицательный результат.
ДНК-зонд - фрагмент ДНК, меченный различным образом и использующийся для гибридизации со специфическим участком молекулы ДНК и позволяющие идентифицировать комплементарные ему нуклеотидные последовательмости. Для мечения зонда могут быть использованы хромофоры,

18
делающие возможным детектирование в ходе последующей ферментативной реакции.
Taq-полимераза - термостабильный фермент, обеспечивающий достраивание 3'-конца второй цепи ДНК согласно принципу комплементарности.
Смесь дезоксинуклеотидтрифосфатов (дНТП) - дезоксиаденозин-
трифосфата (дАТФ), дезоксигуанозинтрифосфата (дГТФ), дезоксицитозинтрифосфата (дЦТФ) и дезокситимидинтрифосфата (дТТФ) — «строительный материал», используемый Taq-полимеразой для синтеза второй цепи ДНК.
Буфер - смесь катионов и анионов в определенной концентрации, обеспечивающих оптимальные условия для реакции, а также стабильное значение рН.
Анализируемый образец - подготовленный к внесению в реакционную смесь препарат, который может содержать искомую ДНК, служащую мишенью для последующего многократного копирования. При отсутствии ДНК-мишени специфический продукт амплификации не образуется.
Положительный контроль позволяет удостовериться, что все компоненты, входящие в состав реакционной смеси, обеспечивают нормальное прохождение реакции. Для этого используют препарат ДНК с заведомо известным генотипом. Неспецифические ампликоны отличаются по размеру от ампликонов, образуемых в результате амплификации с контрольным препаратом ДНК. Они могут быть как большего, так и меньшего размера по сравнению с положительным контролем. В худшем случае их размеры могут совпадать и читаются в электрофорезе как положительные.
Для контроля специфичности образуемого продукта амплификации можно использовать гибридизационные зонды, меченые флюоресцентными метками и взаимодействующими с ДНК в соответствии с теми же принципами, что и праймеры.
Отрицательный контроль включает в себя все компоненты реакции, но вместо клинического материала или препарата ДНК вносится соответствующее количество деионизованной воды, не содержащего исследуемой ДНК. Отрицательный контроль необходим для проверки компонентов реакции на отсутствие в них ДНК или клеток возбудителя вследствие контаминации и исключения учета ложноположительных результатов.
МЕХАНИЗМ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ
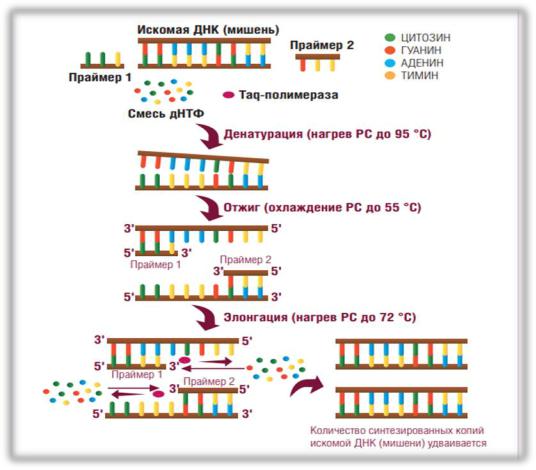
Если в анализируемом образце присутствует искомая ДНК, то в процессе реакции амплификации с ней происходят изменения, которые обеспечиваются определенными температурными циклами. Каждый цикл амплификации состоит из трех этапов (рис. 1):
1.Денатурация. На первом этапе необходимо расплести двойную цепь ДНК, находящуюся в образце. Для этого реакционную смесь нагревают
19
до 92-950С, в результате чего двухцепочечные молекулы ДНК расплетаются с образованием двух одноцепочечных молекул.
2.Отжиг. На втором этапе праймеры присоединяются к одноцепочечной ДНК-мишени. Этот процесс носит название «отжиг» (от англ. «annealing»), Праймеры подбирают так, что они ограничивают (фланкируют) искомый фрагмент и комплементарны противоположным цепям ДНК.
Отжиг происходит в соответствии с правилом комплементарности Чаргаффа, означающим, что в двухцепочечной молекуле ДНК напротив аденина всегда находится тимин, а напротив гуанина - цитозин. Если это условие не соблюдено, то отжига праймеров не происходит.
После отжига праймеров Taq-полимераза начинает достраивание второй цепи ДНК с 3'-конца праймера.
3.Элонгация (синтез). На третьем этапе температуру в реакционной смеси
доводят до оптимума работы Taq-полимеразы, и синтез второй цепи продолжается с максимальной эффективностью.
Иногда, в случае близкого значения температуры отжига праймеров и температуры оптимума работы фермента, становится возможным использовать двухэтапный ПЦР, совместив отжиг и элонгацию.
Температурный ЦИКЛ амплификации многократно повторяется (30 и более раз). На каждом цикле количество синтезированных копий фрагмента ДНК удваивается.
Результатом циклического процесса является экспоненциальное увеличение количества специфического фрагмента ДНК, которое можно описать формулой:
А = М*(2n- n-1)~2n,
где А – количество специфических (ограниченных праймерами) продуктов реакции амплификации; М – начальное количество ДНК-мишеней;
n – число циклов амплификации.
Реальное значение эффективности отдельных циклов амплификации составляет, по некоторым данным, 78–97%. Если в пробе присутствуют ингибиторы реакции, это значение может быть намного меньше, поэтому фактическое количество специфических продуктов амплификации лучше описывает формула:
А = М*(1+Е)n,
где Е – значение эффективности реакции.
Таким образом, специфические фрагменты, ограниченные на концах праймерами, впервые появляются в конце второго цикла, накапливаются в геометрической прогрессии и очень скоро начинают доминировать среди продуктов амплификации.
Эффект плато. Процесс накопления специфических продуктов амплификации по геометрической прогрессии идет лишь ограниченное время, а затем его эффективность критически падает – проявляется эффект плато.
20
Термин «эффект плато» используют для описания процесса накопления продуктов ПЦР на последних циклах амплификации, когда количество ампликонов достигает 0,3–1 пмоль.
На достижение эффекта плато влияют:
1)утилизация субстратов (дНТФ и праймеров);
2)стабильность реагентов (дНТФ и фермента);
3)количество ингибиторов, включая пирофосфаты и ДНК-дуплексы;
4)неспецифические продукты и праймер-димеры, конкурирующие за праймеры, дНТФ и полимеразу;
5)концентрация специфического продукта за счет неполной денатурации при высокой концентрации ампликонов.
Рис. 1. Основные этапы ПЦР.
ВАРИАНТЫ ПЦР
1.ПЦР с горячим стартом (англ. hot-start PCR) – модификация метода, направленная на предотвращение неспецифического взаимодействия компонентов реакционной смеси до достижения оптимальных условий амплификации.
