
4 курс / Акушерство и гинекология / Егорова_Е_С_Основные_принципы_ведения_беременных_с_анемией_и_тромбофилией
.pdf
Рисунок 15
Инфекционный профиль обследованных пациенток с анемией и отягощенным акушерско-гинекологическим статусом.
|
|
18,8 |
|
|
|
|
|
|
|
|
|
|
57,1 |
|
7,6 |
|
|
|
|
|
|
|
|
|
|
|
59 |
|
5,6 |
|
|
|
|
|
|
3,4 |
|
|
|
|
|
|
7,1 |
|
|
|
|
|
|
|
|
|
|
50,8 |
|
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
миксинфекция (спец. возбудители) |
хламидиоз |
|
|
||
|
уреаплазмоз |
|
|
микоплазмоз |
|
|
|
кандидоз |
|
|
трихомониаз |
|
|
|
условно-патогенная флора |
|
ЦМВ, ВПГ |
|
|
|
Таблица№23
Инфекционный профиль обследованных пациенток с анемией и
отягощенным акушерско-гинекологическим статусом.
Заболевания |
|
|
|
|
(n=112) |
|
|
|
|
|
|
Цервицит |
8 |
|
7,1% |
|
|
||
хламидийный |
|
|
|
4 |
|
3,4% |
|
|
|
||
уреаплазменный |
|
|
|
6 |
|
5,6% |
|
микоплазменный |
|
||
|
|
|
|
|
|
|
|
Микс-инфекция |
57 |
|
50,8% |
|
|
|
|
90

Неспецифическая инфекция |
|
64 |
|
57,1% |
|
||
стафилококк, стрептококк, |
|
|
|
|
|
|
|
кишечная палочка) |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Вирусные агенты (ЦМВ, ВПГ) |
|
21 |
|
18,8% |
|
||
|
|
|
|
|
|
|
|
Таким |
образом, |
у |
обследованных |
пациенток в абсолютном |
|||
большинстве |
случаев |
зафиксирован высокий инфекционный индекс, |
|||||
наиболее часто –у 64 (57,1%) женщин диагностирована специфическая микс-
инфекция и активация условно-патогенной флоры, в 18,8% диагностирована цитомегаловирусная инфекция и инфицирование вирусом простого герпеса..
Анемия была выявлена у 100% женщин II группы, при том, что 52,1%
пациенток этой группы указывали на профилактический прием препаратов железа с ранних сроков беременности.
Таблица№24
Гематологические, феррокинетические и эритрокинетические показатели у проспективной и контрольной группы (M SЕ)
Триместры |
II группа |
Контрольная |
|
(n=112) |
Группа |
|
|
(n=150) |
Гемоглобин |
88,1±3,7 |
132,5±2,5 |
(г/л) |
|
|
RBC(х1012/л) |
3,6±0,9 |
4,0±0,07 |
Ht, % |
31,8±0,55 |
39±0,6 |
(ЦП) |
< 0,84 |
< 0,95 |
|
|
|
СЖ, мкмоль/л |
14,8±1,4 |
16,9±1,8 |
ТФ, г/л |
2,01±0,11 |
2,82±0,25 |
Ферритин |
12,7±4,8 |
15,7±4,8 |
сыворотки |
|
|
(мкг/л) |
|
|
СФ, мкг/л |
94,1±13,7 |
56,4±8,3 |
ЭПО,мМЕ/мл |
22,4±4,4 |
42,5±11,5 |
91
ОЖСС |
89,7±6,7 |
82,2±3,1 |
|
(мкмоль/л) |
|||
|
|
||
|
|
|
Анемия легкой степени выявлена у 78 (69,4%) женщин, средней степени – у 32 (28,5%), тяжелой степени – у 2 (1,8%) больных. Степень тяжести анемии оценивался по уровню гемоглобина в сыворотке крови,
согласно общепринятой классификации: I степень или легкая – уровень гемоглобина менее 120 до 90 г/л, II степень (средняя) – гемоглобин 89–70 г/л, III степень (тяжелая) – гемоглобин менее 70 г/л. Анемия у 70,6 % больных была, гипохромной, с достаточно низким содержанием уровня СЖ,СФ, КНТ,
на фоне повышения ОЖСС, ЛЖСС, что доказывало железодефицитный генез анемии.
У 29,4% пациенток с сопутствующей гипергомоцистеинемией был выявлен дефицит фолатов в организме, что, вероятно, и было причиной развития анемии. В абсолютном большинстве наблюдений-89,9% анемия была нормохромной, в 6,3% гипохромной, что могло быть связано с дефицитом железа в организме, маскирующего и усугубляющего дефицит фолиевой кислоты, приводящих к развитию анемии.
Дефицит железа имел место у 91,2% пациенток с анемией, в то время как основные проявления железо-дефицитной анемии (микроцитарная гипохромная анемия) выявлены только у 46,9%. В остальных случаях сниженный уровень железа сопровождал нормохромную анемию с нормальными размерами эритроцитов. В этих случаях наблюдалось сочетание дефицита железа и фолатов, что, по-видимому, маскировало специфические лабораторные признаки каждого из них.
Принимая во внимание отягощенный акушерско-гинекологический анамнез, мы проводили анализ состояния системы гемостаза у больных проспективной группы. Анализ состояния системы гемостаза включал оценку как результатов глобальных общеоценочных тестов – АЧТВ,
протромбиновый индекс, агрегационная активность тромбоцитов, РКМФ,
92

парус-тест, тромбоэластограмма, - так и молекулярных маркеров тромбофилического состояния. Показатели общеоценочных тестов в большей степени использовались для оценки риска геморрагических осложнений и в меньшей степени – тромботических, в то время как
молекулярные маркеры |
тромбофилии – комплексы тромбин-антитромбин |
||||
(ТАТ), |
фрагменты |
F1+2 |
протромбина, |
продукты |
деградации |
фибрина/фибриногена (ПДФ, в частности D-димер) – для |
оценки риска |
||||
тромботических осложнений. |
|
|
|
||
Анализируя состояния системы гемостаза, |
мы обнаружили наличие |
||||
тромбофилического состояния у 112 (100%) обследованных пациенток проспективной группы.
У всех пациенток имелось |
повышение средней концентрации |
комплексов ТАТ, F1+2 (таблица 10), |
свидетельствующей о наличии у них |
тромбофилии и повышенного риска развития тромбоэмболических
осложнений при беременности. |
|
|
|
Помимо ТАТ и F1+2, у наших |
больных также было |
повышено |
|
содержание |
продуктов деградации |
фибрина/фибриногена |
(ПДФ), в |
частности D-димера, фрагментов X-Y и фибринмономеров. Таким образом, у
пациенток проспективной группы обнаружились признаки активации внутрисосудистого свертывания крови, соответствовавшие хронической
(компенсированной) форме ДВС-синдрома.
Таблица№25
Показатели системы гемостаза во II группе и группе контроля.
Показатели |
II А группа (до |
II В группа (до |
Контрольная |
|
терапии) n=62 |
терапии) n=50 |
группа n=150 |
||
|
||||
АЧТВ (сек) |
26,9±1,5 р<0,05 |
27,6±1,4 р<0,05 |
36,4,±0,6 |
|
ТЭГ |
|
|
|
|
r+k |
14,9±0,9 р<0,05 |
14,3±0,8 р<0,05 |
22,1 1,6 |
|
ИТП (у.е.) |
29,9±3,5 р<0,05 |
27,3±3,2 р<0,05 |
29,1±1,7 |
93
Агрегация тромбоцитов: |
|
|
|
АДФ 1×10-3 М (%) |
58,8±4,5 р<0,05 |
67,6±3,4 р<0,001 |
38,4±1,6 |
Ристомицин 1×10-3 М (%) |
59,9±3,8 р<0,05 |
69,1±3,9 р<0,05 |
41,6±2,0 |
Фибриноген (г/л) |
4,3±0,2 р<0,05 |
4,2±0,2 р<0,05 |
3,7±0,1 |
НО («Парус»-тест), абс.ед. |
1,2±0,1 р<0,05 |
1,1±0,1 р<0,05 |
1,4±0,1 |
ТАТ (нг/мл) |
5,2±0,4 р<0,05 |
6,8±0,3 р<0,05 |
3,4±0,1 |
Д-димер (мкг/мл) |
1,9±0,2 р<0,05 |
2,3±0,2 р<0,05 |
0,3±0,1 |
Причиной тромбофилического состояния у данной категории больных были сопутствующие экстрагенитальные заболевания, беременность также могла явиться тригерром, потенцирующей факторы, обуславливающие различные нарушения в системе гемостаза по типу гиперкоагуляции. С
целью выяснения дополнительных причин тромбофилии пациенткам II
группы, с отягощенным личным и/или семейным тромботическим анамнезом, длительным бесплодием и невынашиванием беременности, с
многочисленными неудачными попытками ЭКО, имеющих такие осложнения беременности, как гестоз, ПОНРП, антенатальную гибель плода,
мы проводили дополнительные исследования, включавшие выявление антифосфолипидных антител и генетических дефектов гемостаза,
предрасполагающих к тромбозу.
Проведенное нами исследование у женщин с анемией и отягощенным акушерско-гинекологическим статусом показало наличие генетических форм тромбофилии в абсолютном большинстве –у 109 (97,32%) пациенток.
Мы обнаружили мутацию гена MTHFR C677T - у 36 (32,1%), из них гомозиготная форма - у 12 (10,71%), а гетерозиготная - у 24 (21,42%)
пациенток, гипергомоцистеинемия и гомоцистурия диагностированы у
39(34,82%) пациенток, имеющих мутацию гена MTHFR C677T.
Мутация FV Leiden была обнаружена у 11 (9,82%). Гомозиготная форма мутации выявлена у 3(2,67%) пациенток. Гетерозиготная форма была обнаружена у 8 (7,14 %) пациенток.
94
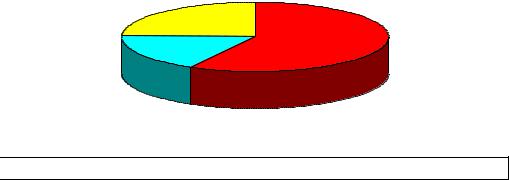
Полиморфизм гена PAI-1, он был диагностирован у 57 (50,89 %)
пациенток. Гомозиготная форма мутации выявлена у 7(6,25%) пациенток.
Гетерозиготная форма была обнаружена у 50 (44,64 %) пациенток.
Циркуляция АФА выявлена у 47 (41,96%) пациенток.
Рисунок 16
Спектр генетической тромбофилии у пациенток II А группы
24%
58%
18%


 мутация гена MTHFR
мутация гена MTHFR  Мутация FV Leiden
Мутация FV Leiden 
 Полиморфизм гена PAI-1
Полиморфизм гена PAI-1
Таким образом, высокая частота тромбофилии у обследуемых женщин позволила нам рассматривать ее в качестве важнейшего этиопатогенетического фактора развития акушерских осложнений у женщин с анемией и отягощенным акушерско-гинекологическим анамнезом, что диктует необходимость подбора оптимальной и безопасной терапии,
направленной на компенсацию возникших нарушений.
Анализ исходов беременности в проспективной группе, где применялось патогенетически обоснованное противотромботическое лечение с фертильного цикла и ранних сроков беременности или со II и III триместра беременности, будет детально проведен в следующей главе V.
95
ГЛАВА V. ПРИНЦИПЫ ПАТОГЕНЕТИЧЕСКОЙ ТЕРАПИИ
АНЕМИИ И ПРОФИЛАКТИКИ ТРОМБОТИЧЕСКИХ
ОСЛОЖНЕНИЙ У БЕРЕМЕННЫХ И РОДИЛЬНИЦ.
Впроспективную группу вошли 112 беременных женщин с
выявленной анемией и отягощенным акушерско-гинекологическим
анамнезом (длительное бесплодие, невынашивание беременности,
антенатальная гибель плода, преждевременная отслойка нормально расположенной плаценты и т.д.)
Из них 62 пациентки, которые были нами консультированы и
обследованы до наступления беременности или на ранних сроках беременности и затем велись в течение всей беременности вплоть до родоразрешения и послеродового периода II А группа.
Остальные |
50 |
беременных, |
которые |
были |
обследованы, |
|||
консультированы и получали терапию со II триместра беременности |
|
|||||||
(II В группа). |
|
|
|
|
|
|
|
|
Всем |
пациенткам |
проспективной |
группы |
в |
качестве |
|||
противоанемического средства мы назначали Ферлатум дозе 800 мг 2 раза в сутки. Ферлатум - железа протеинсукцинилат, в 1 флаконе 15 мл (800 мг) –
40 мг железа. Средний срок лечения составил 34,3±14,2 дня. |
|
|
|||
Выбор |
Ферлатума |
в качестве |
противоанемического |
средства был |
|
обоснован |
тем, что |
железа |
протеинсукцинилат |
не |
обладает |
прооксидативными свойствами. Это |
крайне важно, так как |
свободные |
|||
радикалы являются факторами повреждения эндотелия, что сопровождается усугублением тромбофилии, повышением сосудистого тонуса (вследствие снижения естественной вазодилататорной функции эндотелия) и развитием или утяжелением гестоза и других осложнений беременности.
Динамическая оценка эффективности ферротерапии проводилась каждые 2 недели по данным объективного осмотра и ежемесячно – оценка
96

гематологических показателей. Было установлено, что нормализация
показателей красной крови наступила у 87,3% через 6 недель.
Таблица№26
Показатели гемограммы у больных II группы в процессе лечения железом протеинсукцинилатом 1600 мг.
Показатель |
1-я |
2-я |
неделя |
3-я |
неделя |
4-я |
неделя |
|
неделя |
|
|
|
|
|
|
|
|
|
|
|
|||
Эритроциты, |
3,8+/-0,35 |
4,1+/-0,32 |
4,5+/-0,23** |
4,6+/-0,16** |
|||
1012/л |
|
|
|
|
|
|
|
Гемоглобин, г/л |
77,5+/-6,0 |
88,1+/-4,6*** |
107,6+/-6,8*** |
113,1+/-5,3**** |
|||
Гематокрит, % |
26,0+/-2,3 |
33,4+/-3,3** |
37,0+/-2,3*** |
39,1+/-2,3**** |
|||
Среднее |
21,9+/-1,6 |
23,1+/-1,2 |
26,3+/-1,03** |
27,5+/-1,4** |
|||
содержание |
|
|
|
|
|
|
|
гемоглобина в |
|
|
|
|
|
|
|
эритроцитах |
|
|
|
|
|
|
|
(МСН), pg |
|
|
|
|
|
|
|
Средний объeм |
77,0+/-4,4 |
82,1+/-5,6 |
82,9+/-3,2* |
89,1+/-3,9** |
|||
эритроцитов |
|
|
|
|
|
|
|
(MCV), fq |
|
|
|
|
|
|
|
Железо |
6,9±0,6 |
16,5±1,9 |
14,0±1,3 |
|
13,7±1,4 |
|
|
сыворотки |
|
|
|
|
|
|
|
(мкмоль/л) |
|
|
|
|
|
|
|
НТЖ (%) |
10,2±1,4 |
22,5±3,8 |
23,5±2,5 |
|
24,9±2,0 |
|
|
Ферритин |
12,7±4,8 |
17,1±7,0 |
11,6±3,8 |
|
13,6±3,8 |
|
|
сыворотки |
|
|
|
|
|
|
|
(мкг/л) |
|
|
|
|
|
|
|
Ферритин |
2,0±0,6 |
5,4±3,9 |
|
2,0±1,0 |
|
2,6±1,0 |
|
гемолизата |
|
|
|
|
|
|
|
(мкг/гHb) |
|
|
|
|
|
|
|
СОЭ, мм/ч |
13,5+/-1,9 |
12,0+/-1,9 |
10,2+/-1,5 |
9,2+/-1,5 |
|
||
* p<0,05; ** p<0,01; *** p<0,0001; **** p<0,0001 различия достоверны в сравнении с 1-й
неделей
Приведенные лабораторные данные свидетельствуют, что в результате терапии достигнуто улучшение всех оцениваемых показателей картины периферической крови. Количество эритроцитов увеличилось с 3,8+/- 0,35*1012/л до 4,6+/-0,16*1012/л, достоверное увеличение этого показателя наблюдалось на 3-й неделе лечения. Уровень гемоглобина в крови
97

достоверно увеличился уже на 2-й неделе лечения. Минимальный уровень гемоглобина в исследуемой группе составил 73,9 г/л., на 3-ой неделе лечения этот показатель повысился до 107,6+/-6,8 г/л. Анализ динамики цветового показателя, определяемого по уровню среднего содержания гемоглобина в эритроците и среднего объема эритроцита, свидетельствует о переходе состояния гипохромии к нормохромной характеристике. Гематокрит увеличился в среднем с исходного значения 26,0+/-2,3% до 39,1+/-2,3% после проведенного лечения. Содержание сывороточного ферритина до лечения составляло 6,0+/-0,4 мкмоль/л, после лечения через 4 недели достоверно увеличилось до 13,1+/-1,4 мкмоль/л (р<0,0001), ОЖСС, ЛЖСС пришла к норме через 6 недель у абсолютного большинства -109 (97,3%) больных.
В процессе подготовки к беременности пациенткам II А группы назначалась витаминотерапия. Поддерживающая витаминотерапия включала фолиевую кислоту (минимум 1 мг в сутки), антиоксиданты (микрогидрин),
витамин Е 400МЕ, полиненасыщенные жирные кислоты (омега-3).
Пациенты с гипергомоцистеинемией получали более высокие дозы фолиевой кислоты (4 мг в сутки), а также дополнительно витамины группы
«В» в таблетированной форме.
Таблица№27
Уровень сывороточной концентрации фолиевой кислоты и цианкобаламина на фоне лечения фолиевой кислотой и комплексом витаминов группы «В».
|
|
|
|
|
|
|
II группа |
Показатель |
|
|
(n=112) |
|
|
|
|
до лечения |
|
после лечения |
|
|
|
||
|
|
|
|
|
|
|
|
Фолиевая кислота, |
0,9±0,3 р<0,01 |
|
1,5±0,7 |
нг/мл |
|
||
|
|
|
|
|
|
|
|
Цианкобаламин, |
204±83 р<0,05 |
|
347±53 |
нпг/мл |
|
||
|
|
|
|
|
|
|
|
98
Как видно из табл. 27, сывороточная концентрация фолиевой кислоты и цианкобаламина до лечения была достоверно ниже физиологических значений при беременности (р<0,01). После приема фолиевой кислоты (4 мг в сутки), и витаминов группы «В» сывороточная концентрация фолиевой кислоты и цианкобаламина достоверно возросла (р<0,05) по сравнению с исходными данными.
В фертильном цикле и с наступлением беременности при выявлении тромбофилического состояния в зависимости от уровня маркеров тромбофилии (Д-димер, Антитромбин III, фрагменты f 1+2) и агрегационной активности тромбоцитов назначалась дифференцированная противотромботическая профилактика.
В качестве противотромботической терапии мы применяли НМГ (в
большинстве случаев фраксипарин). Доза препарата корректировалась в зависимости от уровней маркеров тромбофилии, агрегационной активности тромбоцитов, веса женщины. Препарат вводился 1 - 2 раз в сутки (в
зависимости от уровней маркеров тромбофилии, агрегационной активности тромбоцитов, веса женщины) подкожно в определенное время суток с соблюдением равных промежутков между инъекциями. Инъекции проводили сами беременные в подкожную клетчатку брюшной стенки, медиальной поверхности бедра или плеча. Обучение проводилось в клинике.
Терапия НМГ (в большинстве случаев фраксипарин) проводилась в непрерывном режиме в течение всей беременности, аспирин – в зависимости от агрегационной активности тромбоцитов. Всем пациенткам до назначения НМГ, а затем через 10 дней и далее ежемесячно проводился контроль уровня маркеров тромбофилии (Д-димер, Антитромбин III, фрагменты f 1+2),
измерялся уровень гомоцистеина в плазме, агрегационная активность тромбоцитов, а также значения НО по данным глобального теста оценки функции протеина С. Это было необходимо с точки зрения определения исходного уровня тромбофилии, выбора исходно адекватной дозы
99
