
4 курс / Дерматовенерология / ЭСТЕТИЧЕСКАЯ_МЕДИЦИНА_3_ОТ_2019_ГОДА
.pdf
а |
б |
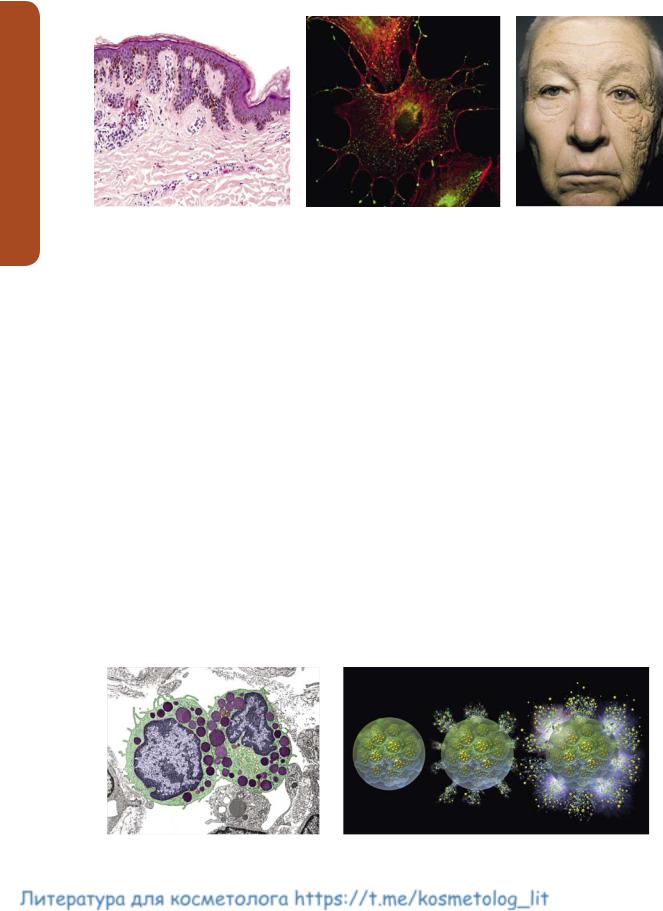
Рис. 3. Макрофаги атакуют нематоду (а) [15]. Многочисленные гранулы в цитоплазме макрофага на электронограмме (б) [16]
иммунного ответа на любой патоген. Кроме того, отмечается плохое заживление ран [1, 5].
Т-лимфоциты-γ/δ, или резидентные кожные лимфоциты, – уникальная малочисленная популяция тимусНЕзависимых лимфоцитов, имеющих рецептор γ/δ(у тимусзависимых – ά/β) [7]. Это оседлые клетки, которые никогда не покидают эпителий (рис. 9). Т-лимфоциты-γ/δ поддерживают непрерывность эпидермального покрова и содержание клеток кожи в интактном состоянии. Их рецепторы ориентированы на распознавание широко распространенных микробных антигенов, в том числе суперантигенов s. aureus, str. gaemolitieus, c. albicans.
Они распознают также комплексы «белок теплового шока / микробный пептид» на зараженных и поврежденных эпидермоцитах. Активатором Т-лимфоцитов- γ/δ служат клетки, находящиеся под воздействием системного стресса (поврежденные клетки). Данная разновидность лимфоцитов выполняет терминирующую функцию при иммунном ответе и контролирует процессы физиологической и репаративной регенерации кожи, продуцируя ростовые факторы [7, 8].
Дефицит Т-лимфоцитов-γ/δ приводит к развитию хронических инфекций кожи и замедлению заживления ран. Такие люди особенно чувствительны к микробам, содержащим молекулы суперантигенов: практически неизлечимыми становятся стафило- и стрептодермии, кандидоз кожи [1, 7].
Естественные, или натуральные, киллеры (NK). В настоящее время их относят к популяции лимфоцитов [8]. Так же, как и предыдущее клетки, являются оседлыми. Уничтожают инфицированные, опухолевые (рис. 4), мутировавшие, старые, поврежденные, чрезмерно пролиферирующие клетки; придают коже здоровый, моложавый вид. Распознают скомпрометированные клетки по отсутствию на их поверхности молекул главного комплекса гистосовместимости первого типа (ГКГС-1), своеобразную «метку своего», что свидетельствует о ее бласт-
Рис. 4. NK-клетки нападают на опухолевую клетку [17]
трансформации или нападении вирусов. NK-клетки уничтожают бактериальные и грибковые микроорганизмы, меченные антителами, осуществляют цитотоксические (благодаря гранулам перфорина и протеаз) и регуляторные функции, восстанавливая у других клеток иммунитета утраченную толерантность к собственным антигенам и предотвращая развитие атопических реакций [10].
При дефиците NK-клеток повышается риск аллергических и аутоиммунных поражений кожи. Такие люди чувствительны к микробам, содержащим много липидов и гликолипидов (трепонем, микобактерий). Дефицит естественных киллеров приводит к хроническим внутриклеточным инфекциям, преждевременному старению кожи, сопровождается высоким риском возникновения опухолей [1, 5, 10].
Кератиноциты. Продуцируют регуляторные молекулы – ростовые факторы и цитокины. Нарушение взаимодействия молекул адгезии на поверхности кератиноцитов с рецепторами лимфоцитов служит патогенетическим механизмом ряда заболеваний (например, псориаза). Кератиноциты – это иммунологическая мишень заболеваний пемфигусной группы, которые опосредуются через реагины, включая IgA и IgM; при этом анатомическое расположение пузырьковых образований коррелирует со скоплениями возникших иммунных комплексов [1].
Меланоциты (рис. 5) – клетки нейрального происхождения [8]. Синтезируют пигмент меланин, который в виде гранул – меланосом – накапливают в своих отростках, а оттуда транспортируют в кератиноциты, защищая последние от ультрафиолетового излучения. Способны продуцировать цитокины – медиаторы иммунного ответа в дерме. Меланин – крупный полимер, способный поглощать свет с длиной волны от 200 до 2400 нм, защищает от УФ-излучения, которое признается одним из важнейших факторов, способствующих старению кожи [5]. Кожа негров содержит то же количество меланоцитов, что и кожа представителей других рас, но они синтезируют бóльшее количество меланина. Синтез меланина стимулируют УФ-излучение, воспаление, прогестерон [8].
НАУЧНЫЕ ИССЛЕДОВАНИЯ
Э С Т Е Т И Ч Е С К А Я М Е Д И Ц И Н А ТОМ XVIII • №3 • 2019 291
НАУЧНЫЕ ИССЛЕДОВАНИЯ
а |
б |
в |
Рис. 5. Меланоциты (темные клетки) в базальном слое дермы (а) [18]. Гранулы меланина (зеленые) в цитоплазме и отростках меланоцитов (б) [19]. Одностороннее фотостарение кожи лица у водителя грузовика с 28-летним стажем (в) [20]
Кератиноциты, фибробласты и эндотелиоциты гемо- и лимфокапилляров кожи признаны активными участниками иммунных реакций.
Под влиянием дендритных клеток, макрофагов и Т-лимфоцитов они приобретают новые свойства – осуществляют эндоцитоз и фагоцитоз антигенов, экспрессируют молекулы адгезии, производят презентацию антигена и продуцируют ряд цитокинов [1, 5, 8].
Тучные клетки – тканевые базофилы, или лаброциты (рис. 6). В 1 мм2 кожи человека насчитывается около 7000–10 000 тучных клеток, которые располагаются вблизи гемокапилляров, лимфатических сосудов и нервов. Впервые описаны в 1877 году Паулем Эрлихом [9].
Тучные клетки (рис. 6а) вызывают мощную экссудативную реакцию в ответ на широкий спектр антигенов. Высвобождение гистамина и других вазоактивных медиаторов повышает проницаемость сосудов и ускоряет местный кровоток в целях элиминации (вымывания) антигена. В качестве рецепторов распознавания тучные клетки используют иммуноглобулины класса Е, а используемый ими механизм индукции воспаления связан с «дегрануляцией» и высвобождени-
ем гистамина, гепарина, агрессивных ферментов и эозинофильного хемотаксического фактора, а также секрецией простагландинов, лейкотриенов и целого ряда провоспалительных цитокинов [1, 2, 5, 7, 8, 14]. Термин «дегрануляция» восходит к световой микроскопии и некорректен, потому что на самом деле этот процесс есть не что иное, как мгновенный экзоцитоз не покрытых мембраной пузырьков (рис. 6б) [6].
Использование антигистаминных препаратов не прекращает развитие атопической реакции, поскольку нейтрализует только эффекты от действия гистамина – лишь одного из многих провоспалительных веществ, вырабатываемых тучными клетками, однако дает хороший косметический эффект. При этом данные препараты не только блокируют защитную экссудативную реакцию, но и способствуют проникновению антигенов в сыворотку крови. Поэтому одной из причин распространенности системных васкулитов в наше время служит ятрогенный фактор – широкое использование антигистаминных препаратов [1].
Патологическое состояние, известное как «недержание» гранул тучных клеток»», может приводить к
а |
б |
Рис. 6. Тучные клетки с метахромными гранулами в цитоплазме (а) [21]. Экзоцитоз тучной клетки (б) [22]
292 Э С Т Е Т И Ч Е С К А Я М Е Д И Ц И Н А ТОМ XVIII • №3 • 2019
а |
б |
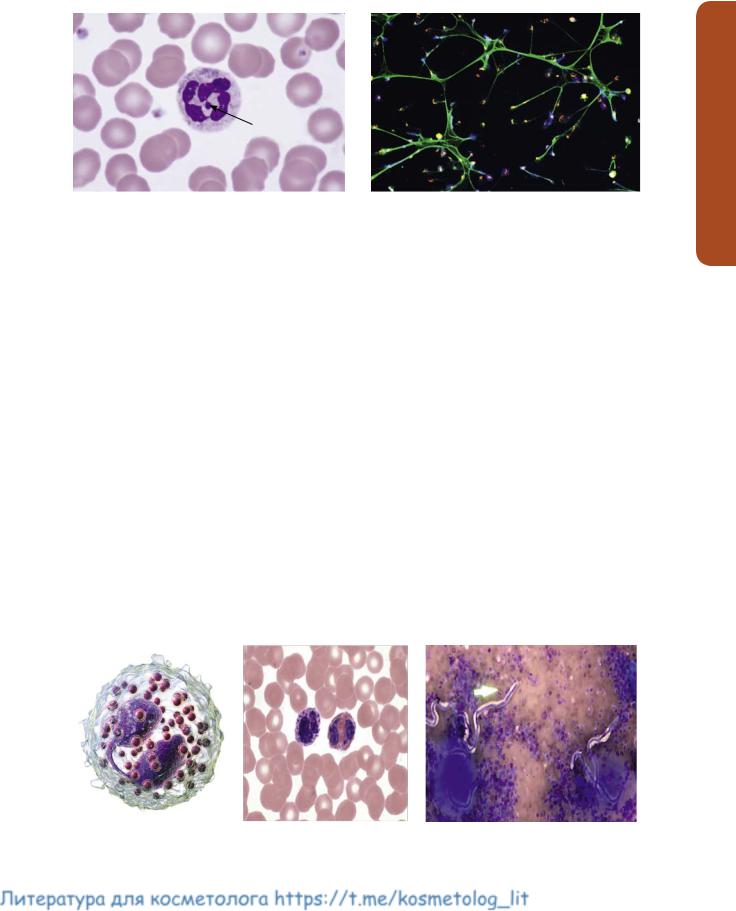
Рис. 7. Нейтрофил с тельцем Барра (показано стрелкой) (а) [24]. Картины нетоза на SEM-фото (б) [25]
псевдоатопической реакции, клинически неотличимой от истинной аллергии. Установлено, что тучные клетки могут выбрасывать секрет гранул в ответ на боль. Отмечено влияние на тучные клетки гормонов гипофиза (АКТГ), щитовидной и поджелудочной желез, половых гормонов [5]. Наряду с усилением локальной иммунной защиты, тучные клетки могут ухудшить течение воспаления через перепроизводство провоспалительных медиаторов.
Нейтрофилы (рис. 7). Короткоживущие (6–7 дней) клетки. Первичные (азурофильные) гранулы содержат миелопероксидазы, кислую фосфатазу, эластазу и др. Вторичные – щелочную фосфатазу, лактоферрин и коллагеназу. Лизоцим присутствует в обоих типах гранул. Ферменты гранул вызывают разрушение тканей и хроническое воспаление (например, при ревматоидном артрите) [8]. У женщин в ядре нейтрофилов имеется тельце Барра – половой хроматин (рис. 7а). Нейтрофилы образуют «внеклеточные ловушки» (рис. 7б). Это явление было открыто в 2004 году немецкими учеными и получило название нетоз (от Neutrophil Extracellular Trap – NET). Суть его в том, что молекула ДНК в ядре нейтрофила и упаковывающие ее белки-гистоны образуют что-то вроде клейкой ленты для мух. В ответ
на присутствие патогенных микроорганизмов, а также особых сигналов от тканей нейтрофил может пожертвовать собой, «выплюнув» «паутину», сотканную из их собственной ДНК и гистонов, во внеклеточное пространство. Бактерии «запутываются» в этой «паутине» и становятся добычей для фагоцитов,
асам нейтрофил погибает подобно «камикадзе». Сходные с нейтрофильными ловушками структуры найдены также у эозинофилов (EET), тучных клеток (MCET) и макрофагов [23].
Эозинофилы. Короткоживущие клетки – живут примерно 10 часов в циркулирующей крови и несколько дней в тканях. Их ядро имеет две доли, соединенные нитью хроматина, отчего и было названо «перекидная сума» (рис. 8а). При окраске гематоксилином и эозином клетки окрашиваются в розовый цвет и потому получили название в честь богини утренней зари Эос [2] (рис. 8б). Эозинофилы содержат лизосомальные ферменты – кислую фосфатазу, рибонуклеин, фосфолипазу, миелопероксидазу; имеют рецепторы к IgE [23]. Фермент гистоминаза из гранул эозинофилов ограничивает воспалительные последствия дегрануляции тучных клеток,
аколлагеназа, напротив, приводит к разрушению тканей, что наблюдается при контактных дерматитах
а |
б |
в |
Рис. 8. Эозинофил (а) [26]. Эозинофил (справа) и нейтрофил (слева) в мазке крови. Окраска гематоксилином и эозином (б) [27]. Эозинофилы (розовые клетки) атакуют паразита (в) [28]
НАУЧНЫЕ ИССЛЕДОВАНИЯ
Э С Т Е Т И Ч Е С К А Я М Е Д И Ц И Н А ТОМ XVIII • №3 • 2019 293

НАУЧНЫЕ ИССЛЕДОВАНИЯ
и экземе [5]. Эозинофилы эволюционировали как защита от нападения паразитов (рис. 8в), которая осуществляется токсичными молекулами гранул.
Эозинофилы в крови могут говорить о таких патологиях, как глистная инвазия, аллергическая реакция, начавшийся аутоиммунный или опухолевый процесс, но могут свидетельствовать и о выздоровлении от инфекционно-воспалительного заболевания, что получило необычное название «эозинофильная заря выздоровления» [2].
Б.Гуморальные факторы врожденного иммунитета кожи
Основу гуморального звена врожденного иммунитета кожи (второго барьера защиты) составляют эндогенные пептиды-антибиотики, секреторный иммуноглобулин класса А (sIg A), лизоцим, лактоферрин, система интерферонов и другие доиммунные цитокины, в частности интерлейкин-1 (ИЛ-1) и фактор некроза опухоли-α (ФНО-α).
Эндогенные пептиды-антибиотики представляют собой противомикробные вещества с широким спектром действия, продуцируемые клетками эпителия и фагоцитами. К самым известным относятся дефензины, кателицидины и дермоцидины. Они встраиваются в мембраны патогенных бактерий, грибков и внешние оболочки вирусов, нарушая их целостность
ипроницаемость. Благодаря этому пептиды-антибио- тики осуществляют бактериостатическое, бактерицидное, фунгицидное и противовирусное действие на самых ранних этапах проникновения патогена. Кроме того, эндогенные антибиотики принимают участие в развитии воспаления, активации и привлечении Т-лимфоцитов, выступая в роли хемоаттрактантов. При этом они индуцируют процессы ангиогенеза
иреэпителизации, играя главную роль в заживлении кожных ран [1, 5]. Таким образом, эндогенные пептиды-антибиотики совмещают в себе противомикробные свойства широкого спектра действия с выраженными иммунорегуляторными и трофическими свойствами. О подобных качествах лекарственных антибиотиков остается только мечтать!
Дефицит эндогенных антибиотиков – причина хронических бактериальных, грибковых и вирусных заболеваний кожи. Установлена роль аномальных молекул кателицидинов в развитии атопического дерматита и красного плоского лишая, а также псориаза в тех случаях, когда кателицидины реагируют на собственную измененную ДНК, способствуя развитию аутоиммунного процесса [1, 5].
SIg A – важный компонент местной специфической защиты кожи. Сочетает в себе возможности врожденного и приобретенного иммунитета, так как относится к антителам, вырабатываемым плазматическими клетками (рис. 9) [7]. Особенность молекулы sIg A – наличие секреторного компонента, который защищает ее от токсинов и действия собственных гидролитических ферментов. При этом каждая молекула sIg A специфична лишь к одному антигену [29].
2
1
3
4
Рис. 9. Трансформация активированного В-лимфоцита (1) в бласт (2) – клетку, способную к пролиферации (2). Она дает начало клону новых лимфоцитов («клональная селекция») (3), часть вновь образованных иммуноцитов будет
депонирована в регионарных лимфатических узлах как «клетки-памяти», а другая превратится в плазмоциты (4), которые синтезируют антитела или иммуноглобулины (5) [30]
SIg A может осуществлять шаблонное распознавание патогенов, что сближает ее с факторами врожденного иммунитета [5]. Это особенно важно
вдетском возрасте, когда еще мал объем иммунной памяти. SIg A борется с патогенными бактериями, грибками, вирусами, микробными токсинами и ферментами, а образованные при этом иммунные комплексы в норме просто слущиваются с поверхности кожи вместе с ороговевшими чешуйками эпидермиса.
При дефиците sIg A наблюдаются хронические бактериальные, грибковые и вирусные заболевания кожи. Недостаточность этого фактора лежит
воснове развития атопического дерматита и бронхиальной астмы. Установлено, что у таких людей чрезвычайно высок риск развития аутоиммунных болезней, в частности ревматоидного артрита, системной красной волчанки и дерматомиозита [1].
294 Э С Т Е Т И Ч Е С К А Я М Е Д И Ц И Н А ТОМ XVIII • №3 • 2019

Лизоцим – фермент, который расщепляет муреин клеточной стенки бактерий, оказывая таким образом бактерицидное действие. Синтезируется кожными макрофагами. Лизоцим наиболее эффективен в отношении грамположительных бактерий, клеточная стенка которых состоит из трехмерной муреиновой решетки [1, 5].
Дефицит лизоцима – причина хронических бактериальных, грибковых и вирусных инфекций кожи, особенно вызванных грамположительной микрофлорой – стрепто- и стафилококками [1, 5].
Лактоферрин – продукт секреции фагоцитов. Способен связывать ионы железа, необходимого для метаболизма бактерий и грибков, осуществляя тем самым выраженные бактериостатическое и фунгостатическое действие. Лактоферрин может вызвать агглютинацию бактерий, препятствуя адгезии микроорганизмов к клеткам кожных покровов. В последнее время выявлено бактерицидные действие лактоферрина [10].
Дефицит лактоферрина предрасполагает к формированию хронических бактериальных и грибковых инфекций кожи, для обмена веществ которых необходимы ионы железа [10].
Интерфероны. Альфа-интерфероны продуцируются любой инфицированной клеткой кожи и воздействуют на другие, рядом расположенные клетки, вызывая в них резистентность к заражению. Особенно эффективны α-интерфероны в случае вирусных инфекций. Суть индуцированной ими резистентности состоит в блокаде ферментов, задействованных во всех этапах вирусной репродукции – репликации, транскрипции и трансляции нуклеиновых кислот [7].
Дефицит α-интерферона – причина хронических вирусных поражений кожи и повышенного риска возникновения кожных опухолей, что обусловлено противоопухолевыми свойствами интерферонов, связанными с активацией эффекторных клеток иммунной системы – NK и Т-киллеров. При этом α-интерферон повышает поверхностную экспрессию антигенов I класса ГКГС клеток различных типов, а значит, умеет «лечить» опухолевые и пораженные вирусом клетки, спасая их от атаки естественных киллеров! Кроме того, α-интерфероны оказывают противобактериальное действие, усиливая активность NO-синтазы макрофагов, и тем самым повышают эффективность фагоцитоза. Поэтому при наличии показаний препараты α-интерферонов могут быть достаточно эффективны в лечении хронических бактериальных инфекций кожи [7, 10].
Бета-интерфероны продуцируются кожными фибробластами преимущественно на завершающих
этапах иммунного ответа, когда восстанавливаются повреждения кожного покрова, вызванные микробной инвазией и воспалительной реакцией. Эти цитокины оказывают противовоспалительное действие, снижая активность и пролиферацию иммунных клеток, а также проницаемость кожных капилляров. Так же, как и α-интерфероны, влияют на экспрессию рецепторов ГКГС I и II классов [7, 10].
ФНО-α. Этот цитокин синтезируется практически всеми клетками кожи при их повреждении инфекцией, механическими, термическими или радиационными факторами. Это «мастер-цитокин», способный самостоятельно индуцировать выработку всего каскада провоспалительных цитокинов в коже. С другой стороны, он может напрямую вызывать апоптоз инфицированных и опухолевых клеток, способствуя прерыванию инфекционного процесса или роста опухоли на самых ранних этапах их развития [14].
Дефицит синтеза ФНО-α может приводить к развитию тяжелых, преимущественно бактериальных инфекций кожи, при которых высока опасность генерализации инфекционного процесса [1, 14].
5ТРЕТИЙ БАРЬЕР – ФАКТОРЫ АДАПТИВНОГО ИММУНИТЕТА
Считается, что здоровая кожа не содержит В-лимфоцитов. Большинство имеющихся в ней лимфоцитов представлено Т-клетками, основная масса (до 90%) которых расположена вокруг посткапиллярных венул или придатков кожи – мест наиболее вероятного вторжения антигенов. Около 10% лимфоцитов составляют интра- и субэпидермальные цитотоксические (эффекторные) клетки, которые поддерживают гомеостаз кожных покровов (рис. 10). Регуляторных Т-клеток, которые угнетают иммунный ответ, мало – менее 5%, что соответствует современным представлениям о коже как об эффекторном органе иммунитета [31].
Установлено, что большинство кожных периваскулярных Т-лимфоцитов пребывают в активированном состоянии, что доказывается высокой экспрессией молекул HLA-DR и рецепторов к ИЛ-2. Это значит, что иммунные клетки кожи пребывают в постоянной готовности к осуществлению специфического ответа на патоген [5].
Проявление защитной функции адаптивного иммунитета в коже может превысить его целесообразность. При этом может нарушиться баланс соотношения иммунокомпетентных клеток, рекрутирование
НАУЧНЫЕ ИССЛЕДОВАНИЯ
Э С Т Е Т И Ч Е С К А Я М Е Д И Ц И Н А ТОМ XVIII • №3 • 2019 295

НАУЧНЫЕ ИССЛЕДОВАНИЯ
|
|
1 |
2 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
9 |
9 |
|
|
Рис. 10. Схема |
|
|
|
|
|
|
|
расположения |
|
|
|
|
|
|
|
иммуногенных клеток в |
|
|
|
|
|
|
|
коже человека: |
|
|
|
|
|
|
|
1 |
– кератиноциты, |
|
4 |
|
|
|
|
2 |
– клетки Лангерганса, |
|
|
|
|
|
3 |
– кровеносные и |
|
|
|
|
|
|
|
||
|
|
10 |
|
5 |
|
лимфатические |
|
10 |
8 |
|
|
|
капилляры, |
||
|
|
|
|
4 |
– макрофаги, |
||
|
7 |
|
|
6 |
|
||
|
|
|
|
5 |
– дендритные клетки, |
||
|
|
4 |
|
|
|
6 |
– тучные клетки, |
|
|
|
|
8 |
7 |
– NK-клетки, |
|
|
|
|
|
|
8 |
– Т-киллеры (CD 8), |
|
|
|
3 |
|
3 |
|
||
|
|
|
|
9 |
– резидентные |
||
|
|
8 |
5 |
7 |
|
Т-лимфоциты γ/δ, |
|
|
6 |
|
10 – фибробласты и |
||||
коллагеновые волокна [32]
лимфоцитов может обрести черты неконтролируемой реакции, а клетки кожи могут получить несвойственные им функции. Поэтому доиммунные защитные механизмы в коже нацелены на удаление патогена на самых ранних стадиях его проникновения.
Кожные Т-лимфоциты имеют общий маркер – кожный лимфоцитарный антиген CLA, который они получают в регионарных лимфатических узлах. По своему строению это мембранный рецептор класса адресинов (названный «хоуминг-рецептором» от англ. to home – домой), который обеспечивает прохождение Т-лимфоцита через венулы строго определенного анатомического региона и переход его в дерму. CLA-лимфоциты составляют 10–15% от всех циркулирующих в крови клеток [5, 7], это означает, что каждая десятая клетка нашей крови относится к защитному барьеру кожи!
6ВОЗРАСТНЫЕ ИЗМЕНЕНИЯ ИММУНОЛОГИЧЕСКОЙ ОРГАНИЗАЦИИ КОЖИ
Нарушение протекания нормальных иммунных реакций в коже приводит к дерматологическим и эстетическим проблемам, а также к преждевременному старению. В стареющей коже развивается мононуклеарная инфильтрация, но при этом снижается число клеток Лангерганса и изменяется продукция цитокинов, влияющих на пролиферацию и дифференцировку клеток. Одномоментно происходят инволюция, склерозирование и варикозное расширение кровеносных и лимфатических сосудов [2].
С возрастом могут формироваться все виды иммунных патологий. Иммунодефицит проявляется
фурункулезом и гнойно-воспалительными процессами. Дефекты фагоцитоза и презентации антигенов приводят к повышенной восприимчивости кожи к бактериальным и грибковым инфекциям. Аллергический (гиперергический) синдром имеет место при контактном и атопическом дерматитах, фотодерматозах и псориазе. Аутоиммунный синдром проявляется склеродермией и системной красной волчанкой. Лимфопролиферативный синдром может проявляться Т-клеточной лимфомой [1, 5, 10].
Диагностика этих состояний основана прежде всего на клинических признаках, которые характеризуются рецидивирующим, затяжным течением (несмотря на адекватную терапию), тенденцией к генерализации процесса, резистентностью к терапии, преобладанием некротических изменений над воспалительными, несоответствием локальных и системных проявлений. Специфических тестов, характеризующих состояние иммунитета кожи, в настоящее время не существует. Дерматологкосметолог может ориентироваться лишь на стандартные иммунологические показатели крови и использование морфологической (гистологической) оценки иммунокомпетентных структур кожи.
ВМЕСТО ЗАКЛЮЧЕНИЯ
У женщин две Х хромосомы, а значит, больше генов, отвечающих за защитные силы организма, поэтому они чаще страдают от аутоиммунных болезней и осложнений, вызванных излишне сильным иммунным ответом. Смертность от сепсиса у женщин вдвое выше, чем у мужчин. Мужчинам в ходе эволюции было важнее не защищаться от инфекции, а
296 Э С Т Е Т И Ч Е С К А Я М Е Д И Ц И Н А ТОМ XVIII • №3 • 2019

снять воспаление. Если бы они обладали женской устойчивостью к инфекции, то чаще бы умирали от боевых ранений. Природа наделила тестостерон парадоксальной функцией – ослаблением иммунитета [2]. Подмечено, что кастраты живут дольше их полноценных собратьев.
ЛИТЕРАТУРА
1.Гелашвили П.А., Супильников АА, Плохова ВА. Кожа человека (анатомия, гистология, гистопатология). Уч. пособие для студентов медицинских вузов. – Самара: РЕАВИЗ, 2013.
2.Сапин МР, Этинген ЛЕ. Иммунная система человека. – М.: Медицина, 1996.
3.https://www.coresatin.com/wp-content/ uploads/2018/03/Blog01-01.jpg.
4.https://pbs.twimg.com/media/C3CEKDLXAAIrQRR.jpg.
5.Дерматовенерология. Национальное руководство. Краткое издание. Под ред. Бутова ЮС, Скрипкина ЮК, Иванова ОЛ. – М.: ГЭОТАР-Медиа, 2013.
6.Standring S, et al. Gray›s Anatomy. The Anatomical Basis of Clinical Practice, 41th ed. – Elsevier, 2016:2252.
7.Рабсон А., Ройт А, Делвз П. Основы медицинской иммунологии. Пер. с англ. – М.: Мир, 2006.
8.Быков ВЛ. Частная гистология человека (краткий обзорный курс). Учебник. – СПб.: Сотис, 2002.
9.Самусев РП. Анатомия человека в эпонимах. Справочник. – М.: Оникс, Мир и образование, 2007.
10.Казмирчук ВЕ, Ковальчук ЛВ, Мальцев ДВ. Клиническая иммунология и аллергология. – Киев: Феникс, 2009.
11.http://info-farm.ru/img/001115-3ce900a2babc109721c f04c2e4f954bf.jpg.
12.http://classconnection.s3.amazonaws.
com/686/flashcards/4143686/jpg/cardima ge_9378612_2360525661389814661327.jpg.
13.https://www.facebook.com/DailyAnatomy/photos/a.16
5931116911609/903224263182287/?type=3&theater.
14.Gallucci S, Matzinger P. Danger signals: SOS to the immune system. Curr Opin Immunol, 2001;13:114–119.
15.https://images.fineartamerica.com/images-medium- large/4-macrophage-cell-tem-steve-gschmeissner.jpg.
16.http://3.bp.blogspot.com/-wZIIKFvCK3E/TcGddbHA3JI/ AAAAAAAACCU/gpJDYc5xWsg/ s1600/Macrofagos+inte ntando+detener+a+una+Taenia.jpg.
17.https://i2.wp.com/diethylstilbestrol.co.uk/ wp-content/uploads/2018/01/Natural_Killer_Cells. jpg?resize=2000%2C1200&ssl=1.
18.https://upload.wikimedia.org/wikipedia/commons/ thumb/1/16/Dysplastic_nevus_-_add_-_high_mag. jpg/1200px-Dysplastic_nevus_-_add_-_high_mag.jpg.
19.http://www.imperial.ac.uk/ImageCropToolT4/ imageTool/uploaded-images/ ss-tojpeg_1421677842718_0–tojpeg_1472044151626_ x4.jpg.
20.https://www.facebook.com/DailyAnatomy/photos/a.16
5931116911609.1073741828.165478916956829/8746
69709371076/?type=3&theater.
21.http://histologyguide.com/EM-view/EM-108-mast-cells/ imgs/preview-c.png.
22.https://i.pinimg.com/originals/51/60/6d/51606d2300
d90399103f7798d9df17ae.jpg.
23.Iwasaki A, Medzhitov R. Toll-like receptor control of the adaptive immune responses. Nature Immunol, 2010;5:987–995.
24.https://media.gettyimages.com/photos/barr-body-in- leukocyte-picture-id128555678.
25.https://www.cshl.edu/wp-content/uploads/2018/08/ nets.jpg.
26.https://upload.wikimedia.org/wikipedia/ commons/1/19/Blausen_0352_Eosinophil_%28crop%29. png.
27.http://test.classconnection.s3.amazonaws.com/784/
flashcards/455784/jpg/16.jpg.
28.https://media.springernature.com/lw785/springer- static/image/art%3A10.1186%2F1475-2883-5-9/ MediaObjects/13564_2004_Article_57_Fig4_HTML.jpg.
29.Eisen HN. Specificity and degeneracy in antigen recognition: Yin and yang in the immune system. Ann Rev Immunol, 2009;(19):1–21.
30.http://www.add3d.ru/wp-content/uploads/2018/12/ immune-1.jpg.
31.Кашутин СА. Лиганд-рецепторные механизмы пролиферативной активности
иммунокомпетентных клеток у больных псориазом. Автореф. докт. мед. наук – СПб., 2010.
32.http://uvbnb.ru/Statyji/2017/immunitet-kozi.jpg.
НАУЧНЫЕ ИССЛЕДОВАНИЯ
Э С Т Е Т И Ч Е С К А Я М Е Д И Ц И Н А ТОМ XVIII • №3 • 2019 297

НАУЧНЫЕ ИССЛЕДОВАНИЯ
Нейроиммуноэндокринология кожи. Часть 2. Гормональные факторы
1 ВВЕДЕНИЕ
Данный обзор продолжает серию статей о нейроиммуноэндокринной системе кожи и посвящен гормональной регуляции физиологических функций кожи. Охарактеризованы строение и основные функции гормонов жировой ткани, биогенных аминов, пептидов, в частности некоторых половых гормонов и их рецепторов, и других гормонов, регулирующих нор-
А. Дробинцева1, 2, специалист в области нейроиммуноэндокринологии и клеточной биологии, кандидат биологических наук
В. Полякова1, 3, специалист в области нейроиммуноэндокринологии и клеточной биологии, доктор биологических наук
З. Газитаева4, 5, пластический хирург
А. Прокопов6, специалист в области эстетической медицины, кандидат медицинских наук
И. Кветной1, 3, специалист в области нейроиммуноэндокринологии и общей патологии, доктор медицинских наук
1 НИИ акушерства, гинекологии и репродуктологии им. Д.О. Отта
2 Санкт-Петербургский государственный педиатрический медицинский университет
3 Санкт-Петербургский государственный университет
4 «Институт красоты Fijie»
5 Санкт-Петербургский институт биорегуляции и геронтологии
6 Лаборатория новинок «РОС-Химия» Санкт-Петербург, Москва, Екатеринбург, Россия
мальное функционирование клеток кожи. Освещены также эндокринные механизмы патогенеза старения кожи, развития псориаза и дерматитов.
2 АДИПОКИНЫ
Жировую ткань теперь оценивают не только как энергетическое депо, но и как орган, регулирующий различные эндокринные и метаболические функции. Регуляция осуществляется посредством высвобождения большого количества активных веществ, называемых адипокинами. В зависимости от топографии и морфологии жировой ткани имеются различия в проявляемых этими гормонами функциях: так, адипокины висцерального жира активнее в эндокринологическом плане, чем адипокины подкожного [3]. Это объясняется тем, что висцеральная жировая ткань обладает бóльшей васкуляризацией и иннервацией, чем подкожный жир [1].
Наиболее представлены в жировой ткани такие адипокины, как адипонектин и лептин, которые через эндокринные, паракринные и аутокринные механизмы регулируют многие функции организма [4].
Адипонектин
Адипонектин – гормон, регулирующий содержание в крови глюкозы. Снижение экспрессии адипонектина связано с синдромом резистентности к инсулину и вызывает повышение концентрации инсулина в плазме крови [4].
С возрастом количество подкожной жировой клетчатки и экспрессия адипокинов изменяются.
298 Э С Т Е Т И Ч Е С К А Я М Е Д И Ц И Н А ТОМ XVIII • №3 • 2019

Экспрессия как адипонектина, так и лептина снижается соответственно уменьшению массы жировой ткани в связи со старением. Однако в подкожном жире она меняется также и из-за фотостарения кожи. Роль влияния ультрафиолета (UV) на кожу известна. Под воздействием UV-излучения в верхнем слое дермы активируется пигмент меланин, в связи с чем у человека появляется загар. Кроме того, UV-лучи могут проникать в глубокие слои дермы, что ведет к таким морфологическим изменениям, как потеря эластичности кожи и формирование морщин [2]. Также UV-излучение может вызывать изменения во внеклеточном матриксе, в частности повреждение и дезорганизацию фибрилл коллагена. Эти изменения – результат ингибирования синтеза проколлагена и ускоренного распада коллагена с помощью индуцированных UV-излучением матриксных металлопротеиназ (ММР), секретируемых эпидермальными кератиноцитами и дермальными фибробластами. Таким образом, UV-воздействие уменьшает экспрессию адипонектина и лептина в подкожном жире, что приводит к активации фотостарения путем стимуляции экспрессии ММР-1 и ингибирования синтеза проколлагена [4].
Лептин
Лептин – подавляющий аппетит полипептидный гормон. Лептин действует на центры пищевого поведения в гипоталамусе. Регуляция аппетита лептином связана с его влиянием на вкусовые рецепторы [5]. Имеет общую молекулярную массу 16 кДа и представляет собой продукт гена ожирения ob (оbese gene) [6].
Воздействуя на потребление пищи и расход энергии благодаря своей связи с ядрами гипоталамуса, лептин влияет на массу тела. Помимо функций, осуществляемых через центральную нервную систему, лептин выполняет еще несколько важных задач: играет ключевую роль в липидном метаболизме [7], гематопоэзе [8], термогенезе [9], работе яичников [10], формировании костей [11] и ангиогенезе [12].
Некоторые исследования [13] демонстрируют, что в поврежденных участках кожи лептин выступает в качестве аутокринного/паракринного регулятора. Было выяснено, что у лептин-дефицитных мышей ob/ob заживление ран на коже происходит медленнее и доказано, что лептин при местном применении способствует заживлению ран на коже, ускоряя пролиферацию, дифференцировку и миграцию эпидермальных кератиноцитов, а также усиливая ангиогенез в поврежденных участках [14]. Таким образом, данный гормон может влиять на здоровье
кожи и ее придатков. В частности, метаболические эффекты лептина благодаря усилению митохондриальной активности и биогенеза могут быть использованы для стимуляции роста волос и замедления старения кожи [15].
Если лептин – единственный продукт гена ob, то рецептор к лептину (ObR) представлен несколькими изоформами, различающимися в зависимости от типа сплайсинга транскриптов. ObR наиболее тесно связан с гликопротеином 130 (gp130), трансдуцирующим мембранным белком сигнального комплекса IL-6 (IL-6-SC), лейкемияингибирующим фактором (LIF) и сайтом связывания гранулоцитарно-колониести- мулирующего фактора (G-CSF) [15]. Ob-рецепторы обычно разделяют на короткие (ObRa, ObRc, ObRd и ObRf), растворимые (ObRe) и длинные (ObRb) формы [16]. Сам рецептор лептина не имеет собственной ферментативной активности, вместо этого лигандиндуцированная передача сигналов зависит от янускиназы 2 (JAK2). Длинная форма служит основным медиатором физиологического воздействия лептина в контроле питания и энергетического баланса, а короткие формы ObRa и ObRc действуют как транспортные белки, доставляющие лептин через гематоэнцефалический барьер [15].
Програнулин
Програнулин (PGRN) представляет собой богатый цистеином секреторный белок с молекулярной массой 68–88 кДа. Экспрессия PGRN может быть обнаружена в жировой и эпителиальной ткани, желудоч- но-кишечном тракте, репродуктивных органах и др. Програнулин известен как адипокин, связанный с ожирением и инсулинорезистентностью. Впервые был выявлен как фактор, обладающий противовоспалительными свойствами и принимающий участие
враннем эмбриогенезе и ремоделировании тканей. Однако последние исследования показали, что при многих заболеваниях PGRN оказывает и провоспалительное действие.
Повышенный уровень секреции PGRN обнаруживается в коже больных псориазом, в моделях мышей с дерматитом и при повреждении кожи. Роль PGRN
вгенезе заболеваний кожи, а именно псориаза, не была полностью выяснена. Чтобы исследовать роль PGRN в патогенезе псориаза, использовали мышей дикого типа (WT) и мышей PGRN-/-, у которых вызывали воспаление кожи, подобное псориазу, введением 12-O-тетрадеканоилфорбор 13-ацетата (ТРА) [17]. Было показано, что у мышей дикого типа
вобработанных TPA псориазоподобных поражениях экспрессия PGRN значительно увеличена (аналогич-
НАУЧНЫЕ ИССЛЕДОВАНИЯ
Э С Т Е Т И Ч Е С К А Я М Е Д И Ц И Н А ТОМ XVIII • №3 • 2019 299

НАУЧНЫЕ ИССЛЕДОВАНИЯ
ная картина наблюдается в псориатических бляшках человека), а PGRN-/--мыши более чувствительны к развитию воспаления, индуцированного TPA.
Известно также, что PGRN увеличивает пролиферацию регуляторных Т-лимфоцитов (Treg), которые защищают кожу от псориатического воспаления. Оказалось, что у обработанных TPA PGRN-/--мышей снижена продукция регуляторных Т-клеток в лимфатических узлах и потенциал к рекрутированию этих клеток в воспаленную кожу ниже, чем у мышей дикого типа (WT). Следовательно, механизм, лежащий в основе повышенной чувствительности PGRN- /--мышей к воспалению, индуцированному TPA, нарушает дифференцировку клеток Treg и сокращает число этих клеток в пораженной коже, что и приводит к более сильному воспалению; в то же время присутствующий у мышей WT PGRN способствует дифференцировке и накоплению клеток Treg и соответственно уменьшает у них силу псориатического воспаления [17]. Таким образом, данное исследование показало, что PGRN играет защитную роль в патогенезе псориаза благодаря своей способности усиливать дифференцировку и увеличивать количество клеток Treg.
Резистин
Резистин, или адипоцит-специфический секреторный фактор (ADSF/FIZZ3), – пептид, состоящий из 114 аминокислотных остатков. Ген резистина локализуется у человека на хромосоме 19 р13.3. Резистин принадлежит к семейству цистеинсодержащих С-терминальных доменовых белков, называемых резистинподобными (RELM), или FIZZмолекулами, вовлеченными в процессы воспаления. Резистин секретируется как преадипоцитами, так и адипоцитами, а также моноцитами и макрофагами в жировой ткани. В период эмбрионального развития ген резистина экспрессируется трофобластами плаценты (преимущественно в конце беременности), и его содержание в плазме крови беременных женщин значительно выше. Считается, что в этот период данный гормон выполняет роль регулятора углеводного обмена.
Резистин индуцирует секрецию провоспалительных цитокинов, таких как интерлейкин-6 (IL-6), IL-12 и фактор некроза опухолей α (TNF-α), а его экспрессию стимулируют липополисахарид, IL-1β и IL-6 [19]. Продукция цитокинов, усиливающаяся под действием резистина, указывает на наличие патогена. Повышенное содержание резистина в сыворотке крови выявляется при ожирении и различных злокачественных новообразованиях. Высокое содер-
жание резистина в сыворотке наблюдается также у пациентов с псориазом [20].
Индукция резистином синтеза CXCL8 и TNF-α в популяции моноцитов в крови связана с патофизиологией псориаза, а TNF-α стимулирует пролиферацию кератиноцитов и привлечение Т-клеток в кожу. Таким образом, видна тесная связь между резистином и TNF-α, которая и обусловливает медиаторное воспаление при псориазе.
3 БИОГЕННЫЕ АМИНЫ
Биогенными аминами называют органические вещества, образованные из аминокислот путем их декарбоксилирования.
Серотонин
Серотонин, или 5-гидрокситриптамин (5HT), так называемый «гормон счастья», представляет собой
моноаминовый нейромедиатор, относящийся к биогенным аминам. Он индуцирует клеточные ответы через серотонинергические рецепторы, связанные с G-белком (GPCRs), которые классифицируют соответственно семи классам рецепторов серотонина (5HTR) от 1 до 7.
Ключевыми медиаторами серотонинергических эффектов вне ЦНС служат тромбоциты, которые хранят большую часть периферического серотонина в форме плотных гранул [21].
Согласно недавним исследованиям [18], кожа также служит источником серотонина. Данное заключение основано на выявлении в коже человека триптофангидроксилазы (фермента, участвующего в синтезе серотонина) и обнаружении серотонина, а также его переносчика в кератиноцитах человека.
Известно, что травма значительно повышает концентрацию серотонина в тканях на первых стадиях заживления. Это может служить еще одним доказательством того, что кожа может продуцировать серотонин. В одном из исследований была изучена роль серотонина в заживлении ран на моделях ожоговых травм in vitro и in vivo [22]. Результаты анализа in vitro показали, что серотонин уменьшает апоптоз
иувеличивает выживаемость клеток фибробластов и кератиноцитов и их пролиферацию. Кроме того, увеличение продукции серотонина значительно ускорило миграцию клеток в тесте на зарастание раны: в культурах неонатальных кератиноцитов
ифибробластов человека наблюдалось ускорен-
300 Э С Т Е Т И Ч Е С К А Я М Е Д И Ц И Н А ТОМ XVIII • №3 • 2019
