
6 курс / Клинические и лабораторные анализы / Клиническая_оценка_результатов_лабораторных_исследований_Г_И_Назаренко
.pdf

et al., 1991].
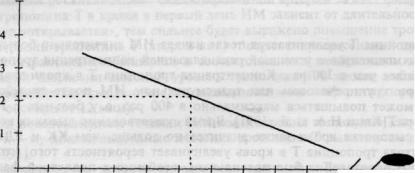
Специфичность методов определения тропонина Т в кро ви при ИМ составляет 90— 100 % и превосходит специфичность для КК, ЛДГ и миоглобина. В первые 2 ч от начала болевого приступа чувствительность методов определения тропонина Т составляет 33 %, через
4 ч — 50 %, после 10 ч — 100 %, на 7-й день — 84 % [Mair J. et al., 1991].
Чувствительность определения КК для диагностики ИМ ограничена, так как увеличение активности фермента относительно небольшое, держится недолго и может быть
186

Маркеры повреждения мозговой ткани
Белок S-100 в сыворотке
Содержание белка S-100 в сыворотке крови в норме менее 0,2 мкг/л; в СМЖ — менее 5 мкг/л.
S-100 является специфическим белком астроцитарной глии, способным связывать кальций, с мол. массой 21 000 Да. Белок впервые был идентифицирован в 1965 г. B.W. Moore и получил свое название благодаря растворимости в 100 % сульфате аммония. Он состоит из двух субъединиц — а и p. S-100 (Pβ) присутствует в высоких концентрациях в глиальных и шванновских клетках (леммоцитах), S-100 (оф) — в глиальных клетках, S-100 (аа) — в поперечнополосатых мышцах, печени и почках. Белок метаболизируется почками, его время биологической полужизни составляет 2 ч. Астроглиальные клетки — это наиболее многочисленные клетки в мозговой ткани. Они образуют трехмерную сеть, которая является опорным каркасом для нейронов. Коммерчески доступные наборы позволяют определять формы белка S-100 (рр) и S-100 (оф), т.е. пригодны для диагностики поражения мозговой ткани. В последние годы определение этого белка все более активно используется в клинике в качестве маркера повреждения мозговой ткани при нарушениях мозгового кровообращения. У больных с кровоизлиянием в мозг пик концентрации S-100 в сыворотке крови и СМЖ наблюдается уже в первые сутки заболевания, при ишемическом инсульте этот пик приходится на 3-й сутки [Kim J.S. et al., 1996]. Уровень повышения концентрации коррелирует с объемом поражения мозга. Так, К. Fassbender и соавт. (1997) отмечают, что уровень S-100 в сыворотке крови у больных ишемическим инсультом при объеме поражения мозга более 5 см3 был значительно выше, чем при объеме поражения менее 5 см3, и концентрация белка коррелировала с тяжестью неврологических нарушений. При ишемическом инсульте наибольшее повышение S-100 выявляется у больных с кортикальными поражениями мозга. Субкортикальные поражения сопровождаются менее значительными повышениями концентрации белка как в сыворотке крови, так и в СМЖ.
Белок S-100 высвобождается в кровь у пациентов, оперированных в условиях искусственного кровообращения. Пик концентрации приходится на окончание экстракорпоральной циркуляции и затем уменьшается в неосложненных случаях. У пациентов с мозговыми осложнениями выход белка продолжается и в послеоперационном периоде. Уровень S-100 более 0,5 мкг/л через 2 дня после операции на сердце указывает на наличие у пациента неврологических осложнений [Johnsson P., 1996].
Повышение белка S-100 в сыворотке крови и СМЖ при нарушениях мозгового кровообращения обусловлено активацией микроглии. Е. Postler и соавт. (1997) показали, что в ранней фазе церебрального инфаркта микроглиальные клетки в периинфарктной зоне экспрессируют белки семейства S-100 и активно пролиферируют, причем белки экспрессируются не более чем 3 дня после инфаркта. Это говорит о том, что ак тивация постоянной популяции микроглии является ранним ответом мозговой ткани на ишемию и может быть использована как ранний маркер ее повреждения.
ВОДНО-ЭЛЕКТРОЛИТНЫЙ ОБМЕН Калий в сыворотке
Содержание калия в сыворотке в норме 3,5—5,0 ммоль/л (мэкв/л).
В организме здорового человека с массой тела около 70 кг содержится 3150 ммоль калия (45 ммоль/кг у мужчин и около 35 ммоль/кг у женщин). Всего 50—60 ммоль калия находится во внеклеточном пространстве, остальное его количество распределено в клеточном пространстве. Суточное потребление калия составляет 60—100 ммоль [Рябов Г.А., 1979]. Почти столько же выделяется с мочой и лишь немного (около 2 %) выводится с каловыми массами. В норме почка выделяет калий со скоростью до 6 ммоль/кг/сут. Концентрация калия в сыворотке — показатель его общего содержания в организме, однако на его распределение между клетками и внеклеточной жидкостью могут влиять различные факторы (нарушение кислотноосновного состояния, повышение внеклеточной осмолярности, дефицит инсулина). Так, при сдвиге рН на 0,1 следует ожидать изменения концентрации калия на 0,1—0,7 ммоль/л в противоположном направлении.
191
Рекомендовано к покупке и прочтению разделом по физиологии человека сайта https://meduniver.com/
