
4 курс / Лучевая диагностика / Общие_принципы_и_методы_лучевой_терапии_злокачественных_опухолей
.pdf
Сочетанное использование лучевой и химиотерапии преследует двоякую цель: взаимное усиление воздействия ионизирующей радиации и химиотерапии на первичную опухоль (достижение аддитивного,
потенциирующего и синхронизирующего эффектов), а также создание условий для профилактики метастазов и лечения субклинических или же выявленных метастазов. Теоретической основой повышения эффективности облучения с помощью химиопрепаратов являются данные о возможности синхронизирующего действия цитостатиков на митотический цикл опухолевых клеток, а также о различных «точках приложения» этих антибластомных агентов (Рис.1)
Рис. 1. Генерационный цикл клетки
Каждая опухоль состоит из различных клеточных фракций. Активно пролифилирующая фракция клеток обеспечивает рост опухоли и чем больше в опухоли активно делящихся клеток, тем выше темп роста ее. В быстро растущих опухолях доля клеток, участвующих в клеточном цикле больше, чем в медленно растущих. Две фракции представлены постепенно умирающими живыми клеткам и полностью некротизированными. Эти клетки не оказывают влияния на рост и метастазирование опухоли. Кроме того, 10-15% опухолевых клеток могут находиться в состоянии покоя и не принимают участия в делении
11
(фаза G-0). В этой фазе они не реагируют на антибластомную терапию.
Установлено, что назначение химиопрепаратов способствует переходу опухолевых клеток из состояния покоя в фазы клеточного цикла и тем самым они становятся уязвимыми для последующего лучевого и/или химиолучевого воздействия. Наибольшей чувствительностью к действию радиации обладают клетки в фазе митоза (М) и премитоза (G-2), меньшей – находящиеся в фазе синтеза (S) и пресинтетической фазе (G-1). Большинство алкилирующих препаратов оптимально действуют на клетки в фазе S и G-2, антиболиты – в
фазе S и G-1, цитостатики растительного происхождения (митотические ингибиторы) в фазе М, ингибиторы синтеза белка – в фазе G-1и G-2.
Мультимодальная терапия онкологических больных предусматривает использование современных методов хирургического, лучевого,
лекарственного лечения, а также сочетание их с радиомодифицирующими воздействиями (гипертермия, гипербарическая оксигенация, электрон-
акценторные соединения, гипоксическая гипоксия и др.).
4. Распределение дозы излучения в облучаемом объеме.
Основным принципом лучевой терапии является излечение опухоли при максимальном щажении нормальных органов и тканей. Для реализации его в клинике большое внимание уделяется разработке способов повышения эффективности лучевого воздействия на основе пространственного и временного распределения дозы ионизирующего излучения и применения средств, изменяющих (моделирующих) лучевые реакции опухоли и организма.
При лучевой терапии весьма важным является точное установление локализации, размеров опухоли и степени ее распространенности. Для этого используются различные диагностические процедуры, включающие ультразвуковые, рентгенологические, радиоизотопные исследования,
компьютерную томографию (КТ), ядерно-магнитно-резонансную томографию
(ЯМРТ), позитронно-эмиссионную томографию (ПЭТ). На основании полученной информации устанавливается макроскопический объем опухоли
12
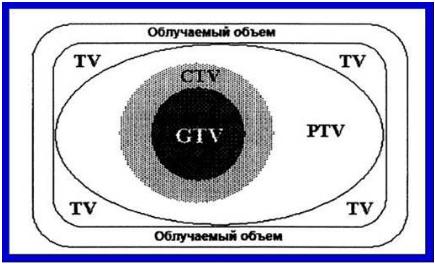
(gross tumor Volume – GTV) (рис.2), в котором сосредоточена основная часть опухолевых клеток. Однако известно, что в нормальных тканях, окружающих опухоль, могут находиться отдельные опухолевые клетки и их комплексы,
которые также должны быть включены в сферу лучевого воздействия. Поэтому в процессе предлучевой подготовки выделяют клинический объем облучения
(clinical tumor volume – CTV), включающий макроскопический объем опухоли
(GTV) и ткани, в которых имеет место микроскопическое распространение опухоли. Планируемый объем облучения (planning tumor Volume – PTV)
учитывает смещение пациента и его органов во время одного сеанса облучения,
а также от сеанса к сеансу. Объем, который получает дозу достаточную для радикального или палиативного лечения с учетом толерантности нормальных тканей, обозначается как «объем лечения». Наиболее оптимальное распространение дозы излучения достигается при объемном (трехмерном)
планировании. Объемное планирование лежит в основе конформного облучения, задачей которого является «придание объему высокой дозы формы опухоли, ограничивая при этом до минимума дозу на окружающие здоровые ткани» (G.Kuthcer).
Рис.2
GTV – макроскопический объем опухоли (gross tumor Volume)
СTV – клинический объем облучения (clinical tumor volume) PTV – планируемый объем облучения (planning tumor Volume) TV – объем лечения
13
5. Распределение дозы излучения во времени.
Результаты лучевой терапии злокачественных новообразований во многом зависят от режима распределения дозы излучения во времени.
Наибольшее распространение получил режим обычного или конвенциального фракционирования, при котором к опухоли подводится разовая очаговая доза (РОД) 1,8 – 2 Гр. Облучение проводится один раз в день 5
дней в неделю, суммарная очаговая доза (СОД) за неделю составляет 9-10 Гр.
Курс лечения продолжается 1,5 месяца до подведения к опухоли канцерицидной дозы.
Разработаны и продолжают изучаться нетрадиционные варианты фракционирования: среднего (РОД 3-4 Гр), крупного (РОД 5 Гр и более),
используемые преимущественно для предоперационного облучения опухолей,
отличающихся высокой злокачественностью, а также с целью паллиативного и симптоматического лечения. Большой интерес представляют курсы лучевой терапии, предусматривающие дополнительное дробление дневной дозы на две
(и более) фракции с интервалами между фракциями менее одних суток
(мультифракционирование). Различают следующие разновидности мультифракционирования:
1.ускоренное (акселерированное) фракционирование – отличается меньшей длительностью курса лучевой терапии по сравнению с таковой при обычном фракционировании, при этом РОД остается стандартной или несколько ниже. Изоэффективная СОД снижается, общее число фракций или равно таковому при обычном фракционировании, или уменьшается за счет того, что применяется 2-3 фракции ежедневно. Ускоренное фракционирование применяют для облучения быстро пролиферирующих опухолей;
2.гиперфракционирование – увеличение количества фракций с одновременным значительным снижением РОД (1,1 – 1,2 Гр). Подводят 2-3
фракции в день с интервалом 3-6 часов при общем времени курса, равном таковому при обычном фракционировании. Изоэффективная СОД, как
14
правило, повышается. Гиперфракционирование применяется для облучения
медленно растущих опухолей.
3.комбинированное фракционирование представляет собой варианты мультифракционирования, имеющие признаки как гиперфракционирования,
так и ускоренного фракционирования, а иногда сочетающееся с обычным
фракционированием дозы.
В зависимости от наличия перерывов в облучении различают:
непрерывный курс лучевой терапии, при котором заданная доза в мишени накапливается непрерывно; расщепленный курс облучения («сплит» – курс),
состоящий из двух (или нескольких) укороченных курсов, разделенных продолжительными (2-4 недели) запланированными интервалами. За время перерыва в облучении здоровые ткани восстанавливают лучевые повреждения.
Опухоль уменьшается в размерах, улучшается ее кровоснабжение, ведущее к улучшению оксигенации опухолевых клеток и повышению их радиочувствительности.
Динамическое фракционирование – облучение с планируемым изменением схемы фракционирования и/или плана облучения больного, при этом подведение крупных фракций с мультифракционированием суточной дозы может сочетаться с классическим фракционированием.
Одномоментное облучение – планируемая суммарная очаговая доза облучения подводится к опухоли за один сеанс. Такое распределение дозы излучения используется в настоящее время при интраоперационном облучении.
6. Радиочувствительность опухолевых и нормальных клеток.
Эффективность лучевой терапии в большинстве случаев определяется степенью различия в радиочувствительности опухолевых и нормальных клеток,
получившей название терапевтического интервала чувствительности. Еще в начале развития радиобиологии было выявлено, что для того чтобы получить одинаковые изменения в различных клетках, тканях и целых организмах,
наступающих под влиянием ионизирующего излучения, требуется подведение
15
различных доз радиации, что свидетельствует о различной их радиочувствительности. Под радиочувствительностью надо понимать способность клеток, тканей или организмов реагировать на действие излучения
(П.Д. Горизонтов). Радиопоражаемость – это устойчивость к ионизирующему излучению. Степень радиочувствительности сильно варьирует у различных видов растительных и животных организмов. Минимальная доза радиации,
вызывающая при общем облучении смерть организма, для простейших будет выражаться сотнями и тысячами грей, а для человека она не превышает 5-6
грей. Вместе с тем, среди животных одного и того же вида встречается экземпляры более чувствительные к действию ионизирующей радиации и менее чувствительные. Но даже при облучении одного и того же организма с соблюдением равномерности воздействия на все органы и ткани можно наблюдать почти полное отсутствие морфологических изменений в одних тканях и резчайшие изменения в других, заканчивающиеся полной дегенерацией их клеточных элементов. Так, у человека к тканям, обладающим высокой радиочувствительностью, относятся мужские и женские половые железы, костный мозг, а также эпителий тонкого кишечника, лимфатические узлы, зобная железа, селезенка, фолликулы кишечного тракта. Менее чувствительны к действию радиации клетки волосяного фолликула и хрусталика. Повреждение хрусталика наблюдается при дозе 3,5 Гр, а
волосяного фолликула при однократном облучении в дозе 4,5 Гр. Более радиорезистентными являются печень, легкие, сердце, мозг, соединительная ткань, кожа, мышцы. Однако радиорезистентность любой ткани невелика. Доза порядка 50-60 Гр даже при фракционировании ее вызывает чаще всего необратимые изменения любой из тканей организма.
Различная радиопоражаемость тканей становится в обратную зависимость от степени дифференцировки клеток ее. В 1906 г. Бергонье и Трибондо высказали предположение о том, что радиочувствительность
(радиопоражаемость) связана с митотической активностью и степенью дифференцировки тканей. Закон они сформулировали следующим образом:
16
«Рентгеновы лучи действуют на клетки с тем большей интенсивностью, чем больше воспроизводящая активность этих клеток, чем дольше она будет делиться в течении своей жизни и, чем менее определена их морфология и функция». Таким образом, чем активнее пролиферация ткани и чем она менее дифференцирована, тем она чувствительнее к излучению.
Эллингером составлена шкала повреждаемости, клеточные элементы в которой расположены по степени чувствительности в следующем порядке:
1.лимфоциты;
2.гранулоциты;
3.эпителиальные клетки:
а) эпителий фолликулов яичников;
б) сперматогонии;
в) эпителий волосяных фолликулов;
г) эпителий слюнных желез;
д) камбиальный слой кожи;
е) эпителий легочных альвеол;
ж) клетки печеночных протоков и почек;
4. эндотелиальные клетки:
а) эндотелий кровеносных и лимфатических сосудов;
б) клетки плевры;
в) клетки брюшины;
5.соединительно-тканные клетки;
6.костные клетки;
7.мышечная ткань;
8.нервные клетки.
Патологическая ткань, в частности опухолевая, нередко оказывается более чувствительной к излучению, чем нормальная. Эти различия в радиочувствительности опухолевой и нормальной ткани позволяют успешно проводить лучевую терапию. Связаны они также и с неодинаковой
17
способностью к восстановлению постлучевых повреждений, более выраженной
внормальных тканях.
Вбольшинстве случаев опухоль повторяет свойства той ткани, из которой она развилась, поэтому злокачественные новообразования также отличается друг от друга по радиочувствительности. В зависимости от чувствительности опухолей к радиации их классифицируют на опухоли высокой, относительно высокой, средней, относительно низкой и низкой радиочувствительности (Rubin Ph., Simann D., 1993)
Опухоли высокой радиочувствительности развиваются из лимфоидной ткани, костного мозга, сперматогенного эпителия и эпителия фолликулов яичников. К ним относятся лимфома, лейкемии, семинома,
дисгерминома. Относительно высокой радиочувствительностью обладают опухоли, исходящие из эпителия ротоглотки, сальных желез, мочевого пузыря,
хрусталика, желез желудка, толстой кишки, молочной железы. В эту группу включаются: плоскоклеточный рак гортани, глотки, мочевого пузыря, кожи,
шейки матки, а также аденокарцинома пищеварительного тракта. Средней радиочувствительностью отличаются сосудистые и соединительно-тканные элементы опухолей. Источником развития этих элементов являются интестинальная соединительная ткань, нейроглиальная ткань, богатая сосудами растущая хрящевая и костная ткань. Относительно низкая радиочувствительность характерна для новообразований, происходящих из взрослой хрящевой и костной ткани, эпителия слюнных желез, почек, печени,
хондроцитов и остеоцитов. Эту группу составляют опухоли слюнных желез,
гепатомы, рак почек, поджелудочной железы, хондросаркомы и остеосаркомы.
Низкая радиочувствительность характерна для опухолей, растущих из мышечной и нервной ткани (рабдомиосаркома, лейомиосаркома,
ганглионейрофибросаркома).
Одно гистологическое строение не определяет чувствительности нормальной и патологической ткани к излучению. Одна и та же ткань в зависимости от условий по-разному реагирует на воздействие излучения. На
18
радиочувствительность оказывает влияние функциональное состояние органа и ткани, метаболические процессы, протекающие в них, состояние иннервации облученной ткани и состояние центральной нервной системы, степень кровоснабжения и содержание в клетках кислорода, характер роста опухоли и соотношения в ней клеточных и соединительно-тканных элементов, состояние окружающих опухоль нормальных тканей. Большое значение для радиочувствительности нормальных и опухолевых тканей имеет общее состояние организма, наличие сопутствующих заболеваний, возраст.
7. Радиомодификаторы.
Радиочувствительность опухолей и нормальных тканей не является чем-
то постоянным и меняется в зависимости от многих факторов. Благодаря успехам радиобиологии появилась возможность искусственно влиять на радиочувствительность опухолевых и нормальных клеток с помощью применения физических и химических факторов – радиомодифицирующих
агентов.
Под радиомодифицирующими агентами понимают физические и химические факторы, способные изменить (усилить или ослабить)
радиочувствительность клеток, тканей и организма в целом.
Для усиления лучевого повреждения опухолей применяется облучение на фоне гипербарической оксигенации (ГО) злокачественных клеток. Метод лучевой терапии, основанный на использовании ГО, получил название
оксигенорадиотерапия или оксибарорадиотерапия – лучевая терапия опухолей, когда больной перед началом облучения и во время него находится в специальной барокамере, где создается повышенное давление кислорода (2-3
атмосферы). Вследствие значительного повышения РО2 в сыворотке крови (в 9-
20 раз) увеличивается разница между РО2 в капиллярах опухоли и ее клетках
(кислородный градиент), усиливается диффузия О2 к опухолевым клеткам и соответственно повышается их радиочувствительность.
19
В практике лучевой терапии нашли применение препараты определенных классов – электрон-акцепторные соединения (ЭАС) (метронидазол, мезонидазол и др.), способные повысить радиочувствительность гипоксичных клеток и не влияющие на степень радиационного повреждения нормальных оксигенированных клеток. ЭАС содержат в своей молекуле неспаренный электрон. При поступлении в кровоток они легко принимают на себя свободный электрон у облученных молекул, но при этом не метаболизируются оксигенированными клетками и поэтому свободно диффундируют в гипоксичные слои опухоли.
С целью усиления действия радиации на опухолевые клетки используются также малые «сенсебилизирующие» дозы радиации (0,1 Гр),
подводимые за 3-5 мин до облучения основной дозой. Малые дозы радиации препятствуют формированию неспецифических реакций опухоли путем стимулирования обменных процессов непосредственно перед или тотчас после облучения и ослабляют тем самым естественные защитные механизмы ее. (Г. С.
Календо). Благодаря этому усиливается повреждающее действие радиации.
Гипертермия, применяемая в сочетании с лучевой терапией, хорошо зарекомендовала себя в ситуациях, достаточно сложных для традиционной лучевой терапии. Локальный нагрев опухоли до 43-44 0С с помощью СВЧ и УВЧ излучений позволяет повысить радиочувствительность опухолевых клеток.
В качестве химических и физических факторов, способных модифицировать радиорезистентность опухолей, используются химиотерапевтические препараты, ультразвуковое излучение, микроволны,
лазерные излучения, магнитные и электрические поля.
Еще большие возможности таит в себе использование
полирадиомодификации – одновременное или последовательное применение одноили разнонаправленных радиомодифицирующих агентов с учетом морфологических и функциональных особенностей опухоли.
20
