
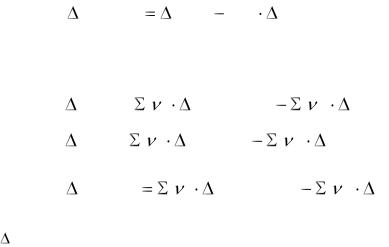
Направление химической реакции определяют по величине изобарноизотермического потенциала:
ΔG<0 - протекает прямая реакция; самопроизвольный процесс;
ΔG=0, система находится в состоянии равновесия;
ΔG>0, протекает обратная реакция; несамопроизвольный процесс.
Рассчитывают ΔG по уравнению изотермы химической реакции:
ΔGх.р. = - RT ln Kp + RT ln (РDd ∙PCc / РAa ∙PBb)
R- газовая постоянная, R=8,314 Дж/(моль К). Kp –константа равновесия
РD , РС - неравновесные давления газообразных продуктов реакции РА , РB - неравновесные давления газообразных исходных веществ.
- RT ln Kp= ΔG0298, х.р.
Способы расчѐта изобарно-изотермического потенциала:
1) G2980 |
,х. р. |
H 2980 |
298 S2980 |
H 2980  (
(
S2980  (
(
i |
H 0f ,298 )кон |
( j |
H 0f ,298 )исх , |
i |
S2980 )кон |
( j |
S2980 )исх |
|
|
2) |
G2980 ,х. р |
( |
i G0f ,298 )кон |
( j |
G0f ,298 )исх |
|
G f , |
0 |
|
- |
стандартное |
изменение энергии |
Гиббса при образовании 1 моля |
||
|
298, |
|
|
|
|
|
|
|
вещества из простых веществ (справочные данные).
Принцип ЛеШателье:
если на систему, находящуюся в состоянии равновесия подействовать извне, то система смещает равновесие в сторону противодействия внешнему воздействию.
Повышение температуры смещает равновесие в сторону протекания эндотермического процесса. Повышение давления - в сторону образования меньшего числа моль газообразных веществ.
Зависимость константы химического равновесия от температуры при постоянном давлении описывает уравнение изобары Вант-Гоффа:
51
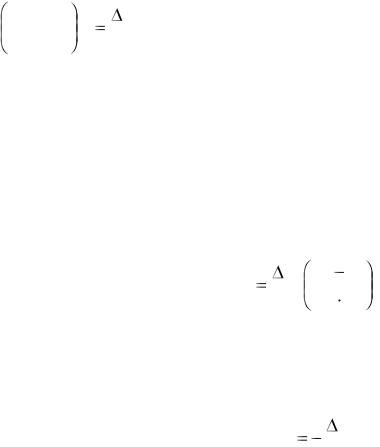
дифференциальная форма уравнения изобары
d ln K p |
|
H 0 |
|
dT |
p |
RT 2 |
, |
|
|
|
где R- газовая постоянная, R=8,314 Дж/(моль К);
Kp – константа равновесия, выраженная через давления; Т – температура; ∆Н – тепловой эффект реакции.
интегральная форма уравнения изобары
ln |
K2 |
|
H |
T2 |
T1 |
|
K1 |
|
R |
|
T2 |
T1 |
|
К1, К2 –константы химического равновесия реакции при температурах Т1 и Т2.
Зависимость константы химического равновесия от давления описывает
уравнение Планка – Ван – Лаара:
d ln K x |
|
n |
dP P
Кх – константа химического равновесия, выраженная через мольные доли; Р – давление;
∆n – изменение числа моль газообразных участников реакции.
Вопросы для самоконтроля
1)Что называют химическим равновесием?
2)Какие реакции называют обратимыми по направлению реакции?
3)Какие реакции называют необратимыми по направлению реакции?
4)Назовите термодинамические условия равновесия в изолированных и закрытых системах.
5)Запишите уравнение изотермы химической реакции.
6)Какими ещѐ способами рассчитывают ∆G? Приведите расчѐтные формулы.
7)Через какие характеристики системы можно выразить константу равновесия?
8)Запишите уравнение изотермы и изобары химической реакции.
52
Тренировочный тест
1.В системе 2SО2 + O2 → 2SO3 исходные концентрации SО2 и О2 были соответственно равны 0,03 и 0,015 моль/л. В момент равновесия концентрация SО2 стала равной 0,01моль/л. Константа равновесия равна
а) 180
б) 260
в) 525
г) 800
2. При 508°С константа скорости реакции Н2(г) + J2(г) →2HJ(г) равна
0,16 л/(моль∙мин). Исходные концентрации Н2 и J2 соответственно равны 0,04 и 0,05 моль/ л. Начальная скорость реакции составляет_________ моль/( л∙мин).
а) 3,2∙10-4
б) 1,92∙10-4 в) 9,6 ∙10-5 г) 2,8 ∙10-5
3. В системе 2SО2(г) + O2(г) → 2SO3(г) исходные концентрации SО2 и О2 были соответственно равны 0,03 и 0,015 моль/л. В момент равновесия [SО2] стала равной 0,01, а равновесная [SО3] _____моль/ л
а) 0,005
б) 0,01
в) 0,02
г) 0,05
4.Если в системе 2Са(к) + О2(г) ∙→ 2СаО(к) увеличить давление в 2 раза, то скорость прямой реакции
53
а) возрастет в 4 раза б) возрастет в 2 раза в) понизится в 2 раза г) не изменится
5.Исходная концентрация СО и Сl2 в системе СО + Сl2 →СОСl2 были равны 0,3
и 0,2 моль/л. Если концентрацию СО повысить до 0,6, а Сl2 до 1,2 моль/л, то скорость реакции между ними увеличится в____
а) 2 раза
б) 6 раз
в)12 раз
г) 24 раза
Ответы: 1а, 2а, 3а, 4б, 5в
54
Ситуационные задачи.
1) Константа равновесия системы СО2(г) + Н2(г) → CO(г) + Н2О(г) равна 1. В
начальный момент [СО2] и [Н2] были соответственно равны 0,2 и 0,8 моль/ дм3.
Концентрация [СО] равн. Составляет ______(моль/ дм3)
2)Запишите выражения КР для реакций:
1.CO + H2 = С граф +H2O газ
2.2CI2 + 2H2O газ = 4HCI(г) + О2
Как связаны КР и КС для этих реакций?
3) Железо и водяной пар реагируют по уравнению:
Fe тв + H2O газ = FeО тв + H2 газ. При температуре 1298К и Робщ = 1атм равновесие наблюдается при РH2 = 0, 562 атм. и Р H2O = 0,438 атм. При температуре 1173К
равновесие наблюдается при Р(H2)= 0,592 атм., Р (H2O) = 0,408 атм.
Рассчитайте средний тепловой эффект реакции в этом интервале температур.
4) При 1000К для реакции SO2 + NO2 = SO3 +NO; Кр = 7,6. В каком направлении будет протекать реакция при РSO2 = 1 атм.; PNO2 = 6 атм.; PSO3
= 2 атм.; PNO= 3 атм.
5) Напишите уравнение, описывающее влияние давления на химическое равновесие. Приведите примеры реакций, на равновесие которых влияет давление и не влияет.
6) Как влияет общее давление на равновесие:
FeCO3 кр = FeO кр + CO2?
7) Для реакции N2+3H2 = 2NH3 при 6230К КР = 7,23 ∙ 10 -14 (Н/м2)-2. В каком направлении будет протекать процесс при:
РN2 = PH2 = PNH3 = 1,0132 ∙ 105 Н/м2.
55
8) Как |
нужно изменить условия проведения реакции (Т и Р) |
CO + H2O(газ) = CO2 +H2, чтобы сдвинуть равновесие в сторону продуктов, |
|
если |
Н0800К = -36994 Дж/моль. |
9). Для реакции: 2CO + 2H2 = CH4 + CO2 при 1000К КР = 2,57 ∙ 10-8
(Н/м)-2. Определить, в каком направлении будет протекать реакция, если:
РСО = 1,0132 ∙ 104;
РН2 = 2, 0264 ∙ 104;
РСН4 = 2, 0264 ∙ 104;
РСО2 = 6, 0792 ∙ 104 Н/м2
10). Для реакции СТВ + 2Н2 Г = СН4 г, при 973К КР = 0, 1924 ∙ 10-5 Н/м2, а при 1033К КР = 0,1159 ∙10-5. Вычислить средний тепловой эффект реакции в этом интервале температур.
11) Что требуется сделать для для смещения равновесия гомогенной химической реакции 2НI 2H2 + O2, H < 0, в сторону продуктов?
12)Как увеличить выход продуктов реакции
2Pb(NO3)2 (тв) 2 PbO(тв)+4 NO2(г)+О2 (г), H > 0.
13)Запишите уравнение константы равновесия гетерогенной химической
реакции 2H2S(г) + SO2 (г) 2S(к) + 2H2O(г)
56

Лабораторная работа
Влияние изменения концентраций на химическое равновесие.
Воздействие концентраций на равновесие изучим на примере реакции хлорида железа (+3) с роданидом калия.
Обычно полное уравнение реакции представляют так:
FeCl3 + 3KSCN  Fe(SCN)3 + 3KCl.
Fe(SCN)3 + 3KCl.
Этому молекулярному уравнению можно сопоставить разные ионные.
Если считать, что хлорид железа полностью распадается на ионы, а роданид железа совсем не распадается, получается следующее сокращѐнное ионное уравнение:
Fe3+ + 3SCN–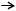 Fe(SCN)3.
Fe(SCN)3.
Частичной диссоциации обеих солей железа отвечают другие ионные уравнения, например, такое:
FeCl2+ + 2SCN–  Fe(SCN)2+ + Cl–.
Fe(SCN)2+ + Cl–.
Запишите стандартное выражение для константы данного равновесия.
В пробирку налейте 10 мл раствора KSCN и прибавьте 1–2 капли разбавленного раствора FeCl3. Должен получиться слабоокрашенный раствор. Его разделите на 4 равные порции.
К первой порции прибавьте концентрированный раствор FeCl3. Во вторую порцию всыпьте ложечку сухого KSCN. К третьей порции добавьте ложечку сухого KCl или влейте 1–2 мл концентрированной HСl. Четвѐртая пробирка предназначена для сравнения (исходное состояние).
Единственным ярко окрашенным веществом в системе является соединение ионов железа и роданида.
Проанализируйте изменения цвета в порциях 1-3 с точки зрения принципа Ле-Шателье. Какой из вариантов ионного уравнения противоречит опыту?
Сделайте выводы о проделанной работе.
57

Лабораторная работа
Влияние концентрации реагирующих веществ на скорость реакции
Воздействие концентрации на скорость химической реакции изучим на примере реакции тиосульфата натрия Na2S2O3 с серной кислотой:
Na2S2O3 + H2SO4 = Na2SO4 + H2SO3 + S.
Вначале проделайте опыт качественно: слейте в пробирке по 2 мл растворов серной кислоты и тиосульфата натрия. Наблюдайте, как быстро и в каком виде появляется сера. Сразу после опыта следует мыть пробирки – потом серу отмыть намного труднее.
Заготовьте растворы в нескольких парах пробирок, как указано в таблице. Растворы подобраны так, чтобы при сливании общий объѐм составлял 20 мл.
Рассчитайте для каждой пары концентрацию ионов водорода и тиосульфата сразу после сливания растворов. Новая концентрация C получается из исходной C0 по формуле: С=С0·V0 / V . Тут в знаменателе – общий объѐм после сливания. Внесите эти данные в таблицу.
. Тут в знаменателе – общий объѐм после сливания. Внесите эти данные в таблицу.
Приготовьте секундомер и приступайте к измерениям. Секундомер запускайте в момент сливания растворов (сразу перемешайте!) и останавливайте при появлении легкой мути (опалесценции). Еѐ рекомендуется наблюдать на тѐмном фоне.
Результаты измерений и расчѐтов заносите в таблицу.
По времени начала опалесценции ( o) оценивают общую скорость реакции v=1/ o. В данном случае v измеряют в обратных секундах (с–1).
|
Пробирка 1 |
Пробирка 2 |
Концентрации |
Время |
Скорость |
||
N |
|
|
|
после сливания |
помутнения |
реакции |
|
|
|
|
|
|
|
|
|
Пары |
1 н. |
1 н. |
|
S2O32–, |
H+, |
o, |
v=1/ o, |
|
H2SO4 |
Na2S2O3 |
H2O |
моль/л |
моль/л |
c |
c–1 |
|
|
|
|
|
|
|
|
1 |
5 мл |
5 мл |
10 мл |
|
|
|
|
2 |
5 мл |
10 мл |
5 мл |
|
|
|
|
|
|
|
|
|
|
|
|
58

3 |
|
5 мл |
15 мл |
|
– |
|
|
|
|
4 |
|
10 мл |
5 мл |
5 |
мл |
|
|
|
|
5 |
|
15 мл |
5 мл |
|
– |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
По данным для пар 1, 2 и 3 |
постройте график зависимости v от исходной |
|||||||
концентрации S2O32– (концентрация H+ при этом постоянна). Четвѐртая точка
– начало координат (при нулевой концентрации, естественно, и v=0).
Сравните, во сколько раз выросли концентрация S2O32– и скорость реакции.
Аналогично, по нулевой точке и данным для пар 1, 4 и 5 постройте график зависимости v от исходной концентрации H+ (при постоянном содержании
S2O32–).
Сравните, во сколько раз выросли концентрация H+ и скорость реакции.
Выполняется ли закон действия масс? Чем отличаются порядок и молекулярность реакции? Что можно сказать о порядке изученной реакции?
Результаты исследования отразите в выводах.
59
Содержание
I. |
Тема занятия: элементы термодинамики. |
3 |
II. |
Тема занятия: кинетика и катализ. |
18 |
III. |
Тема занятия: химическое равновесие. |
48 |
60
