
5 курс / Пульмонология и фтизиатрия / Бронхолегочные_осложнения_хронических_лейкозов
.pdf6.2. Клиническая характеристика бронхолегочной системы у больных истинной полицитемией
У 10 больных ИП диагностировали сопутствующее заболевание - ХОБЛ (все злоупотребляли курением). У 30 больных ИП сопутствующих БОД не было. В данной главе приводятся сведения о морфофункциональном состоянии бронхолегочной системы больных ИП без сопутствующей ХОБЛ (табл. 61).
Среди этих 30 больных у 18, на момент обследования, имела место IIA стадия (I группа), у 12 - IIБ стадия (II группа). Клиническая характеристика бронхолегочной системы у больных ИП I группы не отличалась от таковой в контрольной группе. У всех грудная клетка была правильной формы, обе ее половины равномерно участвовали в акте дыхания. Перкуторно над всей поверхностью легких определялся ясный легочный звук, при аускультации выслушивали везикулярное дыхание, побочные дыхательные шумы отсутствовали. У 12 больных первой группы была умеренно увеличена селезенка (нижний полюс пальпировался не более чем на 2 см ниже края реберной дуги), после проведения кровопусканий селезенка хорошо сокращалась, что говорило об ее переполнении кровью и отсутствии миелоидной метаплазии. Компрессионного синдрома вследствие увеличения селезенки, не было отмечено ни у одного пациента ИП в стадии IIА (табл. 61).
Таблица 61 Клинические характеристика бронхолегочной
системы у больных ИП
Клинические симптомы |
IIА стадия |
IIБ стадия |
||
(n=18) |
(n=12) |
|||
|
|
|||
|
|
|
|
|
Одышка: |
при физической нагрузке |
- |
3 |
|
|
в покое |
- |
2 |
|
Кашель |
|
- |
- |
|
Лихорадка |
|
- |
- |
|
Форма грудной клетки: |
|
|
||
- Цилиндрическая |
18 |
12 |
||
- Эмфизематозная |
- |
- |
||
Ассиметрия грудной клетки при |
|
|
||
дыхании |
|
- |
- |
|
Голосовое дрожание: |
|
|
||
- Без патологии |
18 |
7 |
||
- Усиление |
- |
- |
||
- Ослабление |
- |
5 |
||
Перкуссия: |
|
|
||
- Ясный легочный звук над всей |
18 |
7 |
||
поверхностью легких |
|
|
||
- Притупление легочного звука |
- |
5 |
||
- Усиление легочного звука |
- |
- |
||
Аускультативно дыхание: |
|
|
||
- везикулярное дыхание над всей |
18 |
7 |
||
поверхностью легких |
|
|
||
- ослабление дыхания |
- |
5 |
||
- жесткое дыхание |
- |
- |
||
Хрипы: |
- влажные |
- |
- |
|
|
- сухие |
- |
- |
|
|
- крепитация |
- |
- |
|
Увеличение ЧСС |
- |
4 |
||
Увеличение ЧДД |
- |
2 |
||
Двум больным во IIБ стадии выполнена спленэктомия (у одного больного был диагностирован разрыв
селезенки, у другого - частые инфаркты селезенки). У 10 больных второй группы нижний полюс селезенки пальпировался более чем на 3 см ниже реберной дуги, из них у 5 пациентов селезенка занимала значительную часть брюшной полости, рентгенологически у них диагностировали высокое стояние купола диафрагмы. У этих же пациентов отмечалось значительное увеличение печени. У этих 5 больных имел место компрессионный синдром в виде сдавления диафрагмы и грудной клетки, что клинически проявлялось одышкой, отмечалось притупление легочного звука при перкуссии и ослабление дыхания при аускультации в нижних отделах обеих легких. У одного больного рентгенологически было диагностировано скопление небольшого количества жидкости в обеих плевральных полостях.
6.3.Морфофункциональное состояние бронхолегочной системы у пациентов с истинной полицитемией
При проведении рентгенологических методов исследования у 25 больных (13 из первой, 12 из второй подгрупп) диагностировано усиление легочного рисунка. Какой-либо бронхолегочной патологии у этих пациентов не было. Усиление сосудистого рисунка в данном случае можно объяснить полнокровием легочных сосудов и замедлением тока крови в них.
При проведении спирографического исследования у всех 30 больных ИП без сопутствующей ХОБЛ, вне зависимости от фазы заболевания и ответа на терапию, не было выявлено нарушений вентиляционной функции легких.
Для оценки бронхиальной проходимости и ее суточного мониторирования использовали пикфлоуметрию, с помощью которой измеряли пиковую скорость выдоха (ПСВ) в течение 1 – 2 недель. У больных ИП без сопутствующей ХОБЛ, вне зависимости от фазы заболевания и ответа на терапию, показатели ПСВ составляли в среднем 95% от должных величин утром и 100% вечером. Суточные колебания ПСВ не превышали повторяемости теста и составляли до 5% исходной величины.
Диагностическая фибробронхоскопия (ФБС) выполнена всем 30 больным ИП. В группе больных со IIA стадией заболевания у 12 человек выявлена гиперемия слизистой оболочки, сосуды были полнокровными, извитыми. У 2 больных отмечалась гипертрофия слизистой оболочки бронхов; атрофические изменения слизистой – у 2 больных. У 2 больных изменений со стороны слизистой оболочки не выявлено. У всех пациентов данной группы был диагностирован двусторонний диффузный эндобронхит: ИВ 0 – у 5 человек, ИВI – 7 человек, ИВII - 6 человек, без клинических проявлений.
При проведении диагностической ФБС у больных во IIБ стадии наблюдалась гиперемия слизистой бронхов в 8 случаях, ее истончение в 4. Полнокровие сосудов выявлено у всех больных данной группы. Атрофический бронхит диагностирован у 7, смешанный бронхит - у 5 больных; ИВ0 – у 5 , ИВI – у 2, ИВII – у 5 пациентов. Клинических проявлений бронхита не наблюдалось.
91

12 больным (6 из первой и 6 из второй групп) была выполнена эндобронхиальная биопсия слизистой оболочки бронхов, на 1,5 см дистальнее шпоры правого верхнедолевого бронха. У пациентов обеих групп при гистологическом исследовании биоптатов были диагностированы следующие изменения: переполнение сосудов кровью и их расширение, дистрофические изменения стенки сосудов, перивасулярный склероз, эритроцитарные стазы в сосудах мелкого калибра, агрегаты тромбоцитов внутри сосудов, агломераты из эритроцитов и тромбоцитов в мелких артериях и капиллярах без образования фибринового сгустка. Эритроцитарные и тромбоцитарные стазы были в большей степени выражены у пациентов второй группы.
Всем больным ИП была выполнена эндобронхиальная ЛДФ с целью изучения микрогемоциркуляции в проксимальных отделах бронхиального дерева. Показатель ПМ у всех больных ИП, как с впервые установленным диагнозом, так и при длительном анамнезе заболевания, был достоверно снижен по сравнению с контролем. В первой группе диагностировано достоверное повышение КV и σ, что свидетельствует о высокой вазомоторной активности, которая может быть следствием преобладания активных и пассивных механизмов регуляции кровотока. Во второй группе КV также был повышен, но достоверного изменения σ выявлено не было. В первой группе были значительно повышены амплитуды колебаний в эндотелиальном, нейрогенном, миогенном диапазонах (активные факторы контроля микроциркуляции); амплитуды колебаний в дыхательном диапазоне снижались по сравнению с контролем, достоверного изменения амплитуды колебаний в сердечном диапазоне не выявлено. Во второй группе амплитуда колебаний в эндотелиальном диапа-
зоне также была значительно повышена по сравнению с контролем (р<0,001); достоверных изменений колебаний в нейрогенном и миогенном диапазонах выявлено не было. Диагностировано значительное снижение амплитуд колебаний в Д- и С- диапазонах (табл. 62).
Изучалось влияние лечения на показатели эндобронхиальной микрогемоциркуляции при ИП. Больные получали комплексное лечение гидроксимочевиной или рекомбинантными интерферонами, кровопускания или эритроцитоферез, дезагреганты и т.д. При нормализации гематокрита (не выше 45%) исследование повторяли. У больных обеих групп ПМ достоверно увеличивался по сравнению с показателем до лечения, но полностью не нормализовался. Выявлено достоверное снижение Аэ, в группе больных IIA стадии по сравнению с этими показателями до начала терапии, однако, полной нормализации эндотелиальных амплитуд не наблюдалось. Ан, Ам и Ад у пациентов первой группы после стабилизации гематокрита нормализовались. У больных во IIБ стадии ИП при стабилизации гематокрита нормализовались сердечные и дыхательные амплитуды. Амплитуды колебаний в эндотелиальном диапазоне лишь несколько снизились (табл. 62).
Отсутствие полной нормализации всех показателей ЛДФ после стабилизации гематокрита объясняется полиэтиологичностью нарушений функционирования микроциркуляторного русла. Кроме эритроцитоза и тромбоцитоза, сладж-синдрома на снижение параметров микрогемоциркуляции оказывают влияние нарушения тромбоцитарного и плазменного гемостаза, состояние эндотелия сосудов, регуляция тканевого сосудистого тонуса, показатели рН и рО2, гормональный фон и многие другие факторы.
Таблица 62
Сравнительная характеристика показателей ЛДФ
в проксимальных отделах бронхов у здоровых лиц и больных ИП (M±m)
|
|
|
Клинические группы |
|
|
|
Показатели |
Контроль |
Больные ИП IIA стадия (n=18) |
Больные ИП IIБ стадия (n=12) |
|||
до |
после нормализации |
до |
после нормализации гемато- |
|||
|
(n=20) |
|||||
|
лечения |
гематокрита |
лечения |
крита |
||
|
|
|||||
ПМ, ПЕ |
82,3± |
46,5±2,96 |
67,2±5,01 р1<0,05; |
43,6±5,25 |
60,6±3,25 р1<0,01; |
|
|
5,3 |
р1<0,001 |
р3<0,01 |
р1<0,001; |
р3<0,01 |
|
|
|
|
|
р2>0,05 |
|
|
σ, ПЕ |
10,7± |
14,9±1,23 |
11,9±2,03 р1>0,05; |
12±2,46 |
12,2±2,02 р1>0,05; |
|
|
0,5 |
р1<0,01 |
р3>0,05 |
р1>0,05; |
р3>0,05 |
|
|
|
|
|
р2>0,05 |
|
|
Кv,% |
13,8± |
30,6±1,51 |
14,8±2,33 р1>0,05; |
34,7±3,18; |
15,2±2,8 |
|
|
1,2 |
р1<0,001 |
р3<0,01 |
р1<0,001; |
р1>0,05; |
|
|
|
|
|
р2>0,05 |
р3<0,01 |
|
Аэ, ПЕ |
3,9±0,4 |
6,44±0,37 |
5,99±0,73 р1<0,05; |
6,65±0,32 |
5,95±1,17 р1<0,05; |
|
|
|
р1<0,001 |
р3>0,05 |
р1<0,001; |
р3>0,05 |
|
|
|
|
|
р2>0,05 |
|
|
Ан, ПЕ |
3,2±0,7 |
5,91±0,47 |
5,1±0,9 |
3,45±0,71 |
4,57±0,27 р1>0,05; |
|
|
|
р1<0,01 |
р1>0,05; |
р1>0,05; |
р3>0,05 |
|
|
|
|
р3 >0,05 |
р2<0,01 |
|
|
Ам, ПЕ |
3,6±0,8 |
5,51±0,25 |
3,99±0,97 |
1,95±0,34 |
2,48±0,25 |
|
|
|
р1<0,05 |
р1>0,05; р3>0,05 |
р1>0,05; |
р1>0,05; |
|
|
|
|
|
р2<0,001 |
р3>0,05 |
|
Ад, ПЕ |
3,7±0,5 |
1,97±0,32 |
4,53±0,92 |
1,95±0,31 |
4,0±0,92 |
|
|
|
р1<0,01 |
р1>0,05; р3<0,05 |
р1<0,01; |
р1>0,05; |
|
|
|
|
|
р2>0,05 |
р3<0,05 |
|
Ас, ПЕ |
3,4±0,4 |
3,83±0,34 |
3,8±0,58 |
1,33±0,28 |
2,58±0,64 р1>0,05; |
|
|
|
р1>0,05 |
р1>0,05; р3>0,05 |
р1<0,001; |
р3>0,05 |
|
|
|
|
|
р2<0,001 |
|
|
Примечание: достоверность различий: р1- по сравнению с контролем; р2- между группами больных ИП; р3 – между показателями ЛДФ до и после нормализации гематокрита.
92
При проведении корреляционного анализа выявлены статистически значимые связи между снижением ПМ и увеличением количества эритроцитов и тромбоцитов в периферической крови, повышением гемато-
крита (r = - 0,61, р<0,001, r = - 0,43, р<0,05, r = - 0,48,
р<0,05, соответственно). Установлена достоверная взаимосвязь между амплитудой колебаний в Э-диапазоне и уровнем эритроцитоза, гемоглобина и размерами селезенки (соответственно r = 0,86, р<0,001, r = 0,50,
р<0,05 и r = 0,45, р<0,05).
Полученные результаты свидетельствуют о том, что у больных ИП имеют место значительные нарушения в системе эндобронхиальной микрогемоциркуляции, а, следовательно, и в микроциркуляторном русле всей бронхолегочной системы. Важную роль в нарушении эндобронхиальной микрогемоциркуляции у этих пациентов играет повышенная масса циркулирующих эритроцитов и тромбоцитов, усиление агрегационной способности тромбоцитов, повышение вязкости крови. При анализе ритмических составляющих колебаний кровотока у больных ИП в стадиях IIA и IIБ отмечено значительное повышение амплитуд колебаний в Э-диапазоне, что может свидетельствовать о наличии эндотелиальной дисфункции. Отмечается различное распределение значений нейрогенной активности микрососудов в зависимости от стадии заболевания. У пациентов в стадии IIA диагностировано повышение амплитуд колебаний в нейрогенном диапазоне, указывающее на снижение периферического сопротивления артериол с развитием артериолярной вазодилатации. Амплитуды колебаний в нейрогенном диапазоне у больных в стадии IIБ достоверно не отличались от аналогичных в контроле. Амплитуды миогенных колебаний были значительно повышены в стадии IIA, что говорило о расслаблении прекапилляров, в стадии IIБ амплитуды миогенных колебаний были снижены, что свидетельствовало об усилении тонуса прекапилляров. Возможно, одной из причин развития артериолярной вазодилатации и расслабления тонуса прекапилляров у больных ИП на ранних этапах опухолевой прогрессии является необходимость лучшего кровоснабжения тканей при наличии полнокровия, эритроцитарных и тромбоцитарных стазов. На поздних стадиях гемобластоза имеют место необратимые дистрофические изменения стенки сосудов, периваскулярный склероз. Эритроцитарные стазы и агрегаты тромбоцитов внутри сосудов, агломераты из эритроцитов и тромбоцитов в мелких артериях и капиллярах, как показали данные гистологического исследования, выражены в гораздо большей степени. Вероятно, этим можно объяснить отсутствие компенсаторных механизмов улучшения эндобронхиального микроциркуляторного кровотока на поздних этапах опухолевой прогрессии ИП.
Анализ пассивных механизмов регуляции показал снижение амплитуд колебаний в дыхательном диапазоне при сохранении кардиальных амплитуд у больных ИП в стадии IIA, что свидетельствует о нарушении оттока крови из нутритивного русла при сохраненном поступлении в него крови. По снижению кардиальной и дыхательной амплитуд у больных ИП в стадии IIБ мы судили о снижении притока крови в микроциркуляторное русло и ее оттока в венулы. Основной причиной
этого является наличие эритроцитарных стазов, агрегатов тромбоцитов, агломератов из эритроцитов и тромбоцитов в сосудах микроциркуляторного русла бронхов. Эритроцитоз и тромбоцитоз выражены в гораздо большей степени у больных ИП IIБ стадии, что способствует прогрессированию синдрома повышенной вязкости крови. Все это препятствует адекватному кровотоку по сосудам микроциркуляторного русла.
Исследование функциональной способности диафрагмы проведено 28 пациентам с ИП. Двое лиц ИП IIБ стадии после спленэктомии были исключены из исследования. У всех 28 наблюдаемых изменений ТД не выявлено. У пациентов во IIA стадии заболевания эхоструктура диафрагмы была однородной. У 8 больных (80%) во IIБ стадии отмечается неоднородность эхоструктуры диафрагмы и уплощение её купола. У больных ИП IIА стадии ЭДс не имела достоверных различий по сравнению с контрольной группой, но показатели ЭДф были снижены. Во IIБ стадии ИП отмечается достоверное снижение экскурсии диафрагмы как при спокойном, так и при форсированном дыхании по сравнению с контрольной группой и группой больных со IIA стадией. На фоне проводимой терапии (кровопускания, эритроцитоферез) при нормализации гематокрита у пациентов первой группы отмечалось значительное сокращение размеров селезенки и восстановление показателей функциональной способности диафрагмы (площадь селезенки до лечения составила 84,8±2,21см2, по сравнению с контролем р<0,001, после
– 56,4±3,91см2, р<0,01, между показателями больных ИП до и после нормализации гематокрита - р<0,01). У больных второй группы размеры печени и селезенки при восстановлении гематокрита значительно не изменялись: площадь селезенки до проведения кровопусканий - 118±13,7см2, р<0,001, после нормализации гематокрита – 107,5±5,92см2, р<0,001, между показателями больных ИП до и после нормализации гематокрита - р>0,05, экскурсия диафрагмы при спокойном и форсированном дыхании оставалась сниженной (табл. 63).
При исследовании газового состава венозной крови у больных ИП отмечено достоверное снижение показателя рО2 в обеих группах (30,6±2,09 мм рт ст, р<0,05 и 27,6±2,45 мм рт ст, р<0,01, соответственно) и повышение показателя pСО2 (51,7±1,6, р<0,01, 50,3±1,59, р<0,01, соответственно) по сравнению с контрольной группой. Снижение рО2 можно объяснить тем, что вследствие нарушения функциональной способности диафрагмы, нарушается вентиляция нижних зон обоих легких, а также изменением этого показателя при высоком тромбоцитозе.
ЭХО-КГ выполнена 30 больным ИП. Первичной патологии сердца у этих лиц не было. У больных во IIA стадии заболевания показатели СрДЛА в условиях покоя достоверно не отличались от показателей контрольной группы, в среднем составляли - 15,6±0,41 мм рт. ст., (по сравнению с контролем - 14,99±0,61, р>0,05). Показатели СрДЛА во IIБ стадии отличались от показателей как в контрольной группе, так и больных ИП во IIA стадии: 17,6 ±0,44 мм рт. ст., р<0,01. Легочная гипертензия выявлена лишь у 4 лиц из второй группы с высоким эритроцитозом и значительной гепатоспленомегалией - 21,6 ± 0,3мм. рт. ст, р<0,001.
93

Таблица 63 Показатели ультразвукового сканирования диафрагмы
у больных ИП (M±m)
|
|
|
Клинические группы (n= 30) |
|
||
|
Кон- |
Больные ИП IIA стадии |
Больные ИП IIБ |
|||
Показа- |
(n=18) |
стадии (n=10) |
||||
троль |
||||||
тель |
|
при норма- |
|
при норма- |
||
(n=20) |
|
|
||||
|
до лечения |
лизации ге- |
до лечения |
лизации ге- |
||
|
|
|||||
|
|
|
матокрита |
|
матокрита |
|
ТД (мм) |
5,8±0,2 |
5,6±0,3; |
5,7±0,4 |
6,1±0,3; |
6,1±0,2 |
|
|
|
р1>0,05; |
р1>0,05; |
р1>0,05; |
||
|
|
р1>0,05 |
||||
|
|
р2>0,05 |
|
р2>0,05 |
||
|
|
|
|
|||
ЭДс (мм) |
20,6± |
19,4±2,3 |
19,6±2,4 |
13,5±1,5; |
15,5±1,7 |
|
|
1,36 |
р1>0,05; |
р1<0,01; |
р1<0,05; |
||
|
р1>0,05 |
|||||
|
|
р2>0,05 |
|
р2>0,05 |
||
|
|
|
|
|||
ЭДф (мм) |
80,2±4,5 |
41,7±2,2р1<0 |
75,6±5,6 |
29,5±3,6; |
40,5±3,9; |
|
|
|
,001 |
р1>0,05; |
р1<0,001; |
р1<0,001; |
|
|
|
р2<0,001 |
|
р2<0,05; |
||
|
|
|
|
|||
Примечание: р1 – достоверности различий между показателями больных ИП и контрольной групп; р2 – достоверности различий между показателями больных ИП до и после лечения.
Проведенный корреляционный анализ выявил достоверные обратные корреляционные связи между ЭДф и уровнем тромбоцитов в периферической крови, площадью селезенки и СрДЛА: r=-0,46, р<0,05; r = -
0,85, р<0,001; r=0,41, р<0,05, соответственно. Досто-
верная корреляционная связь с ЭДс установлена только с площадью селезенки, r=-0,47, р<0,05.
Основной причиной снижения функциональной способности диафрагмы является ее компрессия увеличенными печенью и селезенкой. Только у 2/3 исследуемых ИП IIА стадии была умеренно увеличена селезенка, она сокращалась после проведения кровопусканий, поэтому у таких больных диагностировано снижение экскурсии диафрагмы лишь при форсированном дыхании. Во IIБ стадии ИП у больных имеет место миелоидная метаплазия селезенки и печени, проявляющаяся их значительным увеличением. В данной группе больных диагностирован компресссионный синдром и значительное снижение экскурсии диафрагмы как при спокойном, так и при форсированном дыхании.
Таким образом, подтверждается важная роль нарушения функциональной способности диафрагмы у больных ИП в снижении вентиляционных возможностей легких, вследствие чего развивается гипоксемия и ЛГ. Можно утверждать, что механическая компрессия диафрагмы увеличенными печенью и селезенкой и развитие в ее сосудах сладж-синдрома способствуют снижению экскурсии диафрагмы, как одной из причин повышения давления в системе ЛА у больных ИП при прогрессировании заболевания. Изменению показателей газового состава венозной крови, вероятно, способствует развитие эритроцитарных и тромбоцитарных стазов в мелких сосудах и нарушение перфузии в легких. Плеторический синдром, сопровождающийся повышенной вязкостью крови, является существенным фактором, способствующим повышению давления в ЛА.
При исследовании функциональной способности правых отделов сердца методом ЭХО-КГ у больных ИП отмечается увеличение ТМПСПЖ в обеих группах. Достоверное увеличение КДРПЖ выявлено в группе больных во IIБ стадии (3,14±0,31, р<0,05). Диагностировано достоверное снижение ФВПЖ при прогрессировании заболевания. Таким образом, у больных ИП ди-
агностировано достоверное снижение показателей, характеризующих сократительную способность миокарда ПЖ (ФВ) и на поздних этапах опухолевой прогрессии снижение объемных показателей ПЖ (КДР), свидетельствующие о наличии дилатации ПЖ. Выявлено снижение максимальной скорости кровотока в раннюю диастолу (ЕТК), увеличение максимальной скорости потока крови в фазу позднего наполнения ПЖ (АТК) и уменьшение соотношения Е/А. Увеличение ЧСС у данных больных при ИП приводит к повышению АТК. ЕТК зависит от разницы градиента давления в полостях правого сердца и не связано с ЧСС. Его снижение происходит у больных с развитием дилатации полости ПЖ. Выявленные изменения свидетельствуют о развитии у больных ИП признаков диастолической дисфункции ПЖ. Достоверных изменений других показателей легочной гемодинамики при ИП не установлено (табл.64).
Таблица 64 Показатели легочной и внутрисердечной гемодинамики
при ИП (M±m)
|
Контроль |
Больные ИП |
Больные ИП |
|
Показатели |
IIA стадия |
|||
(n=20) |
IIБ стадия (n=12) |
|||
|
(n=18) |
|||
|
|
|
||
ТМПСПЖд,см |
0,38±0,01 |
0,56±0,07, |
0,59±0,01, р<0,001, |
|
|
|
р<0,05 |
р1>0,05 |
|
КДРПЖ, см |
2,29±0,14 |
2,55±0,08, |
3,14±0,31, р<0,05, |
|
|
|
р>0,05 |
р1>0,05 |
|
КДОПЖ, мл |
111,7±3,65 |
108±0,9, р>0,05 |
104±1,8, р>0,05, |
|
|
|
|
р1>0,05 |
|
КСОПЖ, мл |
44,5±2,66 |
44,1±0,4, |
46,3±0,56, р>0,05, |
|
|
|
р>0,05 |
р1>0,05 |
|
УИПЖ, мл/м2 |
40,0±1,8 |
40,2±1,25, |
42,3±1,02, р>0,05, |
|
|
|
р>0,05 |
р1>0,05 |
|
ФВПЖ, (%) |
59,7±1,68 |
50,3±3,62, |
50,0±3,2, р<0,05, |
|
|
|
р<0,05 |
р1>0,05 |
|
ЕТК, м/с |
0,57±0,02 |
0,49±0,05, |
0,46±0,03, р<0,01, |
|
|
|
р>0,05 |
р1>0,05 |
|
АТК, м/с |
0,35±0,03 |
0,47±0,04, |
0,51±0,03, |
|
|
|
р<0,05 |
р<0,001,р1>0,05 |
|
Е/АТК |
1,62±0,05 |
1,12±0,14, |
0,99±0,09, |
|
|
|
р<0,01 |
р<0,001,р1>0,05 |
|
ТМЗСЛЖд, см |
1,1±0,05 |
1,35±0,03, |
1,37±0,04, |
|
|
|
р<0,001 |
р<0,001,р1>0,05 |
|
КДРЛЖ, см |
4,9±0,09 |
5,2±0,04, |
5,24±0,05, р<0,01, |
|
|
|
р<0,01 |
р1>0,05 |
|
КСРЛЖ, см |
2,87±0,05 |
3,13±0,08, |
3,12±0,06, р<0,01, |
|
|
|
р<0,01 |
р1>0,05 |
|
КДОЛЖ, мл |
124,5±5,0 |
111±4,06, |
107±4,42, р<0,05, |
|
|
|
р<0,05 |
р1>0,05 |
|
КСОЛЖ, мл |
45±2,5 |
37,1±1,75, |
35,8±1,52, р<0,05, |
|
|
|
р<0,05 |
р1>0,05 |
|
УОЛЖ, мл |
80,5±3,1 |
75,1±2,87, |
84,4±1,82, р>0,05, |
|
|
|
р>0,05 |
р1<0,01 |
|
МОЛЖ,л/мин |
4,8±0,5 |
5,78±0,12, |
5,71±0,11, р>0,05, |
|
|
|
р>0,05 |
р1>0,05 |
|
УИЛЖ, мл/м2 |
40,5±1,34 |
40,6±1,67, |
40,8±1,68, р>0,05, |
|
|
|
р>0,05 |
р1>0,05 |
|
СИЛЖ, л/мин/м2 |
3,01±0,08 |
3,31±0,13, |
3,74±0,34, р<0,05, |
|
|
|
р>0,05 |
р1>0,05 |
|
ФВЛЖ, (%) |
71,1±2,0 |
67,2±1,28, |
64,5±1,65, р<0,05, |
|
|
|
р>0,05 |
р1>0,05 |
|
ЕМК, м/с |
0,6±0,04 |
0,65±0,03, |
0,58±0,04, р>0,05, |
|
|
|
р>0,05 |
р1>0,05 |
|
АМК, м/с |
0,36±0,03 |
0,58±0,02, |
0,66±0,05, |
|
|
|
р<0,001 |
р<0,001,р1>0,05 |
|
Е/АМК |
1,66±0,06 |
1,18±0,08, |
0,95±0,11, |
|
|
|
р<0,001 |
р<0,001,р1>0,05 |
|
ТМЖПД, см |
0,97±0,04 |
1,11±0,02, |
1,23±0,05, р<0,001, |
|
|
|
р<0,01 |
р1<0,05 |
Примечание: р – достоверность различий по сравнению с контролем; р1 – достоверность различий между группами больных ИП.
94
Анализируя показатели функционального состояния миокарда ЛЖ у больных ИП, отмечено увеличение размеров ТМЗСЛЖД и ТМЖПд. Также выявлены признаки гипертрофии ЛЖ - увеличение размерных и снижение объемных показателей (КДР, КСР, КСО, КДО). Диагностировано достоверное изменение показателей, свидетельствующих о наличии диастолической дисфункции ЛЖ у больных ИП: увеличение АМК и снижение отношения Е/А. Выявлено снижение параметров, характеризующих сократительную функцию миокарда ЛЖ (ФВ) (табл. 64).
Данные изменения можно объяснить плеторическим синдромом и нарушением реологии крови, артериальной гипертензией у большинства больных ИП, пожилым возрастом большинства пациентов и наличием у них ИБС. В процессе лечения ИП в целом по группам показатели легочной и внутрисердечной гемодинамики достоверно не изменялись.
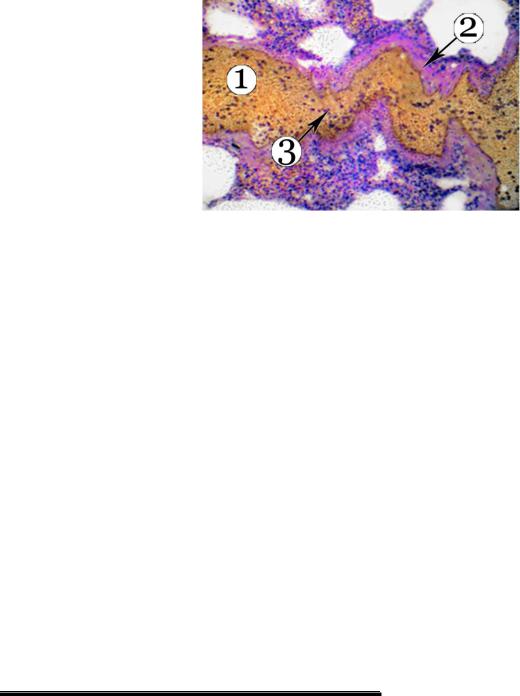
ИП – доброкачественный гемобластоз. За 3 года исследования ни у одного пациента не было диагностировано летального исхода вследствие прогрессии заболевания. У двух был констатирован летальный исход вследствие сопутствующей патологии: в одном случае – инфаркт миокарда, в другом случае – травма, несовместимая с жизнью; оба пациента из второй группы. При гистологическом исследовании легких этих пациентов диагностировали следующие изменения: дилатация и полнокровие сосудов, склеротические изменения стенки сосудов. Сосуды микроциркуляторного русла, главным образом венозные концы капилляров, были переполнены кровью, в них диагностировали агрегаты, состоящие из эритроцитов и тромбоцитов с развитием стазов (сладж-синдром) (рис. 51). В легких и бронхах пациентов, умерших при ИП, лейкемической инфильтрации выявлено не было. В диафрагме отмечены атрофические и склеротические изменения. Диагностированы некробиотические изменения миоцитов, разрастание стромы вокруг сосудов и межмышечном пространстве, участки липоматоза. Лейкемической инфильтрации диафрагмы при ИП не выявлено. В мелких сосудах отмечены дилатация, скопления эритроцитов и тромбоцитов с развитием сладж-синдрома.
На основании изучения морфофункционального состояния бронхолегочной системы у больных ИП можно сделать заключение:
1. Важной причиной нарушения эндобронхиальной микрогемоциркуляции при ИП является повышенное количество эритроцитов и тромбоцитов в периферической крови, способствующее развитию сладжсиндрома. Вследствие развития сладж-синдрома нарушается приток крови в микроциркуляторное русло и его отток в венулы. На начальных этапах опухолевой
прогрессии ИП артериолярная вазодилатация и расслабление тонуса прекапилляров могут являться компенсаторными реакциями с целью лучшего кровоснабжения тканей. На поздних стадиях гемобластоза вследствие необратимых изменений в сосудах микроциркуляторного русла эти компенсаторные механизмы отсутствуют, прогрессирует эндотелиальная дисфункция, что способствует дальнейшему нарушению микрогемоциркуляции, атрофическим изменениям слизистой оболочки бронхов.
Рис. 51. Больной Д., 1951г.р. Диагноз: Истинная полицитемия, IIА стадия. Сладж-синдром в легочном сосуде: дилатация и полнокровие легочного сосуда (1), склеротические изменения в его стенке (2), агрегаты, состоящие из эритроцитов и тромбоцитов (3). Окраска гематоксилином и эозином. Ув. ×
280
2.У больных ИП со значительным увеличением селезенки и печени, вследствие компрессионного синдрома нарушена функциональная способность диафрагмы. Другой важной причиной снижения экскурсии диафрагмы является ее специфическое поражение
–наличие эритроцитарно-тромбоцитарных стазов в сосудах и атрофические изменения миоцитов.
3.В процессе лечения плеторического синдрома у больных ИП без миелоидной метаплазии размеры селезенки уменьшаются, и сократительная способность диафрагмы восстанавливается. У пациентов с миелоидной метаплазией селезенки при нормализации гематокрита размеры селезенки и печени значительно не изменяются, и экскурсия основной дыхательной мышцы остается сниженной.
4.По мере прогрессирования ИП отмечается изменение легочной и внутрисердечной гемодинамики. На поздних этапах опухолевой прогрессии ИП выявлено значительное нарушение систолической и диастолической функции правого и левого желудочков.
95

ГЛАВА 7
КЛИНИЧЕСКАЯ И МОРФОФУНКЦИОНАЛЬНАЯ ХАРАКТЕРИСТИКА БРОНХОЛЕГОЧНОЙ СИСТЕМЫ У БОЛЬНЫХ ИДИОПАТИЧЕСКИМ МИЕЛОФИБРОЗОМ
7.1. Клинические особенности больных идиопатическим миелофиброзом
В общей структуре гемобластозов в Амурской области на идиопатический миелофиброз (ИМФ) приходится 4,6% (табл. 1). Заболеваемость составляет 0,5% на 100000 населения. Проведено комплексное обследование 35 пациентов с ИМФ, из них 17 мужчин и 18 женщин. Трепанобиопсия подвздошной кости для подтверждения диагноза была выполнена всем 35 больным. Мутация гена JAK2 (JAK2V6617F) определена у 20 больных. Средний возраст пациентов на момент обследования составил 59,8±2,21 лет (табл. 65).
Таблица 65 Распределение больных в зависимости от возраста,
в котором диагностирован ИМФ
Возраст |
Количество больных |
% от общего числа |
|
больных |
|||
|
|
||
До 49 лет |
4 |
11 |
|
50-59 лет |
10 |
28,5 |
|
60-69 лет |
11 |
32 |
|
70 лет и старше |
10 |
28,5 |
На момент проведения исследования циторедуктивная терапия гидроксимочевиной проводилась 20 больным, рекомбинантными интерферонами – 5 пациентам. Десять больных получали только симптоматическую терапию.
Спленомегалия и гепатомегалия различной степени выраженности были диагностированы у всех больных ИМФ, геморрагический синдром отмечался у 12 пациентов, у 15 пациентов по клиническим данным и данным УЗИ брюшной полости была диагностирована портальная гипертензия.
Умеренный лейкоцитоз (не более 50×109/л) диагностирован у 13 больных, у 12 пациентов имела место лейкопения (менее 3×109/л), у 10 человек количество лейкоцитов находилось в пределах 3 – 10 ×109/л. Снижение гемоглобина (менее 100 г/л) выявлено у 17 пациентов. Тромбоцитопения (менее 100×109/л) отмечена у 15, тромбоцитоз (более 400×109/л) - у 14 пациентов.
Различные классификации выделяют от двух до четырех стадий ИМФ, но все авторы сходятся в том, что ИМФ в своем развитии проходит стадию предфиброза (клеточная фаза), когда в костном мозге имеет место гиперрегенерация миелоидного ростка, стадию миелофиброза и остеосклероза с выраженным фиброзом костного мозга и значительной редукцией всех ростков кроветворения. У 18 обследованых больных была зарегистрирована клеточная фаза ИМФ, у 17 – фаза миелофиброза и остеосклероза (в дальнейшем по тексту фаза миелофиброза).
Таблица 66 Основные клинико-лабораторные показатели больных ИМФ
|
|
Количество больных |
|
Показатель |
первая группа |
вторая группа |
|
|
|
(n= 18) |
(n=17) |
Пол: мужской |
|
9 |
8 |
женский |
|
9 |
9 |
Фазы заболевания: |
клеточная |
18 |
- |
миелофиброз |
- |
17 |
|
Спленомегалия |
|
|
|
Нижний полюс определяется пальпаторно |
|
|
|
- не ниже 10 см из-под края реберной дуги |
5 |
2 |
|
- более 10 см из-под края реберной дуги |
7 |
4 |
|
- селезенка занимает всю левую половину |
6 |
11 |
|
живота или большую часть брюшной поло- |
|
|
|
сти |
|
|
|
Гепатомегалия. |
|
|
|
Нижний край пальпируется |
|
|
|
- не ниже 10 см из под края реберной дуги |
11 |
5 |
|
- более 10 см ниже края реберной дуги |
7 |
12 |
|
Портальная гипертензия |
|
- |
15 |
Изменения в клиническом анализе крови в |
|
|
|
период обследования |
|
|
|
Гемоглобин <100 г/л |
|
- |
17 |
Тромбоциты <100 × 109/л |
|
- |
15 |
>400 × 109/л |
|
14 |
- |
Лейкоциты: менее 3×109/л |
|
2 |
10 |
более 10×109/л |
8 |
5 |
|
от 3 до 10×109/л |
8 |
2 |
|
Нормоцитоз в периферической крови |
18 |
17 |
|
Дакриоциты |
|
18 |
17 |
Получают лечение: |
|
|
|
Гидроксимочевина |
8 |
12 |
|
Интерфероны |
|
5 |
- |
Симптоматическая терапия |
5 |
5 |
|
Стадия ИМФ: |
|
|
|
развернутых проявлений |
|
18 |
13 |
бластный криз |
|
- |
5 |
Клеточную фазу (клеточно-пролиферативную, предфиброза) ИМФ выставляли на основании трепанобиопсии подвздошной кости, где отмечалась гиперплазия двух или трех ростков кроветворения с преобладанием гранулоцитарного и мегакариоцитарного ростков с характерной морфологией мегакариоцитов, гиперплазия ретикулиновой стромы костного мозга с утолщением и беспорядочным расположением волокон, очаговый миелофиброз. При этом учитывали отсутствие клинико-лабораторных диагностических данных за истинную полицитемию и эссенциальную тромбоцитемию, отсутствие ph-хромосомы и гена bcr/abl.
Стадию миелофиброза (миелофиброза и остеосклероза) выставляли при выявлении в материале трепанобиоптата подвздошной кости диффузного коллагенового миелофиброза и остеосклероза.
Больные с эритремической стадией ИМФ исключались из исследования.
96
В зависимости от наличия анемического синдрома пациенты разделены на две группы: I – пациенты, у которых уровень гемоглобина выше 100г/л, это больные в клеточной фазе (n=18), II – больные с содержанием гемоглобина в периферической крови менее 100 г/л – в фазе миелофиброза (n=17). Основные клиниколабораторные данные пациентов обеих групп приведены в табл. 66.
У 6 пациентов, наблюдавшихся за период исследования, был зарегистрирован летальный исход, причиной которого в 5 случаях был бластный криз, в одном случае – тяжелый геморрагический синдром.
Сопутствующая патология у больных ИМФ представлена в табл. 67.
Таблица 67 Сопутствующая патология у больных ИМФ
Заболевание |
Первая группа |
Вторая группа |
|
(n= 18) |
(n=17) |
||
|
|||
Гипертоническая болезнь |
6 |
5 |
|
Ишемическая болезнь сердца |
12 |
8 |
|
ХОБЛ |
6 |
5 |
|
Язвенная болезнь желудка и |
2 |
1 |
|
12-перстной кишки |
|
|
|
Гастрит |
1 |
- |
|
Сахарный диабет |
3 |
2 |
|
Варикозное расширение вен |
1 |
2 |
|
нижних конечностей |
|
|
|
Вирусный гепатит |
1 |
- |
|
ЖКБ |
2 |
- |
7.2.Клиническая характеристика бронхолегочной системы у больных ИМФ
Обследовано 35 больных ИМФ. Пациенты разделены на группы в зависимости от фазы заболевания: I группа - больные в клеточной фазе заболевания с уровнем гемоглобина выше 100 г/л (n=18), II группа – больные ИМФ в стадии миелофиброза и остеосклероза, содержание гемоглобина в крови менее 100г/л (n=17). Из них у 11 лиц была диагностирована ХОБЛ. Это пациенты, злоупотребляющие курением, их результаты в данной главе не приводятся. У остальных 24 исследуемых сопутствующей патологии бронхолегочной системы выявлено не было. Среди этих 24 больных 12 из первой и 12 из второй групп.
У всех пациентов I группы при объективном осмотре грудная клетка была правильной формы, обе ее половины равномерно участвовали в акте дыхания. У 9 пациентов перкуторно над всей поверхностью легких определялся ясный легочный звук, аускультативно - везикулярное дыхание. У трех больных I гр., со значительной спленомегалией и компрессией диафрагмы отмечалось притупление легочного звука, ослабление дыхания в нижних отделах левого легкого (табл. 68).
У больных ИМФ, в стадии миелофиброза одышка наблюдалась у 9 человек. Обусловлена она была как выраженной гепато- и спленомегалией, так и анемическим синдромом. В данной группе выявлено ослабленное дыхание в нижних отделах левого легкого у 4 пациентов, у 5 – в нижних отделах обоих легких. У 4 больных II группы с портальной гипертензией и недостаточностью кровообращения в нижних отделах легких выслушивались влажные хрипы.
Таблица 68 Клинические характеристика бронхолегочной системы у
больных ИМФ вне присоединения БОД
|
Первая |
Вторая |
Клинические симптомы |
подгруппа |
подгруппа |
|
(n= 12) |
(n=12) |
Одышка |
3 |
9 |
- при физической нагрузке |
3 |
5 |
- в покое |
- |
4 |
Кашель |
- |
1 |
Форма грудной клетки: |
|
|
- цилиндрическая |
12 |
12 |
- эмфизематозная |
- |
- |
Ассиметрия грудной |
- |
5 |
клетки при дыхании |
|
|
Голосовое дрожание: |
|
|
- без патологии |
9 |
3 |
- усиление |
- |
- |
- ослабление в нижних отделах |
3 |
9 |
Перкуссия: |
|
|
- ясный легочный звук над всей |
|
|
поверхностью легких |
9 |
3 |
- притупление легочного звука |
3 |
9 |
- усиление легочного звука |
- |
- |
Аускультативно дыхание: |
|
|
- везикулярное дыхание над всей |
9 |
3 |
поверхностью легких |
|
|
- ослабление дыхания |
3 |
9 |
- жесткое дыхание |
- |
- |
Хрипы: - влажные |
- |
4 |
- сухие |
- |
- |
- крепитация |
- |
- |
Увеличение ЧСС |
2 |
10 |
Увеличение ЧДД |
- |
5 |
У 5 больных (II группа – миелофиброз) терминальная стадия заболевания проявлялась бластным кризом. Селезенка занимала большую часть брюшной полости, была болезненной при пальпации. У всех этих больных имел место компрессионный синдром с выраженной одышкой, наличием жидкости в обеих плевральных полостях, полости перикарда. Грудная клетка оставалась правильной формы, но отмечено отставание ее левой половины в акте дыхания. Определялось ослабление дыхания и голосового дрожания в нижних долях обоих легких, перкуторно – притупление легочного звука, аускультативно – в нижних отделах обоих легких выслушивалось ослабленное дыхание. Наличие жидкости в плевральной полости и полости перикарда подтверждалось после проведения ультразвукового и рентгенологического исследований.
7.3.Функциональное состояние бронхолегочной системы у больных ИМФ
Всем больным ИМФ без сопутствующей патологии бронхолегочной системы (n=24) выполнена спирография. Нарушений вентиляционной функции легких ни у одного пациента не было выявлено.
При проведении пикфлоуметрии нарушений бронхиальной проходимости не обнаружено. В среднем показатели ПСВ составляли 96% от должных величин на протяжении 1-2 недель мониторирования. Суточные колебания ПСВ не превышали повторяемости теста и составляли до 5% исходной величины.
Диагностическая фибробронхоскопия (ФБС) с эндобронхиальной ЛДФ проведена всем 24 больным
97

ИМФ. У 8 пациентов I группы диагностирована бронхоскопическая картина нормального трахеобронхиального дерева, у 4 больных - двусторонний диффузный эндобронхит, ИВ I степени. Клинических проявлений бронхита у этих больных не было. Во II группе патологических изменений со стороны трахеобронхиального дерева не выявлено у 5 пациентов. Двусторонний диффузный эндобронхит имел место у 7 пациентов II групп с ИВ I – II степеней (у 5 и 2 человек соответственно), хотя клинических проявлений воспалительного процесса в легких у них не было. Таким образом, у 50% больных ИМФ наблюдалось латентное течение хронического необструктивного бронхита по данным фибробронхоскопического исследования.
10 пациентам (5 из I и 5 из II групп) была выполнена эндобронхиальная биопсия слизистой оболочки бронхов со взятием биоптатов на 1,5 см дистальнее шпоры правого верхнедолевого бронха. В обеих группах при проведении гистологического исследования биоптатов выявили атрофию слизистой оболочки бронхов, очаговую инфильтрацию гранулоцитами V и VI классов разной степени выраженности (под базальной мембраной), дилатацию сосудов микроциркуляторного русла, у 7 больных – признаки хронического воспаления. У 4 пациентов I группы с уровнем тромбоцитов более 700×109/л диагностировали агрегаты тромбоцитов в мелких артериях и капиллярах. У двух пациентов I группы с уровнем лейкоцитов в периферической крови 30 – 40×109/л в просветах сосудов микроциркуляторного русла диагностировали лейкостазы. У пациентов II группы агрегатов из лейкоцитов и тромбоцитов в сосудах микроциркуляторного русла бронхов выявлено не было, т.к. в периферической крови у них отмечалась лейкопения и тромбоциопения. У этих больных были диагностированы дистрофические изменения стенки сосудов и периваскулярный склероз.
С целью изучения микрогемоциркуляции в проксимальных отделах бронхиального дерева всем больным ИМФ была выполнена эндобронхиальная лазерная допплеровская флоуметрия (ЛДФ). Показатель ПМ как у больных в клеточной фазе, так и в стадии миелофиброза был значительно снижен по сравнению с показателем контрольной группы. При этом у больных II группы ПМ был достоверно ниже аналогичного в I группе (р<0,05). Значение σ у больных I группы было повышено по сравнению с показателем группы контроля. Кv был значительно повышен во всех группах по сравнению с контролем. Анализируя показатели эндобронхиального кровотока было выявлено повышение амплитуд колебаний в эндотелиальном и нейрогенном диапазонах как у больных в клеточной фазе заболевания, так и в стадии миелофиброза. Достоверное повышение амплитуд колебаний в миогенном диапазоне отмечено только в клеточной фазе ИМФ (Табл.
69).
Повышение амплитуд колебаний в Э-диапазоне свидетельствует об эндотелиальной дисфункции в сосудах микроциркуляторного русла бронхов у больных ИМФ. Увеличение амплитуд колебаний в нейрогенном диапазоне свидетельствует о снижении периферического сопротивления артериол, развитии артериолярной вазодилатации, которая больше выражена в стадии миелофиброза. Увеличение амплитуд миогенных колебаний в I группе свидетельствовало о расслаблении прекапилляров микроциркуляторного русла. Достоверных изменений в Д- и С-диапазонах в целом по обеим группам больных ИМФ не было выявлено, несмотря на их снижение у 5 больных с бластным кризом. Таблица
69.
Таблица 69
Сравнительная характеристика показателей ЛДФ в проксимальных отделах бронхов у здоровых лиц и больных ИМФ (M±m)
|
|
|
Клинические группы |
|
|
Показатели |
|
больные ИМ в кле- |
Больные ИМ в стадии миелофиброза (n=12) |
||
контроль (n=20) |
при наличии анемического |
после купирования анемического |
|||
|
точной фазе (n=12) |
||||
|
|
синдрома |
синдрома |
||
|
|
|
|||
|
|
|
|
|
|
ПМ, ПЕ |
82,3±5,3 |
44,4±3,11 |
34,8±3,2 |
44,2±2,8, р1<0,001; |
|
|
|
р1<0,001 |
р1<0,001; р2<0,05 |
р2>0,05; р3<0,05 |
|
|
|
|
|
|
|
σ, ПЕ |
10,7±0,5 |
12,8±0,35 р1<0,01 |
13,63±0,41 |
11,2±0,6; р1>0,05; |
|
|
|
|
р1<0,001; р2>0,05 |
р2<0,05; р3<0,01 |
|
|
|
|
|
|
|
Кv,% |
13,8±1,2 |
31,1±3,18 |
35±4,13; |
30,8±4,12; р1<0,001; |
|
|
|
р1<0,001 |
р1<0,001; р2>0,05 |
р2>0,05; р3>0,05 |
|
|
|
|
|
|
|
Аэ, ПЕ |
3,9±0,4 |
6,23±0,58; |
7,33±0,29; |
6,1±0,33; р1<0,001; |
|
|
|
р1<0,01 |
р1<0,001; р2>0,05 |
р2>0,05; р3<0,01 |
|
|
|
|
|
|
|
Ан, ПЕ |
3,2±0,7 |
6,29±0,3 р1<0,001 |
7,18±0,22; |
5,9±0,2; р1<0,001; |
|
|
|
|
р1<0,001; р2<0,05 |
р2>0,05; р3<0,001 |
|
|
|
|
|
|
|
Ам, ПЕ |
3,6±0,4 |
4,91±0,45; |
4,62±0,8; |
3,8±0,2; р1>0,05; |
|
|
|
р1<0,05 |
р1>0,05; р2>0,05 |
р2<0,05; р3>0,05 |
|
|
|
|
|
|
|
Ад, ПЕ |
3,7±0,5 |
4,1±0,43 |
4,02±0,5; |
3,9±0,3; р1>0,05; |
|
|
|
р1>0,05 |
р1>0,05; р2>0,05 |
р2>0,05; р3>0,05 |
|
|
|
|
|
|
|
Ас, ПЕ |
3,4±0,4 |
3,76±0,4 |
4,32±0,35; |
4,02±0,45; р1>0,05; |
|
|
|
р1>0,05 |
р1>0,05; р2>0,05 |
р2>0,05; р3>0,05 |
|
|
|
|
|
|
|
Примечание: р1 – достоверность различий между показателями больных ИМФ и контрольной групп; р2 – достоверность различий между показателями ЛДФ больных ИМ в клеточной фазе и в фазе миелофиброза; р3-достоверность различий между показателями II подгруппы до и после купирования анемического синдрома.
98
Важной причиной нарушения эндобронхиальной микрогемоциркуляции у больных ИМФ в стадии миелофиброза является анемический синдром. Снижение показателей микрогемоциркуляции может быть обусловлено изменением количества форменных элементов крови и скорости их движения в микрососудах зондируемой области. У всех пациентов II группы диагностирован анемический синдром, уровень гемоглобина в среднем составлял 74±4,2 г/л, эритроцитов – 2,3±0,2±1012/л. Лечение анемии проводилось трансфузиями эритроцитсодержащих сред, реже эффект наступал при использовании эритропоэтинов. При достижении уровня гемоглобина более 100×109/л и эритроцитов более 3×1012/л эндобронхиальную ЛДФ повторяли. Отмечалось некоторое улучшение основных показателей ЛДФ, но их полной нормализации не было ни в одном случае (табл. 69), что обусловлено многофакторностью нарушений в микроциркуляторном русле.
У 5 пациентов II группы в данном исследовании был диагностирован бластный криз с лейкоцитозом 40
– 50 ×109/л. Кроме этого у всех пациентов имела место выраженная тромбоцитопения, поэтому им не выполняли эндобронхиальную биопсию слизистой бронхов, но всем была выполнена эндобронхиальная ЛДФ. В данной когорте пациентов отмечены наибольшие нарушения эндобронхиальной микрогемоциркуляции, в частности снижение ПМ (30,4±2,4 ПЕ; по сравнению с контролем р<0,001) и повышение Аэ (7,8±0,4ПЕ;
р<0,001) и Ан (7,5±0,3 ПЕ; р<0,001). У этих больных, в
отличии от других пациентов II группы, отмечено достоверное снижение амплитуд колебаний в дыхательном и сердечном диапазонах (2,3±0,3 ПЕ; р<0,05 и 2,1±0,25 ПЕ; р<0,05). Снижение ПМ в данном случае, помимо анемического синдрома и склеротических изменений сосудистой стенки, может быть обусловлено наличием лейкостазов, вероятность которых существует при наличии лейкоцитоза, этим же обусловлено нарушение притока крови в микроциркуляторное русло
иего оттока в венулы (снижение Ас и Ад).
Вгруппе больных в клеточной фазе ИМФ была установлена достоверная обратная корреляционная связь между снижением ПМ, тромбоцитозом (r = - 0,60, р<0,01) и площадью селезенки (r = - 0,43, р<0,05); прямая корреляционная зависимость между тромбоцитозом и амплитудами колебаний в Э- и Н- диапазонах
(r = 0,48, р<0,05 и r = 0,54, р<0,05, соответственно).
Вгруппе больных ИМФ в фазе миелофиброза выявлены статистически значимые корреляционные связи между уровнем гемоглобина, тромбоцитопенией, размерами селезенки и показателями ЛДФ. Диагностирована достоверная прямая связь между снижением уровня гемоглобина и снижением ПМ (r = 0,85, р<0,01), обратная связь между снижением уровня гемоглобина и повышением амплитуд колебания в Э-, Д-
диапазонах (r =-0,73, р<0,01, r =-0,87, р<0,01, соответ-
ственно). Установлена прямая корреляционная связь между снижением уровня тромбоцитов и снижением ПМ (r =0,58, р<0,01), обратная корреляционная связь между увеличением размеров селезенки и снижением показателей ПМ (r=-0,82, р<0,001). Диагностирована прямая корреляционная связь между амплитудой колебаний в Э-диапазоне и размером селезенки (r=0,65,
р<0,01).
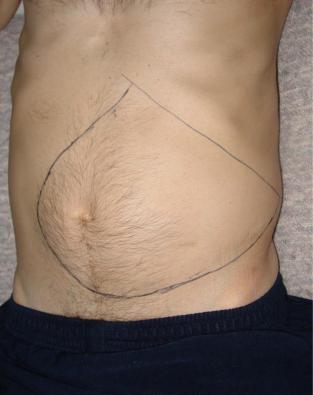
Рис. 52. Спленомегалия у больного ИМФ, фаза миелофиброза и остеосклероза
На основании вышеизложенного можно сделать заключение о том, что у больных ИМФ имеются значительные нарушения в системе эндобронхиальной микрогемоциркуляции и они нарастают по мере прогрессирования заболевания. Нарушения в системе микрогемоциркуляции у пациентов I группы (клеточная фаза) в первую очередь могут быть обусловлены гипертромбоцитозом. По нашему мнению, одной из причин развития артериолярной вазодилатации и расслабления тонуса прекапилляров у больных ИМФ в клеточной фазе может являться необходимость лучшего кровоснабжения тканей при наличии полнокровия и тромбоцитарных агрегатов. Артериолярная вазодилатация у больных II группы может быть обусловлена опухолевой интоксикацией и анемическим синдромом, а в стадии бластного криза еще и необходимостью улучшения тока крови при наличии лейкостазов.
ИМФ – это гемобластоз, при котором имеет место значительное увеличение размеров селезенки, особенно в фазе миелофиброза и остеосклероза (рис. 52). По данным УЗИ площадь селезенки в I группе составила
150±9,91см2 (р<0,001), во II группе - 216±17,7см2 (р<0,001).
Всем 24 больным ИМФ проведено ультразвуковое исследование диафрагмы. У больных в клеточной фазе заболевания изменения толщины диафрагмы не выявлено, но структура диафрагмы у 6 пациентов была неоднородной. У пациентов в стадии миелофиброза отмечается истончение диафрагмы, уплощение её купола. У всех больных отмечается снижение экскурсии диафрагмы как при спокойном, так и при форсированном дыхании. Наибольшее снижение функциональной способности диафрагмы выявлено у больных в фазе мие-
99

лофиброза со значительным увеличением печени и се- |
р<0,001). Выявлена связь между повышением уровня |
лезенки (табл. 70). Патогенетическое цитостатическое |
СрДЛА и снижением экскурсии диафрагмы при форси- |
лечение ИМФ в обеих фазах не привело к значитель- |
рованном дыхании (r=-0,63, р<0,05). В обеих группах |
ному сокращению размеров селезенки и печени, и ни у |
установлены достоверные корреляционные связи меж- |
одного пациента показатели функциональной способ- |
ду снижением рО2 и повышением СрДЛА (r=-0,88, |
ности диафрагмы достоверно не улучшились. |
р<0,001 и r=- 0,9, р<0,001). |
Таблица 70 Показатели ультразвукового сканирования диафрагмы у
больных ИМФ (M±m)
|
|
Клинические группы |
||
Показатель |
Контроль |
больные ИМ |
|
больные ИМ в стадии |
(n=20) |
в клеточной |
|
||
|
|
миелофиброза (n=12) |
||
|
|
фазе (n=12) |
|
|
|
|
|
|
|
ТД (мм) |
5,8±0,6 |
5,46±0,16, |
|
3,99±0,5, р1<0,01, |
|
|
р1>0,05 |
|
р2<0,01 |
ЭДс (мм) |
20,6±1,36 |
15,1±0,98, |
|
10,4±1,52, р1<0,001, |
|
|
р1<0,01 |
|
р2<0,05 |
ЭДф (мм) |
80,2±4,5 |
40,1±3,56, |
|
26,6±2,88, р1<0,001, |
|
|
р1<0,001 |
|
р2<0,01 |
Примечание: |
достоверности различий р1 – |
между показателями |
||
больных ИМ и контрольной групп; р2 – между показателями больных ИМ в зависимости от стадии заболевания.
При исследовании газового состава венозной крови установлено достоверное снижение уровня рО2и повышение рСО2 (табл. 71).
Развитие гипоксемии у больных ИМФ обусловлено компрессией грудной клетки значительно увеличенными печенью и селезенкой и снижением функциональной способности диафрагмы, нарушением перфузии, прогрессированием анемического синдрома. Более выражена гипоксемия была у больных II группы. При проведенном корреляционном анализе выявлена достоверная прямая корреляционная связь между уровнем гемоглобина и рО2 (r = 0,87, р<0,01). Установлена корреляционная связь между снижением ЭДс и снижением рО2 (r=0,60, р<0,01).
ЭХО-КГ выполнено всем пациентам с ИМФ. Показатели СрДЛА в среднем оставили 14,8±0,95 мм рт ст (по сравнению с контролем р>0,05) у больных в клеточной фазе заболевания; 17,4±0,4 мм рт ст, (р<0,05) – в стадии миелофиброза. Таким образом, средние показатели СрДЛА не превышали 20 мм рт ст. Однако, у 4 больных второй группы с бластным кризом отмечалось достоверное по сравнению с контролем повышение СрДЛА, в среднем этот показатель у них составил –
21,2±1,2 мм рт ст, р<0,05.
У больных в клеточной фазе заболевания наблюдается достоверная корреляционная связь между повышением СрДЛА и снижением экскурсии диафрагмы при форсированном дыхании (r=-0,52, р<0,05), площадью селезенки (r=0,46, р<0,05). Также установлена связь между увеличением площади селезенки и снижением экскурсии диафрагмы при форсированном дыхании (r=-0,56, р<0,01), что подтверждает роль спленомегалии с развитием компрессии грудной клетки в нарушении функциональной способности диафрагмы при ИМФ.
В группе больных ИМФ в стадии миелофиброза установлены достоверные корреляционные связи между увеличением размеров селезенки и снижением экс-
курсии |
диафрагмы как при спокойном (r=-0,83, |
р<0,01), |
так и при форсированном дыхании (r=-0,84, |
Таблица 71 Показатели газового состава крови у больных ИМФ
и в контроле (M±m)
|
|
Клинические группы |
||
Показатель |
Контроль |
больные ИМ |
больные ИМ |
|
(n = 20) |
в клеточной фазе |
в стадии миело- |
||
|
||||
|
|
(n=12) |
фиброза (n=12) |
|
рСО2, мм |
44,1±1,5 |
48,8±1,16, р1<0,05 |
54,75±1,11, |
|
рт. ст. |
|
|
р1<0,001; р2<0,001 |
|
|
|
|
|
|
рО2, мм рт. |
42,3±4,5 |
32,04±1,3, р1<0,05 |
28,72±2,28, |
|
ст. |
|
|
р1<0,05, р2˃0,05 |
|
|
|
|
|
|
рН |
7,4± |
7,35±0,008, |
7,32±0,01, |
|
0,002 |
р1<0,001 |
р1<0,001, р2<0,05 |
||
|
||||
|
|
|
|
|
Примечание: р – достоверности различий: р1 – между показателями больных ИМ и контрольной групп; р2 – между показателями больных ИМ в зависимости от стадии заболевания.
Проведенное исследование показывает, что при ИМФ значительно увеличенные селезенка и печень вызывают компрессию диафрагмы с нарушением ее подвижности, в результате чего происходит снижение вентиляционных возможностей легких, развитие гипоксемии и повышение давления в системе ЛА.
При изучении легочной гемодинамики с использованием ЭХО-КГ диагностировано увеличение ТМП- СПЖ, КДРПЖ, КСОПЖ (II группа), снижение УОПЖ и ФВПЖ. Большее снижение ФВПЖ выявлено у больных с анемией.
Анализируя показатели ЭХО-КГ больных ИМФ обеих групп, отмечается нарушение сократительной способности миокарда ПЖ – увеличение ТМПСПЖ, и снижение ФВПЖ, а также увеличение КДРПЖ. В большей степени указанные изменения характерны для пациентов в стадии миелофиброза, что, по-видимому, связано с наличием тяжелого анемического синдрома. Можно сделать заключение, что у больных ИМФ имеют место признаки систолической и диастолической дисфункции ПЖ, более выраженные при развитии анемии (табл. 72).
У больных ИМФ обеих групп отмечается увеличе-
ние ТМЗСЛЖд, ТМЖПД, КСРЛЖ и КСОЛЖ. Достоверное увеличение КДРЛЖ, и КДОЛЖ установлено только в фа-
зу миелофиброза при наличии тяжелого анемического синдрома. При этом большее увеличение данных показателей отмечается у больных в стадии бластного криза с развитием выраженного анемического синдрома. ФВЛЖ в обеих группах была снижена. Снижение параметров, характеризующих сократительную способность миокарда ЛЖ (ФВ) и увеличение размерных показателей (КДР, КСР) прогрессирует в процессе заболевания. Выявлены признаки, свидетельствующие о наличии диастолической дисфункции ЛЖ: увеличение ЕМК и в большей степени АМК, и, как следствие, снижение соотношения Е/АМК. При наличии анемического cиндрома происходит увеличение ЧСС и как следствие, повышение показателей МОЛЖ, УИЛЖ, СИЛЖ (табл. 72).
100
