
4 курс / Общая токсикология (доп.) / Toxikologia_ryb_Lukyanenko
.pdf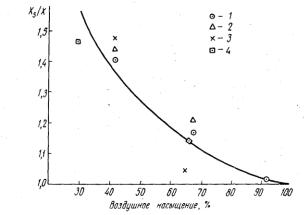
Р. Ллойд (Lloyd, 1960, 1961) изучал изменение устойчивости рыб к ядам промышленных сточных вод (на примере цинка, меди, свинца, фенола и аммиака) в зависимости от уровня кислородного насыщения. Несмотря на заведомо различный механизм действия этих веществ на рыб, автор установил сходный характер зависимости устойчивости рыб от насыщения воды кислородом: с понижением содержания кислорода падает устойчивость рыб к каждому из испытанных ядов (рис. 25). Иными словами, снижение токсикорезистентности рыб при дефиците кислорода не зависит от природы яда и всецело определяется особенностями дыхательной активности рыб.
Рис. 25. Зависимость токсичности некоторых ядов от концентрации растворенного кислорода:
Xs - концентрация яда при 100% насыщении;
X - концентрация яда при минимальном насыщении воды кислородом; 1 - цинк; 2 - свинец; 3 - медь; 4 - фенол (по Lloyd, 1961).
По мнению Р. Ллойда, ведущим моментом при этом является увеличение тока воды, проходящего через жабры и, как следствие этого, возрастание количества яда, достигающего поверхности жаберного эпителия с последующим проникновением в организм. Концентрация яда на поверхности жаберного эпителия определяется не только концентрацией яда в растворе, но и скоростью дыхания. По данным, полученным М. Шепардом (Schepard, 1955), с понижением концентрации кислорода в воде содержание гемоглобина в крови увеличивается и, что собственно важно, увеличивается скорость циркуляции крови через жабры.
Таким образом, снижение концентрации кислорода в воде вызывает сложный комплекс сдвигов в деятельности многих функциональных систем организма рыб, некоторые из которых имеют решающее значение в определении скорости проникновения и накопления токсических веществ в организме. Поэтому уровень растворенного кислорода в воде оказывает неспецифическое влияние на токсикоре-зистентность рыб ко многим ядам промышленных сточных вод. Это следует учитывать не только при планировании опытов по определению степени токсичности вещества, но и при биологическом нормировании предельно допустимых концентраций ядов промышленных сточных вод в естественных водоемах.
АКТИВНАЯ РЕАКЦИЯ СРЕДЫ (ВЕЛИЧИНА рН)
В классических работах С. Н. Скадовского (1923, 1926, 1928) показана решающая роль рН в распределении гидробионтов в пресноводных водоемах. В последующем было установлено, что концентрадия водородных ионов, определяющая активную реакцию среду, играет важную роль в изменении устойчивости рыб к различным токсическим компонентам промышленных сточных вод. При этом имеются в виду не крайние величины рН, которые оказывают губительное действие на рыб, а лишь те, которые не оказывают видимого токсического эффекта.
Величина рН морской воды обычно колеблется незначительно (8,1-8,3 или 7,5-8,5), Поэтому морские виды рыб менее устойчивы к резким колебаниям рН, чем пресноводные виды. По данным Е. Пауэрса (Powers, 1923), полученным в опытах с сельдью (CLupeu pallasi), изменение величины рН на 0,2 приводит к изменению пороговой концентрации кислорода, а предельно допустимые колебания рН для акулы находятся в области 8,2- 8,7.
Величина рН в пресных и особенно малопроточных водоемах широко варьирует не только в течение года, но и на протяжении суток (Зернов, 1949). Активная реакция среды определяется характером почв, растений, концентрацией растворенных карбонатов, бикарбонатов и многими другими факторами, влияющими на интенсивность и направленность биологических процессов в водоеме. В любых пресных водоемах присутствуют
71
кислоты органического происхождения, поэтому минерально-кислотные загрязнители могут суммировать свое ядовитое действие с кислотами естественного происхождения, вызывая массовую гибель рыб. Имеется обширная литература по вопросу выявления пороговой величины различных кислот и щелочей, оказывающих в основном токсическое действие на рыб путем изменения величины рН. Критический обзор этих работ представлен П.
Дудоровым и М. Катцом (Doudoroff, Katz, 1950).
SchaperCLaus (1926, 1927), Brown, Jewel (1926), Dahl (1927), Dyk (1940), Menzies (1927), Kreaser (1930), Southgate (1948) установили, что рыбы способны длительно существовать в кислой воде при рН ниже 5,0. Устойчивость различных пресноводных рыб к действию сильно щелочной воды изучали многие (Wells, 1915; Belding, 1927; Wiebe, 1931; Bandt, 1935, 1936; Sanborn, 1945). А. Уиб (1931) установил, что прудовые рыбы резистентны к быстрым изменениям рН в области от 6,0 до 9,6.
Суммируя все полученые данные, можно сделать вывод, что большинство пресноводных форм способны нормально жить в воде при рН 5,0-9,0 (табл. 31), а наиболее резистентные могут существовать даже при рН ниже
4,0 и выше 10,0.
Таблица 31
Предельно допустимые концентрации водородных ионов (рН) для рыб
(по W. Q. С, 1952)
Величина рН |
Характер влияния на рыб |
|
минимальная |
максимальная |
|
3,6 |
- |
Окунь живет 2 недели, карп погибает |
4.0 |
10,1 |
Граница для большинства устойчивых видов |
4.1 |
9,5 |
Диапазон устойчивости форели |
4.3 |
- |
Карп гибнет за 5 дней |
4,8 |
- |
Нижняя граница для форели |
4,8 |
9,2 |
Токсическая граница для рыб |
5,0 |
9,0 |
Допустимая область для большинства рыб |
5.4 |
- |
Нижняя граница для карпа и окуня |
5,4 |
11,4 |
Избегают (предел) |
6,0 |
11,0 |
Не избегают воду в этих пределах |
Вработах М Велса (Wells, 1918), В. Шелфорда (Schelford, 1918), А. Карстена (Karsten, 1934), Д. Лонгвелла
иФ. Пентелова (Longwell, Pentelow, 1935) и многих других выявлено, что изменение концентрации водородных ионов и смещение активности реакции в ту или иную сторону от нейтральной точки оказывает заметное влияние на устойчивость рыб к ядам, а также меняет степень токсичности различных компонентов промышленных сточных вод. Эти сведения касаются довольно обширной группы токсических веществ, из которых следует упомянуть аммиак, аммоний и аммонийные соли. Оказалось, что устойчивость рыб к некоторым аммонийным солям, таким, как NH4CI, (NH^SCU, значительно ниже в щелочной среде, чем в нейтральной (Wells, 1915; Schelford, 1918; Grindley, 1946).
П. Дудоров и М. Катц (1950) высказали предположение, что широкое расхождение литературных данных относительно степени токсичности аммонийных солей в различных водах (Powers, 1917; McKay, Vars, 1931; Ellis, 1937) объясняется колебанием величины рН. М. Эллис (1937) отмечает, что токсичность аммонийных солей увеличивается даже при незначительном повышении величины рН (с 7,4 до 8,0) почти в два раза. К. Вурман и др. (1947) подтвердили эти наблюдения. Опыты, проведенные с неионизированным свободным аммиаком и
аммонием (NH3 • Н20) и аммонийными солями на относительно устойчивом виде рыб - голавле (Squalls cephalus), показали, что устойчивость рыб к этим соединениям зависит от величины рН испытуемого раствора (от 7,0 до 9,5) и определяется главным образом активной реакцией среды.
Д. Лонгвелл и Ф. Пентелов (1935), изучая токсическое действие сульфидов на ручьевую форель, обнаружили, что устойчивость рыб и к этой группе ядов меняется с изменением величины рН в пределах от 6,0 до 9,0 единиц при постоянной концентрации яда - 3,2 мг/л. Понижение величины рН на две единицы (с 9,0 до 7,0) привело к резкому падению устойчивости (время гибели испытуемых рыб сократилось со 120 до 8 мин).
Изучая токсическое действие растворов различных металлов, обычно не обращали внимание на активную реакцию растворов. Между тем соли многих металлов интенсивно гидролизуются и их токсический эффект может быть обусловлен не непосредственным вредным действием катионов металлов, а конечной кислотностью раствора. Известно, например, что водные растворы хлоридов,, нитратов или сульфата аммония, железа, хрома, стронция, марганца, меди, свинца имеют кислую реакцию вследствие частичного гидролиза. В случае попадания таких растворов в естественную щелочную воду в осадок выпадает малорастворимая гидроокись или основание соли, а вместе с этим меняется фактическая концентрация токсического агента в растворе. Именно с этих
72
позиций следует подойти к оценке литературных данных (W. S. С. W. Р., 1939; Warrick et al., 1948) относительно способности некоторых рыб (молодь черного окуня) противостоять чрезвычайно высоким концентрациям сульфата меди до 150 мг/л CuS04-5H20 при растворении ее в жесткой, высокощелочной воде. При таких условиях образуется нерастворимое основание карбоната меди [Сu(ОН)2], выпадающее в осадок и не оказывающее токсического влияния на рыб. При аэрации токсического раствора во время опытов удаляется свободная СO2 и тем самым повышается величина рН. П. Дудоров (1953) в опытах, проведенных на ушастом окуне, показал, что рыбы в состоянии выдержать концентрацию 500 мг/л CuS04-5H20, добавленную в высокощелочную воду, в течение 6 дней. Раствор меди на протяжении всего опыта непрерывно аэрировали, а также за полтора часа до погружения рыб в него. В неаэрированном растворе подопытные рыбы погибали через 115 мин после погружения. В другой серии опытов к щелочной воде добавляли сернокислую медь - 208 мг/л и различные количества соляной кислоты. Токсический раствор аэрировался. При рН 7,1 в этом растворе в течение 10 дней погибло шесть окуней из 10. В растворе с рН 7,6; 8,0 и 8,4 (после аэрации) все 10 окуней оставались живы на протяжении 10 дней, а в более кислой среде при рН 6,5; 6,1 и 5,0 подопытные рыбы погибли за 6 ч. Интересны результаты опытов Д. Джонса (Jones, 1939), выполненные им на колюшке с раствором хлористого железа. Автор установил, что с понижением величины рН устойчивость рыб к хлорному железу резко падает. Так, например, при рН 4,6 (1,5 мг/л Fе) рыбы погибали в течение 72 ч, при рН 4,4 (2,0 мг/л Fe) - в течение 48 ч. Последующее снижение величины рН до 4,2 (3 мг/л Fe), 3,8 (7,0 мг/л Fe) и 3,4 (20 мг/л Fe) сопровождалось сокращением времени гибели и было равно 24; 6 и 3 ч (соответственно). Динамика гибели испытуемых рыб в различных растворах хлорного железа и в различных растворах соляной кислоты с соответствующей величиной рН, были идентичны, следовательно, токсичность растворов FeCL3 обусловлена главным образом его кислотностью. Этот вывод был подтвержден и в опытах с сернокислым железом. Раствор FeS04, вначале слегка кислый, в ходе опытов становился высококислотным и коричневым по цвету вследствие образования H2S04 и Fe(OH)3 путем гидролиза и окисления. Токсичность этого раствора также объясняется его кислотностью. Вместе с тем растворы Аl(NO3)3 и Cr2SO4 уже при рН, равном 5 или 6 единицам, вызывают гибель испытуемых рыб за 24-144 ч, что не связано с кислотностью этих растворов, ибо соляная кислота с равной величиной рН не оказывала на рыб выраженного токсического действия.
Последующие работы были направлены на выявление степени токсичности различных металлов. Можно сослаться на сообщение X. Бандта (Bandt, 1946) о зависимости токсичности железа от величины рН, а также на работы Ф. Трама и Р. Бенойта (Trama, Benoit, 1960) и С. Тарзвела и С. Хендерсона (Tarzwell, Henderson, 1960).
Изучая токсичность шестивалентного хрома, Трама и Бенойт пришли к выводу, что устойчивость ушастого окуня резко повышается с увеличением щелочности раствора. На основе этого факта они предложили снижать токсичность шестивалентного хрома путем разбавления сточных вод, содержащих хром, щелочью.
Устойчивость рыб к некоторым другим малораспространенным металлам (бериллий и уран) также определяется величиной рН (Tarzwell, Henderson, 1960). Все это свидетельствует о важном значении активной реакции среды в определении степени устойчивости рыб к большой группе металлических солей, встречающихся в составе различных промышленных сточных вод.
Имеются разрозненные литературные данные относительно зависимостн устойчивости рыб от величины рН и для некоторых других ядов промышленных сточных вод. Так, по данным английской лаборатории изучения водных загрязнений (R. W. Р., 1957), устойчивость радужной форели к токсическому действию хлора значительно выше в нейтральной и слабощелочной среде (7,4 и 8,2), чем в слабокислой (рН 6,2). Противоречивые данные получены в опытах с цианидами. Ф. Бринлей (Brinley, 1927), а затем К. Вурман и X. Вокер (Wuhrmann, Woker, 1948), изучая токсическое действие растворов цианидов, пришли к выводу, что активным началом при этом является недиссоциированная цианистая кислота (HCN), токсическое действие которой уменьшается с повышением величины рН. В опытах на голавлях они отметили, что токсичность раствора, содержащего 0,66 мг/л цианистой кислоты, удваивалась при изменении рН от 8,84 до 7,58. Однако Б. Соусгейт (1948) пришел к выводу, что токсичность цианистого натрия для радужной форели остается без каких-либо изменений при увеличении рН от 6,0 до 8,5.
По мнению английских исследователей (W. P. R., 1957) токсичность фенола также не зависит от величины
рН.
Таким образом, имеются работы, в которых значение величины рН не выявляется столь отчетливо или вообще отрицается. Следовательно, роль рН в определении устойчивости рыб к различным группам ядов промышленных сточных вод еще не ясна и нуждается в дополнительном исследовании. В связи с этим мы предприняли специальное исследование с целью выявить характер зависимости двух основных параметров концентрация - время, определяющих скорость развития, выраженность и исход токсического процесса от величины рН.
Мы изучали токсическое действие шести концентраций фенола: 25, 50, 100, 200, 400 и 800 мг/л при изменении величины рН от 4,0 до 11,0.
Методика опытов уже, была описана ранее, поэтому укажем только, что опыты проводились при стандартных условиях: температура 15°С, кислород 7-4,5 мг/л, жесткость 10° Нем. При статистической обработке результатов определения продолжительности жизни в токсическом растворе при различных рН использовали
73
непараметрический критерий Вилкоксона.
В первой части нашего исследования (150 карасей, возраст 2 + ) были проведены опыты при шести различных рН: 3,0; 4,0; 7,2; 9,0; 11,0 и 12,0 единиц. Концентрация фенола во всех случаях была 50 мг/л. Контрольные опыты, направленные на выявление устойчивости карасей к различной концентрации водородных ионов, показали, что крайние величины используемой нами шкалы рН - 3,0 и 12,0 остротоксичны и вызывают гибель в течение 1,0 и 2,2 ч (соответственно). Следующие две крайние величины рН - 4,0 и 11,0 не оказывали заметного токсического эффекта в течение 10 дней и поведение подопытных рыб ничем не отличалось от контрольных. Результаты опытов с раствором фенола 50 мг/л при пяти различных величинах рН (табл. 32) не позволили выявить существенных изменений устойчивости карасей к фенолу под влиянием изменения концентрации водородных ионов. Следует отметить, что в растворах фенола с крайними значениями рН- 4,0 и 11,0 имела место статистически недостоверная тенденция ускорения гибели рыб в сравнении с контролем (при рН 7,2). В связи с этим возникла необходимость более подробного изучения устойчивости рыб к фенолу при этих величинах: детально сопоставлялся характер зависимости концентрация-время при рН 4,0 и 11,0, но с большим диапазоном легальных концентраций фенола (от 25 до 800 мг/л), ибо сравнение эффективности всей шкалы концентраций несомненно дает больше сведений для оценки изучаемого фактора, чем суждение о нем по какойлибо одной концентрации.
Таблица 32
Средняя продолжительность жизни карасей в растворе фенола 50 мг/л при различных величинах рН
Величина рН |
Средняя длина рыб, |
Средняя масса рыб, |
Средняя продолжительность |
|
см |
г |
жизни, ч |
4,0 |
8,7 |
9,0 |
6,1 |
5,0 |
8,7 |
10,5 |
7,5 |
7,2 |
9,2 |
10,3 |
7,2 |
9,0 |
8,0 |
10,8 |
5,6 |
11,0 |
8,1 |
9,1 |
5,8 |
Примечание. Во всех случаях испытывали по 20 рыб.
Эта серия опытов была проведена на 360 карасях (240 опытные и 120 контрольных). Характер зависимости концентрация-время, а стало быть, и устойчивость при испытании токсичности фенола с рН 4,0 и 11,0 фактически не менялся в широком диапазоне летальных концентраций (рис. 26), следовательно, динамика гибели подопытных рыб имела сходный характер при различных рН. Устойчивость рыб к минимальной смертельной концентрации фенола 25 мг/л несколько изменилась и время гибели при рН 4,0 сократилось в 1,7 раза в сравнении с контролем (рН 7,2), а при рН 11,0-в 1,9 раза. Обращает на себя внимание и тот факт, что токсичность фенола увеличивалась как в кислом растворе, так и в щелочном. По-видимому, это можно объяснить неспецифическим повреждающим влиянием указанных величин рН, ослабляющих устойчивость рыб к различным патологическим воздействиям. В растворе фенола 800 мг/л при рН 4,0 караси гибли быстрее в среднем на 20 мин, чем в контроле. Различие оказалось статистически достоверным, но, отвлекаясь от чисто формального подхода, можно считать, что в токсикологическом отношении такое различие несущественно.
Рис. 26. Зависимость времени выживания карасей от концентрации яда при разных величинах рН: 1 - время выживания при рН 7,2; 2- при рН 4; 3 - при рН 11,0.
74

Выявленные незначительные различия продолжительности жизни карасей в растворах фенола в большинстве случаев не получили подтверждения при статистической обработке. Так, из шести концентраций фенола при величине рН 4,0 различие среднего времени выживания у контрольных и подопытных рыб оказалось недостоверным в четырех случаях (50, 100, 200 и 400 мг/л) и только при концентрациях 25 и 800 мг/л оно оказалось достоверным. Аналогичные данные были получены и при обработке результатов опытов при рН 11,0. Только в одном случае, в растворе фенола 25 мг/л, различие оказалось статистически реальным.
Результаты наших опытов совпадают с данными английских авторов (W. P. R., 1957) и свидетельствуют о слабой связи между устойчивостью рыб к фенолу и величиной рН токсического раствора.
Необходимо иметь в виду, что устойчивость рыб при крайних величинах рН 4,0 и 11,0, оказывающих, повидимому, субтоксическое влияние на организм, заметно снижается, что отражается на сокращении времени выживания при минимальных летальных концентрациях фенола.
Необходимо отметить, что имеются два пути влияния меняющейся концентрации водородных ионов на результаты опытов по определению степени токсичности различных компонентов промышленных сточных вод; прямой и косвенный. Косвенный путь - это изменение токсичности самих веществ за счет различных химических превращений, обусловленных сдвигом активной реакции среды в ту или иную сторону. В качестве иллюстрации можно сослаться на отмеченное выше изменение токсичности солей различных металлов вследствие частичного или полного гидролиза, образования плохо растворимых карбонатов и выпадения их в осадок. Известно, что токсичность таких соединений, как аммоний или различные цианиды, значительно выше у недиссоциированных молекул в сравнении с диссоциированными ионами. Именно поэтому токсичность аммония возрастает с увеличением рН раствора в силу нарастания концентрации неионизированных молекул. В данном случае изменение токсичности под влиянием рН достигается путем изменения концентрации токсического агента, а не его химического превращения. Нарастание токсичности цианидов имеет место при сдвиге рН раствора в кислую сторону и уменьшается при добавлении щелочей.
Однако основное влияние активной реакции среды на устойчивость рыб к ядам промышленных сточных вод состоит, по-видимому, в изменении интенсивности обмена и кислородного потребления, хотя имеющиеся литературные сведения не позволяют считать этот вопрос окончательно решенным. Б ряде работ была обнаружена связь между величиной рН и скоростью потребления кислорода. Мы имеем в виду результаты опытов Ф. Холла (Hall, 1931), В. Виба и его сотрудников (Wiebe, Fuller, 1933; Wiebe, McGavock, 1933; Wiebe et al.,
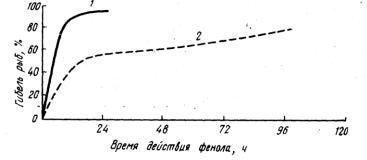
1934). Холл описал снижение скорости потребления кислорода у Sphaeroi-des maculatus при повышении кислотности воды с 8,5 до 6,5 единиц. В обширной серии работ, выполненных в лаборатории Виба на различных видах рыб, установлено, что в определенном диапазоне величин рН (6,5; 7,5; 8,1; 9,4; 9,6; 9,7) скорость потребления кислорода после кратковременного повышения устанавливается на прежнем уровне. Авторы показали также, что при крайних величинах рН устойчивость рыб к дефициту кислорода резко падает (рис. 27).
Рис. 27. Зависимость летальной концентрации кислорода (в мг/л) от рН среды: 1-окунь черный малоротый (при 25° С); 2 - крапия белая (при 25° С); 3 – радужная форель (при 11,7° С); 4 - радужная форель (при 13,5° С)
(по WIebe et. al., 1934).
Эти опыты особенно интересны, так как вскрывают существование зависимости пороговой концентрации кислорода от величины рН. Причем имеется определенный диапазон величин рН, с минимальной пороговой концентрацией кислорода для рыб. Увеличение или уменьшение рН (по отношению к этому диапазону) приводит
75
к повышению пороговой концентрации кислорода. Установлено (Leiner, 1937; Свиренко, 1937; Lindroth, 1942; Новикова, 1939), что смещение рН в кислую сторону приводит к заметному снижению интенсивности обмена. По данным Т. В. Новиковой (1939), полученным в лаборатории С. Н. Скадовского, интенсивность потребления кислорода карпом при снижении величины рН. Следует согласиться с мнением М. Лей-нер (1937), что в основе угнетения интенсивности обмена при нижних величинах рН лежит повреждающее субтоксическое действие ненормальной концентрации водородных ионов.
Таким образом, можно считать, что в основе изменения токсико-резистентности рыб под влиянием изменения активной реакции среды лежит повреждающее действие субтоксических величин рН и нарушение нормального хода и уровня обменных процессов, связанных с угнетением дыхания.
Величина рН является важнейшим экологическим фактором, оказывающим неспецифическое влияние как на степень токсичности различных компонентов промышленных сточных вод, так и на уровень токсикорезистентности рыб. Именно поэтому при биологическом нормировании предельно допустимых концентраций должны быть учтены особенности величины рН воды данного водоема и ее колебания.
ЖЕСТКОСТЬ ВОДЫ
Уже в работах Л. Легера (Leger, 1912) и А. Томаса (Thomas, 1915) было установлено, что токсическое действие солей тяжелых металлов резко снижается в жесткой и морской воде. Токсичность некоторых соединений сернокислого аммония и азотнокислого свинца вообще нельзя было определить в морской воде, поскольку они немедленно выпадали в осадок. Токсическое действие сернокислого цинка, бихромата калия, хлоридов кобальта и цинка на рыб в морской воде значительно ослаблено. Fundulus heteroCLitus выживали в растворах этих солей даже при концентрации 200 мг/л на протяжении 7-14 дней (Thomas, 1915). Но токсичность других солей тяжелых металлов (хлорид ртути, нитрат кадмия, сульфат и хлорид меди) проявлялась как в пресной, так и в морской воде.
Можно было предположить, что главной причиной ослабления токсичности солей тяжелых металлов в высокоминерализованных ) водах является образование осадков, ведущее к изменению активной концентрации токсического агента. Последующие опыты внесли существенные коррективы в понимание этого вопроса. М. Эллис (Ellis, 1937) в опытах на золотой рыбке показал, что устойчивость рыб в токсическом растворе сульфата меди (10 мг/л), приготовленного на дистиллированной воде, постепенно возрастает по мере добавления нитрата натрия (табл. 33).
Таблица 33
Влияние нитрата натрия на устойчивость рыб к сульфату меди (10 мг/л) (по Ellis, 1937)
Концентрация NaNO2, мг/л |
рН |
Время выживания, мин |
|
|
|
Дистиллированная вода |
4,0 |
150 |
500 |
5,7 |
180 |
5000 |
6,0 |
400 |
5000+50 |
6,4 |
765 |
Эллис нашел также, что устойчивость рыб к токсическому действию солей меди может быть повышена солями магния (Ellis a. Lad-ner, 1935). Кроме того, он выявил различие устойчивости рыб к фтору в мягкой и жесткой воде. При неизменной концентрации яда (1000 мг/л) время гибели различалось почти в пять раз: 12-29 ч в очень мягкой и 60-102 ч в жесткой воде.
Д. Джонс (Jones, 1938) провел обстоятельное исследование зависимости устойчивости колюшки к двум токсическим растворам нитрата свинца 0,4 и 1,0 мг/л (по РЬ) от степени жесткости воды. Изменение жесткости достигалось путем добавления в мягкую воду различных концентраций хлористого кальция (от 0 до 50 мг/л по Са). Как и в опытах М. Эллиса с сульфатом меди, устойчивость рыб увеличивалась по мере повышения концентрации СаС12 в токсическом растворе. Определяя время гибели колюшки в растворе нитрата свинца 1 мг/л при добавлении 0,5; 10; 20 и 50 мг/л СаС12, Джонс нашел, что оно постепенно увеличивалось: 1,3,6,7 и 10,5 дней (соответственно). Сходные данные были получены и в опыте, где вместо ZnN03 использовали ZnS04, а вместо СаС12-Ca(N03)2. И в этом случае колюшка выдерживала токсическое действие сернокислого цинка 2 мг/л (по Zn) в присутствии 50 мг/л Са на протяжении 10 дней, в то время как эта концентрация цинка без добавления кальция вызывала гибель рыб за 18 ч. Еще более высокая устойчивость к солям свинца в присутствии кальция была отмечена в опытах на золотой рыбке. В этих опытах рыба выдерживала токсическое действие 10 мг/л (по РЬ) в жесткой воде (50 мг/л по Са) на протяжении 15 дней, но погибала при этой же концентрации свинца в мягкой воде через 60-114 ч после погружения в токсический раствор.
76
Таким образом, в присутствии 50 мг/л Са колюшка выдерживает токсическое действие 1 мг/л свинца или 2 мг/л цинка, а золотая рыбка - 10 мг/л свинца без видимых признаков отравления. Между тем токсическое действие солей свинца, растворенных в мягкой воде, проявляется уже при концентрации 0,1-0,4 мг/л, а цинка 0,3-
0,7 мг/л (Jones, 1938; Oshima, 1931; Rushton, 1949).
Существующая четкая зависимость устойчивости рыб к токсическому действию солей тяжелых металлов от степени жесткости воды, подтвержденная данными, полученными в других, лабораториях (Doudoroff a. Katz, 1953; W. P. R., 1957), показывает, что причина изменения токсичности этой группы ядов промышленных сточных вод не может быть сведена к изменению их растворимости и образованию осадка. Она обусловлена, повидимому, влиянием кальция на клеточную проницаемость и режим поступления ядов в организм.
Показано, что повышенная жесткость воды ограничивает поступление в организм рыб стронция. По данным А. Н. Марея, М. М. Сау-рова и Г. Д. Лебедевой (1958), увеличение содержания кальция в пресной воде с 40-60 до 280-300 мг/л замедляет скорость поглощения и снижает коэффициент накопления стронция-90 в костях рыб в 5-6 раз. Дополнительные сведения о влиянии солевого состава и, в частности, жесткости воды на накопление радиоизотопов гидробиомтами можно найти в работе Г. Г. Поликарпова (1964).
Впоследнее время (Cairns, Scheier, 1957; Trama, Benoit, 1960; Lloyd, 1960; Tarzwell, Henderson, 1960 и др.)
подтверждены и значительно дополнены прежние наблюдения, а также получены новые данные, характеризующие зависимость устойчивости рыб к солям тяжелых металлов от уровня жесткости воды, ипыты с сульфатом цинка, проведенные на Salmo gairdnerii и Lepomis macrochirus, подтвердили данные Д. Джонса (1938)
относительно снижения токсичности ZnSO4 в жесткой воде в сравнении с мягкой. Зависимость I времени выживания рыб от концентрации была линейной в очень мягкой воде (12 мг/л СаСO3) и криволинейной в жесткой воде (1320 мг/л СаСO3). Кроме того, цинк менее токсичен в воде, содержащей хлорид кальция, чем в воде, жесткость которой обусловлена Са(НСO3)2 (Lloyd, 1960). В соответствии с ранними данными Л. Легера (1912) находятся результаты опытов Кэрнса и Шейера (1957), согласно которым токсичность пороговой концентрации солей цинка можно значительно снизить добавлением кальция. Устойчивость рыб к цинку в морской воде значительно выше, чем в пресной. Токсическое действие шестивалентного хрома и фтора значительно выше в жесткой воде, чем в мягкой (Neuhold a. Sigler, 1960). Установлено также, что пороговая концентрация бериллия и урана в жесткой воде в 10-100 раз больше, чем в мягкой. Поэтому жесткость воды в естественном водоеме, в который сбрасывают промышленные сточные воды, содержащие соли различных металлов, играет важную роль в определении степени их токсичности и уровня устойчивости рыб. Это обстоятельство должно найти свое отражение и на величине предельно допустимой концентрации различных солей тяжелых металлов.
Поиски зависимости токсичности некоторых других компонентов - промышленных сточных вод: кислот, аммиака, аммонийных солей :: и других, от степени жесткости воды были начаты также около (Г 50 лет назад (Leger, 1912; CLark a. Adams, 1913; Dodero, 1924, 1926), но в последующем не получили должного развития. Л. Легер (1912), сопоставляя токсичность соляной и серной кислот, пришел к выводу, что первая в 10 раз более токсична для форели и гольяна в дистиллированной воде, чем вторая. Однако в жесткой воде обнаруженное различие менее выражено. X. Кларк и Г. Адаме (1913) подтвердили это наблюдение и пришли к выводу, что нижняя граница токсичности соляной и серной кислот для пресноводных рыб в мягкой воде лежит в пределах 0,0001 N и 0,001 N (соответственно), а в жесткой воде снижается до 0,006 N.
М. Додеро (1924, 1926) показал, что минимальная летальная концентрация Na2S для гольяна, ручьевой и радужной форели в дистиллированной воде 2 мг/л (0,82 мг/л по S), а в жесткой воде в 25 раз больше - 50 мг/л (20,5 мг/л по S). Пороговые концентрации этого I яда в дистиллированной воде - 0,8 мг/л и в жесткой - 40,0 мг/л. Л.^Крейтман (Kreitmarm, 1929) нашел, что минимальная летальная концентрация H2S при одночасовом испытании оказалась равной 3 мг/л в мягкой воде и 2 мг/л. в жесткой.
Вряде работ (Wells, 1915; Ellis, 1937; Longwell, Pentelow, 1938; Grindley, 1946) установлена прямая связь между уровнем жесткости воды и устойчивостью рыб к аммиаку и аммонийным солям. Так, например, по данным Д. Лонгвелла и Ф. Пентелова (1938), устойчивость рыб к сульфиду аммония (NH.ibS в жесткой воде почти в 12 раз выше, чем в мягкой воде, если судить по минимальной летальной концентрации яда: 2,5 и 0,2 мг/л (соответственно).
До недавнего времени считали, что с увеличением жесткости устойчивость рыб к различным токсическим агентам всегда повышается. В последние годы в эти представления были внесены важные коррективы. Ф. Хупер
иА. Гженда (Hooper a. Gvbenda, 1955) установили, что устойчивость рыб и кормовых беспозвоночных к токсафену в мягкой воде выше, чем в жесткой. Д. Дэвис и В. Хардкастл (Davis, Hardcastle, 1959) определяли устойчивость молоди ушастого окуня (Lepomis macnochirus) и большеротого окуня (Micropterus salmoides) в растворах с различным уровнем жесткости к некоторым гербицидам, наиболее токсичны из которых изопропил- N-(3-хлорфенил) карбомат; диметил-амин-4 (2-метил-4 дихлорфенокси) масляная кислота; 1,2-дибромэтан. По их
данным величина CL50 в течение 24 ч в жесткой воде почти в 2 раза выше, чем в мягкой, и составляла 20-25 мг/л, в мягкой воде-10-15 мг/л. В данном случае, как и в опытах с ядами неорганического ряда, имеет место более высокая устойчивость рыб в жесткой воде по сравнению с мягкой. Однако в работе С. Гендерсона, К. Пиккеринга
иД. Коэна (Henderson, Pickering, Cohen, 1959) вновь описана более высокая устойчивость рыб к мылам в мягкой
77
воде, чем в жесткой. Авторы сопоставили устойчивость молоди Pimephabes promelas к синтетическим детергентам и хозяйственным мылам в жесткой и мягкой воде. Оказалось, что устойчивость рыб к детергентам не зависит от жесткости воды, а устойчивость к мылам резко падает в жесткой воде (почти в 40 раз). Поэтому степень токсичности детергентов и мыл примерно одинакова в мягкой воде, но резко отлична в жесткой.
Разноречивые фактические данные по существу оставляют открытым вопрос о роли жесткости воды в определении устойчивости рыб к ядам органического ряда. Однако результаты опытов, полученных с щелочноземельными и тяжелыми металлами, кислотами, аммиаком, сероводородом и др., в работах обзорного характера (Klein, 1957; Vivier, 1957; Beak, 1958) нередко переносятся и на другие ингредиенты промышленных сточных вод. Поэтому создается впечатление об универсальном значении выявленного феномена - зависимости устойчивости рыб к различным группам ядов промышленных стоков от солевого состава воды.
Для определения роли кальция в изменении устойчивости рыб к ядам органического ряда и, в частности, фенолу мы провели серию специальных экспериментов. Основная цель опытов - изучить характер зависимости концентрация - время в растворах с мягкой и умеренно жесткой водой (10,3-10,7° Нем.). Мы использовали умеренно жесткую воду, так как дальнейшее увеличение концентрации кальция и магния могло привести к побочному токсическому эффекту. Опыты проводились в обычных, описанных выше, методических условиях на карасях (310 рыб 2-3-летнего возраста). Жесткость воды контролировали трилонометрическим методом. Токсический эффект концентраций фенола 25, 50 и 100 мг/л определяли в трех повторных сериях опытов (по 20 рыб в каждом), а 200, 400 и 800 мг/л - в двух повторных сериях опытов. Время наблюдения 240 ч. Токсический раствор не аэрировался, а обновлялся через 24 ч. Основным индикатором в определении устойчивости рыб к яду служило время их гибели. Результаты опытов контролировали статистически.
Врастворе фенола 25 мг/л из 30 подопытных рыб погибли 24, шесть оставшихся карасей после погружения в чистую воду погибли в течение 3-6 последующих дней (поражены сапролегнией). Средняя продолжительность жизни испытуемых рыб составляла 172 ч. В мягкой воде из 30 карасей за 240 ч погибла 21 рыба, остальные девять рыб, несмотря на перемещение в чистую воду, также погибли от сапролегнии в течение последующих 2-5 дней. Средняя продолжйтельность жизни карасей этой группы равна 146 ч. Выявленное различие средних периодов выживания: 172 ч в жесткой и 146 ч в мягкой воде, оказалось статистически недостоверным.
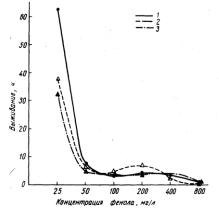
Вэкспериментах с концентрацией фенола 50 мг/л в обеих группах все рыбы погибли в период от 2,5 до 86 ч. Средняя продолжительность жизни рыб в жесткой воде была равна 6,8 ч, а в мягкой 52,2 ч, т.е. различалась более чем в 7 раз (рис. 28). Это различие статистически достоверно.
Рис. 28. Динамика гибели карасей в растворе фенола 50 мг/л, приготовленного на мягкой и жесткой воде: 1 - в мягкой воде; 2 - в жесткой.
Мы не смогли выявить статистически достоверного различия продолжительности жизни карасей в растворе фенола 100 мг/л, приготовленного на жесткой и мягкой воде, хотя среднее время выживания различалось более чем в два раза (5,5 и 11,2 ч). Здесь, как и в опытах с концентрацией фенола 25 мг/л, устойчивость рыб не претерпела значительных изменений под влиянием кальция. В опытах с концентрациями фенола 200, 400 и 800 мг/л средние периодывыживания карасей в жесткой и мягкой воде почти не отличались по абсолютному значению (табл.34).
Суммируя полученные данные, отмечаем, что жесткость воды в опытах с типичным представителем ядов органического ряда - фенолом, играет несравненно меньшую роль, чем с солями тяжелых металлов и некоторых других токсикантов. Это факт сам по себе достаточно интересен и не до конца ясен.
Наши опыты, проведенные на массовом материале, с использованием широкого диапазона летальных концентраций фенола (25-800 мг/л), позволяют считать, что характер зависимости концентрация - время при испытании токсичности в мягкой и жесткой воде претерпевает лишь незначительные изменения.
Интересно, что, рассматривая вопрос о характере зависимости между временем выживания испытуемых рыб и концентрацией фенола (Лукьяненко и Флеров, 1963а), мы отметили более высокую токсичность приготовленного на умеренно жесткой воде раствора фенола 100 мг/л в сравнении с 200 и 400 мя/л. В
78
последующих опытах этот факт неоднократно воспроизводился во всех случаях, когда токсический раствор фенола готовился на жесткой воде. Как и в опытах Р. Ллойда (1960) с цинком зависимость времени выживаний от концентрации яда в жесткой воде более криволинейна, чем в мягкой.
Анализируя литературные данные, можно представить себе два пути влияния кальция на устойчивость рыб к ядам и токсичность различных компонентов промышленных сточных вод. Один из них заключается в изменении растворимости токсического вещества, в частности солей тяжелых металлов, приводящим к образованию осадков, снижающих токсичность растворов. Другой состоит в том, что ионы кальция выступают в качестве физиологического антагониста токсических катионов тяжелых металлов, снижая клеточную проницаемость и затрудняя тем самым проникновение ядов внутрь клетки посредством «реакции поверхностной преципитации» (Heilbrunn, 1927, 1928). Вторая точка зрения, предполагающая активную роль кальция в снижении клеточной проницаемости, проливает свет на понимание причин изменения устойчивости рыб не только к токсическому действию катионов щелочных и тяжелых металлов, но и к ряду других компонентов промышленных сточных вод: кислотам, сероводороду, аммиаку и др. Полученные нами данные на модели фенольной интоксикации рыб, а также результаты опытов Д. Дэвиса и В. Хардкастла (1959) с гербицидами и С. Гендерсона, К. Пиккеринга и Д. Коэна (1959) с синтетическими детергентами пока трудно объяснимы и нуждаются в специальном экспериментальном анализе. Обобщая изложенные в этом разделе данные, необходимо подчеркнуть, что учет факторов водной среды приобретает первостепенный интерес при планировании экспериментов, направленных на выявление минимальных смертельных и предельно допустимых концентраций разнообразных токсических агентов для рыб того или иного конкретного водоема, с его особым гидрохимическим и гидрологическим режимом. В основе неспецифического влияния факторов водной среды на исход контакта рыб с ядами лежит изменение их устойчивости, обусловленное сдвигами в уровне метаболизма и нормального функционирования различных физиологических систем. Концентрация кислорода в воде, температура и величина рН, оказывая влияние на интенсивность потребления кислорода, приводят к изменению в деятельности различных функциональных систем, обеспечивающих компенсаторные возможности организма в ответ на повреждающее воздействие ядов промышленных сточных вод. Полученные в условиях кратковременного опыта величины летальных и предельно допустимых концентраций токсических агентов могут оказаться завышенными и при неблагоприятном уровне кислородного насыщения или температуры воды проявить свое токсическое действие. Поэтому необходимо при описании экспериментальных данных по токсичности различных компонентов промышленных сточных вод указывать условия проведения опытов, включающие в себя температуру, величину рН, жесткость и содержание кислорода в токсическом растворе.
Факторы водной среды влияют на исход контакта рыб с ядами и тем самым на величину предельно допустимой концентрации также и путем химических превращений компонентов промышленных сточных вод. Образуются осадки, приводящие в конечном счете к изменению концентрации действующего токсического агента (влияние жесткости и величины рН).
В связи с тем, что рассмотренные факторы водной среды оказывают свое влияние на величину пороговой
79
и предельно допустимой концентрации неодинаковым путем, роль каждого из них различна. По-видимому, значение и удельный вес конкретного фактора или их комбинации будут существенно меняться в зависимости от химической природы яда и физиологических особенностей испытуемых видов рыб. Сравнительное изучение роли различных факторов водной среды в определении уровня устойчивости рыб к различным компонентам промышленных сточных вод приводится крайне редко, но имеющиеся сведения подтверждают эту точку зрения
(Cairns, Scheier, 1957).
При планировании экспериментов для определения минимально летальной и предельно допустимой концентрации любого из исследуемых токсических агентов следует, вероятно, избирать не оптимальные для жизнедеятельности испытуемых рыб показатели рассмотренных факторов водной среды, а их пороговые величины, т. е. нижние уровни, при которых в поведении рыб не отмечается еще видимых изменений. Это позволит исключить возможные влияния колебаний факторов водной среды в естественном водоеме (в сторону их снижения) на устойчивость рыб к тому или иному ингредиенту промышленных сточных вод.
80
