
3 курс / Фармакология / Синтез_и_изучение_свойств_новых_материалов_с_противоопухолевой
.pdf
|
|
|
91 |
|
|
|
1.5 |
|
|
|
|
/ мград |
1.0 |
|
|
|
|
|
|
|
|
|
|
дихроизм |
0.5 |
|
|
|
|
0.0 |
|
|
|
|
|
Круговой |
|
|
|
|
|
-0.5 |
|
|
|
|
|
|
|
|
|
|
|
|
-1.0 |
|
|
|
|
|
240 |
260 |
280 |
300 |
320 |
|
|
|
l / нм |
|
|
Рис. 3.40. Спектры кругового дихроизма ДНК (C = 6,1 мкM) в зависимости от
концентрации соединения 3.6 (C = 3,89–12,3 мкМ).
3.7.2.3. Изучение связывания соединения 3.6 с ЧСА спектрофотометрическим
методом
Для идентификации сайтов связывания соединения 3.6 с ЧСА были проведены эксперименты по конкурентному взаимодействию соединения 3.6 с
сайтами связывания ЧСА в присутствии соответствующих маркеров сайтов связывания. Для определения констант связывания (Kbin), а также стехиометрии реакции связывания (n) использовалось уравнение Скэтчарда:
lg |
F0 |
- F |
= lg Kbin |
+ n lg Q , |
(3.22) |
|
F |
||||
|
|
|
|
|
где F0 — интенсивность флуоресценции ЧСА в отсутствие вещества 3.6, F —
интенсивность флуоресценции ЧСА в присутствии вещества 3.6, Q — концентрация соединения 3.6, М. На Рис. 3.41 представлены данные по связыванию соединения 3.6
с ЧСА в координатах Хилла ( lg F0 - F от lgQ).
F

92
lg[(F0-F)/F]
-0.8 -0.9
-1.0 -1.1 -1.2 -1.3 -1.4 -1.5 -1.6
-1.7 





 -5.3 -5.2 -5.1 -5.0 -4.9 -4.8 -4.7 -4.6 -4.5
-5.3 -5.2 -5.1 -5.0 -4.9 -4.8 -4.7 -4.6 -4.5
lgQ
Рис. 3.41. Зависимость в координатах Хилла процесса взаимодействия соединения
3.6 с ЧСА при 298,15 К в отсутствие маркеров сайтов связывания. F0 —
интенсивность флуоресценции ЧСА, F — интенсивность флуоресценции ЧСА в присутствии соединения 3.6, Q — молярная концентрация соединения 3.6.
Анализ констант связывания, представленных в Табл. 3.14, показывает, что соединение 3.6 образует прочный комплекс с ЧСА в субдомене IB и слабо связывается с субдоменом IIIA. Определение изменения энтальпии и энтропии реакции взаимодействия соединения 3.6 с ЧСА рассчитывали графическим методом с использованием уравнения Вант-Гоффа (Рис. 3.42):
ln K |
bin |
= - H |
+ S , |
(3.23) |
|
RT |
R |
|
|
|
|
|
где H и S — изменение энтальпии и энтропии реакций взаимодействия соединения 3.6 с ЧСА, R — универсальная газовая постоянная, T — абсолютная температура.
lnkbin
11
10
9
8
7
6
5
4
0.00320 |
0.00325 |
0.00330 |
0.00335 |
T-1 / K-1
Рис. 3.42. Температурная зависимость константы связывания соединения 3.6 с ЧСА в координатах lnKbin – T−1.
Данные, представленные в Табл. 3.14 позволяют сделать следующие выводы:
(1) значительное снижение lgKbin и n наблюдается в присутствии дигитонина; (2) в
Рекомендовано к изучению сайтом МедУнивер - https://meduniver.com/

93
присутствии ибупрофена незначительно снижается lgKbin и n; (3) увеличение lgKbin и n наблюдается в присутствии варфарина.
Изменение энергии Гиббса (ΔG) реакции связывания соединения 3.6 с ЧСА в
интервале температур 298,15–313,15 К рассчитывали по уравнению:
G = H -T S , |
(3.24). |
Табл. 3.14. Значения логарифмов констант связывания (lgKbin) и стехиометрии реакции связывания (n) соединения 3.6 с ЧСА.
Маркер сайта |
lgKbin / lgМ−1 |
n |
|
|
|
Без маркера |
4,13 ± 0,12 |
1,09 ± 0,02 |
Дигитонин |
1,80 ± 0,09 |
0,59 ± 0,02 |
Ибупрофен |
3,15 ± 0,06 |
0,89 ± 0,01 |
Варфарин |
5,81 ± 0,04 |
1,43± 0,08 |
Отрицательные значения G (Табл. 3.15) в интервале температур 298,15– 315,15 К свидетельствуют о термодинамически выгодном связывании соединения
3.6 с ЧСА. Изменение энтальпии (ΔH) имеет отрицательное значение (Табл. 3.15),
что характерно для образования водородных связей [111].
Табл. 3.15. Термодинамические параметры связывания соединения 3.6 с ЧСА. H,
S, G — изменение энтальпии, энтропии, энергии Гиббса.
T / К |
− H / кДж·моль−1 |
S / Дж·(моль К)−1 |
− G / кДж·моль−1 |
|
|
|
|
298,15 |
|
|
27,0 ± 1,2 |
303,15 |
|
|
23,0 ± 1,1 |
306,15 |
282,3 ± 8,4 |
856,3 ± 24,9 |
20,4 ± 1,1 |
310,15 |
|
|
16,9 ± 0,9 |
313,15 |
|
|
14,4 ± 0,9 |
|
|
|
|
94
3.7.3. Антирадикальная активность соединения 3.6
Для количественной оценки скорости реакции между соединением 3.6 и
ДФПГ была также использована кинетическая модель реакции псевдопервого порядка (3.20), которая позволила рассчитать значения констант скорости при различных температурах (Рис. 3.43, Табл. 3.16).
|
0.01 |
|
|
|
|
|
|
0.00 |
|
|
|
|
|
|
-0.01 |
|
|
|
|
|
)] |
-0.02 |
|
|
|
|
|
0 |
|
|
|
|
|
|
-A |
|
|
|
|
|
|
|
-0.03 |
|
|
|
|
|
)/(A |
|
|
|
|
|
|
|
|
|
|
|
|
|
t |
-0.04 |
|
|
|
|
|
-A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ln[(A |
-0.05 |
|
|
|
|
|
|
|
|
|
|
|
|
|
-0.06 |
|
|
|
|
|
|
-0.07 |
|
|
|
|
|
|
-0.08 |
|
|
|
|
|
|
-0.09 |
|
|
|
|
|
|
0 |
5 |
10 |
15 |
20 |
25 |
|
|
|
время / мин |
|
|
|
Рис. 3.43. Кинетическая зависимость восстановления ДФПГ веществом 3.6 при
298,15 К (■); 303,15 К (▼), 308,15 К (■), 313,15 К (▲), 318,15 К (●).
Табл. 3.16. Значения кажущихся констант скорости реакции восстановления ДФПГ веществом 3.6.
Т / К k·10−4 / мин−1
298,15 6,05 ± 0,23
303,15 7,28 ± 0,23
308,15 9,83 ± 0,16
313,15 25,71 ± 0,44
318,15 36,60 ± 1,68
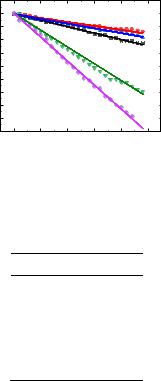
Использование уравнения Аррениуса (3.22) позволило рассчитать значения энергии активации Еa и предэкспоненциального множителя A из зависимости в координатах lnk от T−1 (Рис. 3.44).
Рекомендовано к изучению сайтом МедУнивер - https://meduniver.com/

95
lnk/lnмин-1
-5.6
-6.0
-6.4
-6.8
-7.2
-7.6
0.00315 |
0.00320 |
0.00325 |
0.00330 |
0.00335 |
T-1 / K-1
Рис. 3.44. Температурная зависимость логарифма константы скорости реакции восстановления ДФПГ веществом 3.6.
Значение энергии активации и предэкспоненциального множителя для реакции восстановления ДФПГ веществом 3.6 равны 76,4 ± 12,4 кДж/моль и 23,2 ± 4,9 мин−1, соответственно.
3.7.3.1. Фотодинамические свойства соединения 3.6
Деградацию фотосенсибилизатора оценивали путём измерения констант скорости фотодеградации (kdeg), значения которых определяли из кинетических зависимостей в координатах ln(At / A0) – t. Уменьшение kdeg свидетельствует о наличии у исследуемого соединения свойств тушителя синглетного кислорода. В
свою очередь, увеличение kdeg указывает на наличие у исследуемого соединения свойств индуктора образования синглетного кислорода. На Рис. 3.45 представлены экспериментальные данные по фотообесцвечиванию Радахлорина в присутствии соединения 3.6. Анализ полученных зависимостей свидетельствует о том, что соединение 3.6 проявляет антиоксидантные свойства, которые носят дозозависимый характер. Однако, антиоксидантные свойства вещества 3.6 менее выражены, чем у азида натрия [111].

|
|
|
|
96 |
|
|
|
0.01 |
|
|
|
|
|
|
0.00 |
|
|
|
|
|
|
-0.01 |
|
|
|
|
|
)] |
-0.02 |
|
|
|
|
|
0 |
|
|
|
|
|
|
-A |
|
|
|
|
|
|
|
-0.03 |
|
|
|
|
|
)/(A |
|
|
|
|
|
|
|
|
|
|
|
|
|
t |
-0.04 |
|
|
|
|
|
-A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ln[(A |
-0.05 |
|
|
|
|
|
|
|
|
|
|
|
|
|
-0.06 |
|
|
|
|
|
|
-0.07 |
|
|
|
|
|
|
-0.08 |
|
|
|
|
|
|
-0.09 |
|
|
|
|
|
|
0 |
5 |
10 |
15 |
20 |
25 |
|
|
|
|
t / мин |
|
|
Рис. 3.45. Кинетическая зависимость фотовыцветания Радахлорина в присутствии
вещества 3.6 (5 мкМ, 25 мкМ, 100 мкМ) в сравнении с азидом натрия (500 мкМ). A0
иAt — оптические плотности растворов Радахлорина при длине волны 664,9 нм до
ипосле облучения.
3.7.3.2. Фотоиндуцированный гемолиз соединения 3.6
На Рис. 3.46 представлена концентрационная зависимость степени фотоиндуцированного гемолиза от концентрации вещества 3.6.
контроль |
50 |
/T |
|
соединение3.6 |
50 |
T |
|
1.8
1.6
1.4
1.2
1.0
0.8
0.6
0.4
0.2
0.0
0 |
10 |
25 |
50 |
75 |
100 |
C / мкМ
Рис. 3.46. Концентрационная зависимость степени фотоиндуцированного гемолиза в присутствии соединения 3.6. C — молярная концентрация соединения 3.6, Т50соединение 3.6 — время фотоиндуцированного гемолиза 50 % эритроцитов в присутствии соединения 3.6, T50контроль — время фотоиндуцированного гемолиза 50
% эритроцитов в присутствии физиологического раствора.
Рекомендовано к изучению сайтом МедУнивер - https://meduniver.com/
97
Полученные экспериментальные данные свидетельствуют о том, что соединение 3.6 практически не влияет на фотоиндуцированный гемолиз, вызванный фотообесцвечиванием Радахлорина. Таким образом, в условиях эксперимента соединение 3.6 не обладает антиоксидантными свойствами.
3.7.3.3. Антирадикальная активность соединения 3.6 по отношению к NO-
радикалам
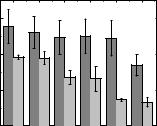
На Рис. 3.47 представлены результаты измерения активности соединения 3.6
и азида натрия в реакции взаимодействия с NO-радикалами в модельной системе,
содержащей нитропруссид натрия. Видно, что во всём диапазоне концентраций вещество 3.6 не проявляет антирадикальной активности [111].
0.6 |
|
|
|
|
|
0.4 |
|
|
|
|
|
A |
|
|
|
|
|
0.2 |
|
|
|
|
|
0.0 |
|
|
|
|
|
0 |
10 |
25 |
50 |
75 |
100 |
|
|
|
C / мкМ |
|
|
Рис. 3.47. Эффективность захвата NO-радикалов соединением 3.6 (темно-серый) по сравнению с азидом натрия (серый). С — молярная концентрация соединения 3.6.
3.7.4. Цитотоксичность соединения 3.6
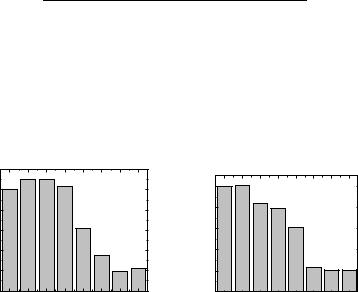
Соединение 3.6 проявило выраженное дозозависимое снижение выживаемости клеток аденокарциномы печени человека (SK-HEP-1; Рис. 3.48а) и
глиобластомы человека (T98G; Рис. 3.48б) при концентрации 50 мкМ.
98
Цитотоксичность соединения 3.6 сопоставимо с цисплатином и соединением 1.57
(Табл. 3.17) [28].
Табл. 3.17. Значения IC50 (мкМ) для соединений 1.57, 3.6 и цисплатина.
Наименование клеточной линии
|
T98G |
SK-HEP-1 |
|
|
|
Соединение 1.57 |
49,26 |
53,55 |
Соединение 3.6 |
44,9 |
22,2 |
Цисплатин |
34,8 |
50,2 |
|
|
|
|
|
|
|
|
(а) |
|
|
|
|
120 |
|
|
|
|
|
|
|
|
100 |
|
|
|
|
|
|
|
/ % |
80 |
|
|
|
|
|
|
|
Выживаемость |
|
|
|
|
|
|
|
|
60 |
|
|
|
|
|
|
|
|
40 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20 |
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
0 |
2 |
10 |
20 |
50 |
100 |
150 |
200 |
|
|
|
|
C / мкМ |
|
|
|
|
(б)
|
100 |
|
|
|
|
|
|
|
/ % |
80 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Выживаемость |
60 |
|
|
|
|
|
|
|
40 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20 |
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
0 |
2 |
10 |
20 |
50 |
100 |
150 |
200 |
|
|
|
|
C / мкМ |
|
|
|
|
Рис. 3.48. Влияние соединения 3.6 на выживаемость SK-HEP-1 (а); влияние
соединения 3.6 на выживаемость T98G (б).
3.7.5. Влияние соединения 3.6 на стабилизацию HIF-1α
Белок HIF-1α является одним из ключевых факторов канцерогенеза и отвечает за жизнеспособность опухолевых клеток в условиях гипоксии [112]. Для выяснения механизмов действия вещества 3.6 было изучено его влияние на стабильность HIF-
1α в модельных условиях: при химической гипоксии, индуцированной CoCl2. При снижении концентрации HIF-1α в условиях гипоксии снижается жизнеспособность опухолевых клеток. Клетки обрабатывали веществом 3.6 и селективным ингибитором трансляции HIF-1α KC7F2 в течение 8 ч в условиях химической
Рекомендовано к изучению сайтом МедУнивер - https://meduniver.com/
99
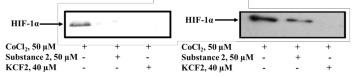
гипоксии (50 мкМ CoCl2) и анализировали относительное содержание белка HIF-1α
методом иммуноблоттинга (Рис. 3.49).
(а) (б)
Рис. 3.49. Соединение 3.6 снижает уровень экспрессии белка HIF-1α в клеточных линиях HeLa (а) и A549 (б).
Таким образом, показано, что соединение 3.6, снижает стабилизацию HIF-1α
в клеточных линиях HeLa и A549. В условиях гипоксии были зафиксированы более низкие значения жизнеспособности клеток HeLa и A549 (IC50 = 30,4 ± 3,1 мкМ и IC50
= 1,8 ± 0,3 мкМ, соответственно) по сравнению с нормоксией.
Показано, что триазинилтетразол 3.6 является гемосовместимым, и
цитотоксическим по отношению к клеточным линиям A549, HeLa, PANC-1, SK- HEP-1 и T98G. Комплекс исследований по изучению взаимодействия соединений 3.6
с ДНК позволяет заключить, что они обладают смешанным механизмом действия,
обладает антиоксидантной активностью.
3.8. Биосовместимость нековалентного конъюгата на основе GO и соединения
1.57
3.8.1.Исследование гемосовместимости
3.8.1.1.Гемолиз конъюгата GO-1.57
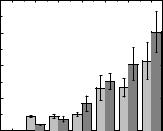
На Рис. 3.50 показано, что GO-1.57 при инкубации в течение 1 и 3 ч вызывал гемолиз во всём диапазоне концентраций; скорость гемолиза зависела от дозы и времени. Стоит отметить, что наноматериалы относятся к негемолитическим, если степень гемолиза не превышает 5 % [115].
100
|
4 |
|
|
|
|
|
|
)Ч100 % |
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
100 |
|
|
|
|
|
|
|
/ A |
2 |
|
|
|
|
|
|
) |
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
− A |
|
|
|
|
|
|
|
c |
|
|
|
|
|
|
|
((A |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
0 |
10 |
25 |
50 |
75 |
100 |
200 |
|
|
|
|
C / мгЧл−1 |
|
|
|
Рис. 3.50. Влияние GO-1.57 на степень гемолиза эритроцитов через 1 ч (светло-
серый) и через 3 ч (тёмно-серый).
3.8.1.2. Фотоиндуцированный гемолиз конъюгата GO-1.57
На Рис. 3.51 показана концентрационная зависимость степени фотоиндуцированного гемолиза в присутствии GO-1.57. Как видно из полученных данных, GO-1.57 по сравнению с контролем ингибировал гемолиз, индуцированный Радахлорином, что проявлялось в увеличении времени гемолиза 50 % эритроцитов.
На основании полученных данных можно сделать вывод, что GO-1.57 проявляет антиоксидантную активность, которая носит дозозависимый характер.
Рекомендовано к изучению сайтом МедУнивер - https://meduniver.com/
