
С.А. Мазунин, Г.С. Посягин ОСНОВЫ ФИЗИКО-ХИМИЧЕСКОГО АНАЛИЗА Часть 1. 1999г
..pdf
|
|
|
|
|
|
121 |
|
|
|
|
nD |
|
|
|
|
|
nD |
|
|
|
|
|
5 |
6 |
A-H O |
|
|
K-K |
|
|||
4 |
7 |
2 |
8 |
|
4 |
|
||||
|
|
B-H2O |
|
3 |
5 |
6 |
7 |
|||
|
|
|
|
2 |
|
|
A-X |
|||
|
|
|
|
|
|
|
||||
3 |
4 |
5 |
|
|
6 |
1 |
|
|
B-Y |
8 |
3 |
|
|
|
|
|
|
9 |
|||
2 2
1  1
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ba |
% соли |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
||||
Рис. 13. 2. Изотермы показателя прелом- |
K1 y1x1 |
K2 |
% соли |
|||||||
Рис. 13. 3. Изотермы показателя прелом- |
||||||||||
ления насыщенных растворов в сечениях |
ления насыщенных растворов в сечениях |
|||||||||
А-Н2О и В-Н2О системы А-В-Н2О |
К-К и В-Y системы А-В-Н2О |
|||||||||
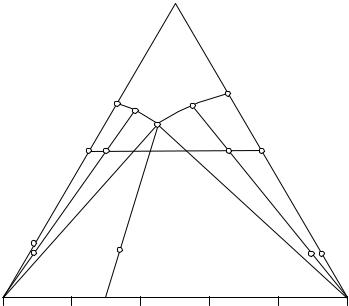
Для уточнения положения двойной эвтонической точки изучают сечения, составленные гетерогенными системами с постоянным содержанием воды, например сечение К - К. Функциональная зависимость величины физического свойства жидкой фазы от состава в данном сечении приведена на рис 13. 3. Так как сечение пересекает три фазовые области, то на графике функциональной зависимости имеются три пересекающиеся в двух точках линии.
Точка К1 находится на границе полей кристаллизации соли А и совместной кристаллизации солей А и В - предельной ноде А - Е.
Точка К2 находится на границе полей кристаллизации соли В и совместной кристаллизации солей А и В - предельной ноде В - Е. Проведя прямые АК1 и ВК2 до пересечения друг с другом, можно легко установить положение эвтонической точки Е. Таким образом, изучая сечения направления А - Х; В - У; К - К, не прибегая к химическому анализу, можно изучить изотерму растворимости.
В заключение выскажем несколько замечаний. В качестве физического свойства целесообразно использовать показатель преломления жидких фаз. Изломы на функциональных кривых можно определять на ЭВМ. Метод сечений требует кропотливого труда по взвешиванию веществ при приготовлении исходных смесей, а время, затрачиваемое на это, не всегда меньше времени, затрачиваемого на химический анализ насыщенных растворов. Другими словами, метод сечений особенно эффективен, когда затруднено проведение химического анализа насыщенного раствора.
13.3 Метод остатков Схрейнемакерса
Метод остатков Схрейнемакерса относится к изотермическим методам исследования растворимости.
122
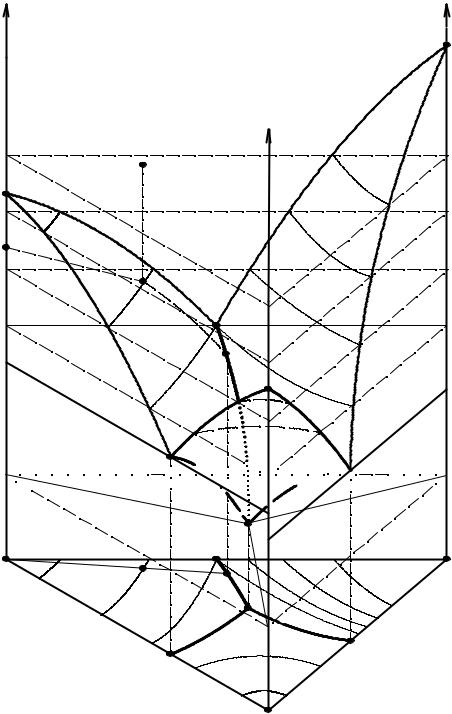
Сущность метода состоит в определении состава насыщенного раствора и твердой фазы, смоченной маточным раствором - остатка, методами химического анализа. По правилу соединительной прямой эти точки лежат на прямой, соединяющей составы насыщенного раствора и равновесной твердой фазы. Поэтому, изучив составы нескольких растворов и остатков и определив точку пересечения соединительных прямых (лучей кристаллизации), можно определить состав равновесной твердой фазы (см. рис 13.4).
H2O
RA |
G' |
Q' |
RB |
|
|
E |
|
F J
G  H Q
H Q
F" |
H" |
Q" |
J" |
G" |
|
|
0 |
20 |
40 |
60 |
80 |
100 |
A |
|
|
|
|
B |
Рис. 13. 4. Исследование изотермы растворимости методом остатков Схрейнемакерса и видоизмененным методом остатков
Таким образом можно определить состав кристаллогидрата, двойной соли или образование твердых растворов. В последнем случае лучи кристаллизации не пересекаются в одной точке, а показывают составы равновесных твердых растворов.
При использовании метода остатков Схрейнемакерса для изучения растворимости практически поступают следующим образом. Готовят исходные смеси (точки F, G H, Q, J, рис. 13.4), лежащие в различных частях фазовой диаграммы, таким образом, чтобы в них содержалось 15-20 % твердой фазы. Эти смеси термостатируют при постоянном перемешивании и периодически отбирают на анализ жидкую фазу.
После установления равновесия отфильтровывают жидкую фазу и влажный осадок (остаток) отбирают на анализ. Результаты анализов жидкой фазы
(точки RA, G', E, Q', RB, рис. 13.4) и остатка (точки F", G", H", Q", J", рис.13.4)
наносят на концентрационный треугольник и определяют состав равновесной твердой фазы по результатам нескольких опытов. Соответствующие равновес-
123
ные составы жидкой фазы при этом определяют ход ветви растворимости данной твердой фазы на диаграмме.
13.4. Использование состава исходной реакционной смеси для изучения тройных водно-солевых систем (видоизмененный метод остатков)
Использование видоизмененного метода остатков основано на следующем свойстве состава исходной реакционной смеси: он, как и состав остатка, лежит на луче, соединяющем составы равновесных фаз - насыщенного раствора и твердой фазы. Соединяя состав насыщенного раствора с составом исходной смеси прямой линией, легко заметить, что построенный по этим составам луч также проходит через состав равновесной твердой фазы (см. рис. 13.4). Состав насыщенного раствора определяется аналитическими методами. Состав исходной смеси точно известен. При использовании этого способа отпадает необходимость в отборе остатка и его анализе.
13.5. Численное определение оптимального состава исходной реакционной смеси
Введем следующие обозначения. Состав предполагаемого насыщенного раствора (Xn, Yn ,Zn), где Xn, Yn, Zn - предполагаемое содержание компонентов X, Y, Z (воды) в составе насыщенного раствора. Состав равновесной твердой фазы (XT, YT, ZT), где XT, YT, ZT - содержание компонентов X, Y, Z(воды) в твердой фазе. Оптимальный состав исходной реакционной смеси (X, Y, Z) нужно вычислить.
По уравнению прямой
X − X n |
= |
Y − Yn |
= |
Z − Z n |
= K , |
(13.1) |
X T − X n |
YT − Yn |
|
||||
|
|
ZT − Z n |
|
|||
где К может меняться от 0 до 1, легко вычислить значения X, Y, Z, задавая желаемую долю твердой фазы (К) от массы всей навески:
X |
= |
K (XT − Xn ) |
+ Xn , |
(13.2) |
|
Y |
= |
K (YT −Yn ) |
+ |
Yn , |
(13.3) |
Z |
= |
K (ZT −Zn ) |
+ |
Zn . |
(13.4) |
В случае, когда К = 1 (жидкая фаза отсутствует), уравнения 13.2-4 дают следующие решения: X = XT; Y = YT; Z = ZT. В случае, когда К = 0 (твердая фаза отсутствует), X = Xn; Y = Yn; Z = Zn. Оптимальное значение величины К лежит в пределах от 0.2 до 0.3. При меньших значениях К возрастает ошибка определения состава твердой фазы, кроме того, могут быть получены ненасыщенные растворы. При больших значениях К возрастает количество твердой фазы, что затрудняет отбор жидкой фазы для анализа, также такие исходные смеси труднее доводить до равновесия.
Рассмотрим подробнее, как следует выбирать составы оптимальных реакционных смесей при исследовании тройной системы простого эвтонического типа, составленной солями X, Y и водой (Z).
124
Из справочника растворимости об этой системе известно, что растворимость соли X при температуре исследований равна X0, соли Y - Y0, состав эвтонического раствора при данной температуре неизвестен. Составы всех растворов условимся выражать в % мас.
Прежде всего определяем растворимость чистых солей, убеждаемся, что их растворимость совпадает со справочными данными, и экспериментально удостоверяемся в надежности выбранных методов химического анализа.
При использовании уравнения (13.1) для планирования изучения растворимости соли X оно будет иметь следующий вид:
|
X − X 0 |
= |
Z − (100 − X 0 ) |
|
= 0.2 . |
(13.5) |
|
100 − X 0 |
0 − (100 − X 0 ) |
||||||
|
|
|
|||||
Из уравнения (13.5) следует: |
|
|
|||||
X = 0.2·(100 - X0) + X0 , |
|
(13.6) |
|||||
Z = 0.2·(X0 - 100) - X0 + 100. |
|
(13.7) |
|||||
Для проверки правильности вычисления состава исходной смеси сложите значения X и Z, сумма должна быть равна 100.
При определении состава двойного эвтонического раствора будем считать, что содержание компонента X такое же, как и в насыщенном растворе (Xn = X0), содержание соли Y такое же, как и в насыщенном растворе (Yn = Y0), содержание воды легко вычислить по уравнению: Zn = 100 - X0 - Y0.
Равновесный состав твердой фазы должен содержать приблизительно одинаковое количество кристаллов безводных солей X и Y: XT= 50; YT = 50; ZT = 0. С учетом всех этих условий уравнение (13.1) будет иметь следующий вид:
X − X 0 |
= |
Y − Y0 |
= |
Z − (100 − X 0 − Y0 ) |
= K . |
(13.8) |
|
50 − Y0 |
0 − (100 − X 0 ) |
||||
50 − X 0 |
|
|
|
|||
Из уравнения (13.8), задавая различные значения К, можно вычислить несколько различных составов оптимальных исходных реакционных смесей, что необходимо для доказательства нонвариантности эвтонического раствора.
После проведения термостатирования вычисленных составов исходных смесей и определения состава эвтонического раствора (XE, YE, ZE) целесообразно приступать к исследованию линий моновариантного равновесия.
Предположив, что составы насыщенных растворов лежат на прямой, соединяющей соответствующие точки растворимости с эвтоническим раствором, легко вычислить любое необходимое количество предполагаемых составов насыщенных растворов по уравнению прямой (для ветви растворимости соли Y):
X n − X E |
= |
Yn |
− YE |
= |
Z n |
− Z E |
= K , |
(13.9) |
|
0 − X E |
Y0 |
− YE |
Z 0 |
− Z E |
|||||
|
|
|
|
где: 0 < К < 1, К = 0 в эвтонической точке, К = 1 в точке растворимости соли Y.
При равномерном распределении точек по предполагаемой линии насыщенных растворов коэффициент К в формуле (13.9) можно вычислить по следующей формуле:
|
125 |
К = Н/(М+1), |
(13.10) |
где Н - номер точки по порядку, считая от эвтонической; М - желаемое количество точек на ветви растворимости.
Для определения состава исходной реакционной смеси кроме предполагаемого состава насыщенного раствора, вычисленного по формуле (13.9), необходимо знать состав твердой фазы. В поле кристаллизации соли Y: XT = 0; YT =
100; ZТ = 0. Формула (13.1) в этом случае будет иметь следующий вид: |
|
||||||
|
X − X n |
= |
Y − Yn |
= |
Z − Z n |
= 0.2 . |
(13.11) |
|
|
100 − Yn |
|
||||
|
0 − X n |
|
0 − Z n |
|
|||
Из формулы (13.11) легко вычислить состав оптимальной реакционной смеси (X, Y, Z). Для проверки правильности вычислений сложим значения X, Y и Z, сумма должна быть равна 100. Аналогичные вычисления можно проделать и для ветви кристаллизации соли X.
После проведения опытов с вычисленными составами реакционных смесей и определения составов насыщенных растворов последние наносят на концентрационный треугольник и строят изотерму растворимости.
13.6. Численное определение равновесного состава твердой фазы
В основе математического определения состава равновесной твердой фазы лежит вычисление координат точки пересечения двух линий, задаваемых двумя точками. Такими линиями могут быть два луча кристаллизации или луч кристаллизации и одна из сторон треугольника состава. Луч кристаллизации задается аналитически определенным составом насыщенного раствора и составом исходной реакционной смеси (Xu, Yu, Zu) или аналитически же определенным составом остатка.
Рассмотрим сначала наиболее простой случай - кристаллизацию безводного исходного компонента X в тройной системе X - Y - H2O. Введем следующие обозначения: XH - содержание компонента X в насыщенном растворе; YH - содержание компонента Y в насыщенном растворе; ZH - содержание воды в насыщенном растворе; Xu - содержание компонента X в исходной реакционной смеси или в остатке; Yu - содержание компонента Y в исходной смеси или в остатке; Zu - содержание воды в исходной смеси или в остатке; XT - содержание компонента X в твердой фазе; YT - содержание компонента Y в твердой фазе; ZT - содержание воды в твердой фазе.
Поскольку речь идет о поле кристаллизации компонента X, то будем определять координаты пересечения луча со стороной треугольника состава X - H2O. Для вычисления этих координат необходимо решить следующую систему уравнений:
X |
T |
− X |
H |
|
Y |
− Y |
|
Z |
T |
− Z |
H |
|
|
|
|
|
|
= |
T |
H |
= |
|
|
= K |
|
||||
|
|
− X |
|
Y − Y |
Z |
|
− Z |
|
|
|||||
X |
u |
H |
|
u |
H |
. |
(13.12) |
|||||||
|
|
u |
H |
|
|
|
||||||||
X T + |
ZT |
= |
100 |
|
|
|
|
|
|
|
||||
Поскольку YT = 0 на стороне X - H2O, то выражение:

126
(YT - YH)/(Yu - YH) = К1 определено и решение системы (13.12) сводится к вычислениям координат состава твердой фазы по следующим уравнениям:
(13.13)
(13.14)
Определение равновесного состава твердой фазы в поле кристаллизации Y аналогично, только определенным становится выражение
(XT - XH)/(Xu - XH) = К1, так как XT = 0 на стороне Y - H2O. Решение системы уравнений (13.12) в этом случае сводится к вычислениям искомых координат по двум следующим уравнениям:
YT = К1·(Yu - YH) + YH , |
(13.15) |
ZT = К1·(Zu - ZH) + ZH . |
(13.16) |
Определение равновесного состава твердой фазы в трехфазной области тройной эвтонической системы с кристаллизацией безводных солей не отличается от изложенных выше случаев.
Выражение (ZT - ZH)/(Zu - ZH) = К1 определено, так как ZT = 0. Определение состава твердой фазы сводится к вычислениям по следую-
щим уравнениям: |
|
YT = К1·(Yu - YH) + YH , |
(13. 17) |
XT = К1·(Xu - XH) + YH . |
(13. 18) |
Случай образования химического соединения более сложный - необходимо решать систему уравнений двух прямых. Введем в обозначениях верхний индекс, показывающий, к какой прямой относятся точки: один штрих для первой линии и два штриха - для второй:
XT − X H 'Xu '−X H '
XT − X H ''
X ''−X ''
u H
= |
YT −YH ' |
= |
|
ZT − ZH ' |
= K1 |
||||
|
|
|
|||||||
|
Yu '−YH ' |
|
Zu ' − ZH ' |
|
|||||
= |
|
YT −YH '' |
|
= |
ZT − ZH '' |
= K2 . |
|||
|
Yu ''−YH '' |
Zu '' − ZH '' |
|||||||
|
|
|
|
|
|||||
Решениями системы (13.19) являются следующие уравнения:
K1 = |
( X u ''−X H '' )(YH '−YH '' ) − ( X H '−X H '' )(Yu ''−YH '' ) |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
, |
|
( X |
u |
'−X |
H |
' )(Y |
''−Y |
'' ) − ( X |
u |
''−X |
H |
'' )(Y |
'−Y |
' ) |
||
|
|
|
u |
H |
|
|
u |
H |
|
|
||||
K2 = |
( Xu '−X H '' )(Yu '−YH ' ) −( Xu '−X H ' )(YH '−YH '' ) |
, |
||||||||||||
( X |
u |
'−X |
H |
'' )(Y |
'−Y |
' ) −( X |
u |
'−X |
H |
' )(Y |
''−Y |
'' ) |
||
|
|
|
u |
H |
|
|
u |
H |
|
|
||||
(13.19)
(13.20)
(13.21)
XT = К1(Xu' - XH') + XH' = К2(Xu" - XH") + XH" , |
(13.22) |
YT = К1(Yu' - YH') + YH' = К2(Yu" - YH") + YH" , |
(13.23) |
ZT = К1(Zu' - ZH') + ZH' = К2(Zu" - ZH") + ZH" . |
(13.24) |
Для проверки правильности вычислений необходимо сложить полученные по формулам (13.20-24) значения величин XT, YT, ZT, сумма должна быть равна 100%.
127
14. Тройные конденсированные системы плавкости простого эвтектического типа
14. 1. Объемная диаграмма состояния
Простейшая диаграмма состояния тройной конденсированной системы плавкости приведена на рис. 14.1. Эта диаграмма описывает процесс кристаллизации в том случае, когда из расплава выделяются только чистые кристаллические компоненты системы. Диаграмма представляет собой трехгранную призму, основанием которой служит концентрационный треугольник; температуры фазовых переходов откладываются на перпендикулярах, восстановленных из каждой точки треугольника.
Боковые поверхности объемной диаграммы представляют собой три диаграммы состояния двойных систем простого эвтектического типа . Температуры затвердевания этих трех эвтектик различны (ТI, TII, TIII).
Точки, отвечающие началу выделения кристаллов каждого из компонентов А, В, С из тройных расплавов различного состава , образуют соответствен-
но три кривые поверхности TA-eII -E-eI -TA , TB-eII -E-eIII -TB и TC- eI -E-eIII -TC.
Если спроецировать границы eIE, еIIE и eIIIE, представляющие собой линии двойного выделения, на основание диаграммы, то их проекции e'IE', е'IIE' и e'IIIE' разбивают концентрационный треугольник на три области. Из систем, составы которых отвечают областям Ае'IE'e'IIA, Be'IIE'e'IIIB и Ce'IE'e'IIIC, в первую очередь начинают выделяться кристаллы А, В или С соответственно.
Рассмотрим процесс охлаждения системы, отвечающей фигуративной точке S. Состав расплава не меняется, пока фигуративная точка исходной смеси не достигнет в процессе охлаждения точки S'. Эта точка лежит на поверхности кристаллизации компонента А. В момент достижения точки S' система еще однофазна. При дальнейшем охлаждении система распадается на две фазы - кристаллический компонент А и остаточный расплав, фигуративная точка которого при охлаждении перемещается по кривой S'-S", лежащей на поверхности кристаллизации компонента А. Расплав при этом обедняется компонентом А, выделяющимся в твердую фазу.
Расплав, отвечающий точке S", находится в равновесии с кристаллами двух компонентов А и В, поэтому последующее охлаждение сопровождается одновременным выделением кристаллов А и В. Фигуративная точка расплава при этом перемещается по кривой S"- E, представляющей собой часть кривой
еIIE.
В точке Е расплав находится в равновесии с кристаллами всех трех компонентов и представляет собой тройную жидкую эвтектику. Кристаллизация эвтектики происходит при постоянной температуре, отвечающей точке Е (ТЕ). Система в это время является псевдононвариантной, поскольку в процессе кристаллизации давление остается постоянным, а в равновесии находятся четыре
128
фазы - жидкая, состава Е, и три твердые, чистые компоненты А, В и С (0 = 3 - 4 + 1).
T T
|
t,° C |
|
|
T B |
|
|
|
|
|
|
|
T |
|
|
T 1 |
S |
|
|
|
T A |
|
|
|
|
|
|
|
|
|
T 2 |
|
|
|
|
a ' |
|
|
|
|
T 3 |
|
|
|
|
|
e I I |
|
|
|
T 4 |
S ' |
|
|
T I I |
|
|
|
||
T I |
S " |
T |
C |
T I I I |
|
||||
|
|
|
||
|
|
|
|
|
T E 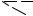






 e I
e I 






 e I I I
e I I I 


 T E
T E
|
|
E |
|
|
|
A |
|
e 'I I |
|
|
B |
s ,s ' |
s " |
|
|
|
|
T 2 |
|
|
|
T 1 |
|
T |
|
E ' |
|
|
|
3 |
T E |
TT 2 |
|||
|
T |
4 |
3 |
||
|
T 4 |
e 'I |
e 'I I I |
|
|
|
|
T 4 |
|
|
|
T 3 C
Рис. 14. 1. Объемная диаграмма состояния тройной системы плавкости В обычной работе пользуются проекциями объемных диаграмм на их
основание. Подобные проекции представляют собой отображение на плоскость изотермических кривых на поверхностях первичных выделений, пограничных кривых двойной кристаллизации, эвтектической точки и т. д. Проекции получают совершенно также, как это делают при вычерчивании географических
129
карт: на картах нанесены горизонтали, отвечающие определенным высотам над уровнем моря, горизонтали же на поверхности проекций объемных диаграмм представляют собой кривые линии составов сплавов, начинающих кристаллизоваться при одинаковой температуре. Пример подобного построения приведен на рис. 14. 1.
Рассекая объемную диаграмму горизонтальными плоскостями Т1, Т2, Т3, Т4 и т. д., получаем на поверхностях первичных выделений кривые, отвечающие этим температурам. Проекция этих линий на основание образует сеть кривых, которая позволяет судить о рельефе поверхности и предсказывать последовательность выделения различных фаз при кристаллизации расплавов не хуже, чем с помощью объемной диаграммы.
14.2. Плоская диаграмма состояния. Основные пути протекания процессов кристаллизации
На рис. 14. 2 приведена ортогональная проекция объемной диаграммы состояния тройной системы простого эвтектического типа на плоскость треугольника состава (так называемая плоская диаграмма ликвидуса). На диаграмме имеются следующие элементы: А, В, С - точки, отвечающие чистым компо-
нентам; АВ, ВС и АС - отрезки, отвечающие двойным системам; eI, eII, eIII - точки, отвечающие двойным эвтектикам; площади АеIEeIIA, BeIIEeIIIB и CeIEeIIIC - поля кристаллизации компонентов А, В и С соответственно; кривые еIE, еIIE и
еIIIE - линии вторичных выделений; точка Е - тройная эвтектика. Кроме основных элементов на рис. 14. 2 имеется ряд вспомогательных линий и точек, необходимых для дальнейших объяснений.
|
C |
T |
S F |
G E |
|
|
|
|
|
|
|
|
|
TS |
1 |
|
|
e |
e |
TF |
2 |
1 |
1 |
I |
TG |
|
|
||
|
III |
|
|
|
|
E |
|
|
G |
TE 3 4 2 3 |
3 |
1 |
|
2 |
|
|
|
|
2 |
|
|
|
S |
F |
|
5 |
4 |
|
4 |
3 |
A H |
eII |
B |
|
|
|
|
τ |
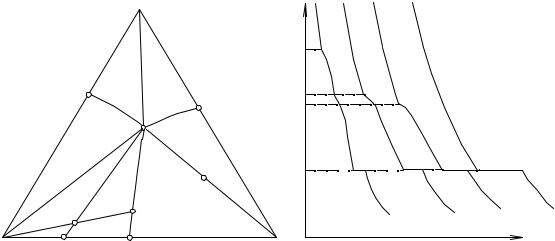
Рис. 14. 2. Основные типы кривых охлаждения в тройной системе простого эвтектического типа
При помощи рис. 14. 2 рассмотрим, как будут изменяться составы равновесных фаз при охлаждении расплава S. Сначала исходная реакционная смесь S нагрета выше температуры ликвидуса и представляет собой гомогенный рас-
130
плав. При охлаждении этого расплава до температуры ликвидуса изменения состава жидкой фазы не происходит, этот состав отображается точкой S.
При дальнейшем охлаждении начинает кристаллизоваться компонент А. Состав жидкой фазы обедняется этим компонентом и изменяется по лучу AF от точки S до точки F. Суммарный состав выпавших кристаллов равен чистому компоненту А. Вариантность равновесия (L+A(s)) системы уменьшается на единицу, и на кривой охлаждения (точка 1 на кривой S) наблюдается излом.
Точка F находится на линии вторичных выделений. При дальнейшем охлаждении реакционной смеси происходит совместная кристаллизация компонентов А и В. Вариантность равновесия (L+A(s)+B(S))снова уменьшается на единицу, и на кривой охлаждения (точка 2 на кривой S) наблюдается излом. Состав жидкой фазы изменяется по кривой еIIE от точки F до точки Е. При этом суммарный состав выделившихся кристаллов меняется от точки А до точки Н на стороне АВ треугольника состава. Для определения положения точки Н необходимо провести ноду из состава тройной эвтектики через состав исходной реакционной смеси и продолжить ее до пересечения с соответствующей стороной треугольника состава.
Точка Е является тройной эвтектикой системы. При отводе тепла будет происходить нонвариантный (при постоянном давлении) процесс кристаллизации сразу трех твердых фаз. На кривой охлаждения наблюдается температурная задержка (точки 3-4 на кривой S). Состав жидкой фазы остается постоянным, равным Е. Суммарный состав выделившейся твердой фазы изменяется по лучу НЕ от точки Н до точки S. Когда суммарный состав твердой фазы становится равным составу исходной реакционной смеси, исчезает последняя капля эвтектического расплава.
Аналогично описанному выше процессу кристаллизации исходной смеси S будет протекать кристаллизация любого расплава, состав которого находится внутри одного из кривосторонних треугольников АеIE, АeIIЕ, BeIIE, ВeIIIЕ,
CeIE и СeIIIЕ.
Рассмотрим, как будет протекать кристаллизация исходного расплава F, а также любой другой исходной смеси, лежащей на линии вторичного выделения. В отличие от смеси S охлаждение гомогенного расплава F до температуры ликвидуса приведет к кристаллизации сразу двух твердых фаз - смеси чистых компонентов А и В. Вариантность равновесия (L+A(s)+B(S)) при этом уменьшается сразу на две единицы и становится равной 1 (3-3+1=1), на кривой охлаждения (точка 1 на кривой F) наблюдается излом.
При дальнейшем охлаждении состав расплава меняется по кривой еIIЕ от точки F до точки Е. Суммарный состав твердой фазы меняется незначительно, он приблизительно равен составу двойной эвтектики в системе А - В. Для определения равновесного состава твердой фазы любого промежуточного расплава достаточно провести ноду из этого расплава через состав исходной смеси (точка F) и продолжить ее до пересечения со стороной треугольника состава. Точка
