
Студентам IV, V курса / Руководство по лаб. методам диагностики A.A.Кишкун
.pdf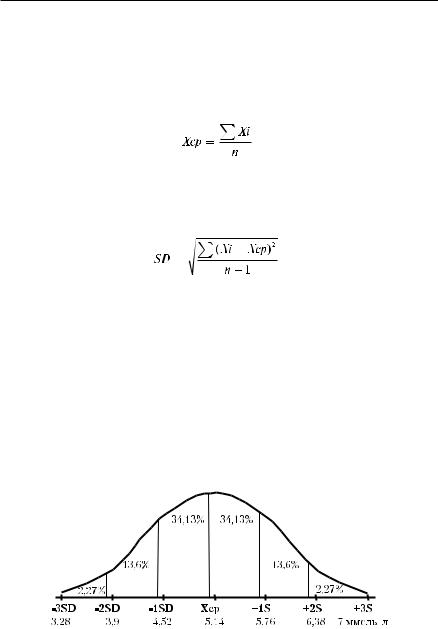
2 ■ Глава 1
так же как и метод определения исследуемых показателей. Математический анализ результатов, полученных при таких исследованиях, позволил выделить два основных класса параметров биоматериалов здоровых людей. Одни из них подчиняются закону Гауссова (нормального) распределения, другие — биноминальному распределению.
Например, всем обследуемым определяют концентрацию глюкозы в крови и строят кривую распределения. Среднюю величину рассчитывают делением суммы всех результатов на их количество.
где: Хср — средняя величины; n — количество результатов, Хi — значение отдельного результата (∑Хi — сумма всех результатов).
Дисперсию средней величины при распределении Гаусса можно выразить среднеквадратическим отклонением (SD), которое рассчитывают с помощью следующей формулы.
Как правило, распределение биологических объектов по степени выраженности одного из признаков описывает кривая Гаусса (рис. 1-1), это подразумевает, что в интервал, где величина признака колеблется в пределах М±2SD (применительно к концентрации глюкозы в крови — 3,9− 6,38 ммоль/л) попадает более 95% биологических объектов; тем не менее почти у 5% лиц здоровой популяции концентрация глюкозы не входит в интервал М±2SD. Именно поэтому критерием диагностики сахарного диабета считают концентрацию глюкозы в крови 7 ммоль/л и выше, а пациентов с результатами в пределах 6,38−6,9 ммоль/л относят к группе риска по данному заболеванию.
Таким образом, если распределение признака отвечает закону Гаусса, то нормальные лабораторные показатели определяют как среднее значение показателя для здоровой популяции ±2 стандартных отклонения (±2SD).
Рис. 1-1. Гауссово распределение (на примере концентрации глюкозы в крови у здоровых лиц).

Технология оценки результатов лабораторных исследований ■ 3
Вместе с тем у 5% здоровых людей значение показателя выходит за пределы указанного диапазона. Приведённой математической закономерности подчиняется рапределение значительной части лабораторных показателей химического и клеточного состава крови.
Ко второй группе лабораторных показателей относят результаты, для которых расчёт средней величины и среднеквадратичного отклонения невозможны. Поэтому для таких показателей вместо наиболее частой нормальной величины определяют и указывают пределы нормальных колебаний. Можно просто указать диапазон полученных результатов от самой малой до самой большой величины, но чаще отсекают 3% первых величин (снизу) и 3% последних (сверху).
Вместе с тем нормальные лабораторные показатели различных веществ, которыми нередко пользуются в лабораторной диагностике, включают только общую биологическую вариацию без учёта отдельных факторов, что снижает диагностическую ценность лабораторных тестов. Поэтому на смену термину «нормальные лабораторные показатели» приходит концепция референтных величин. Референтные величины дают представление о диапазоне, в котором располагаются нормальные величины. Смысл этого введения состоит в том, что результаты лабораторного исследования сравнивают с референтными величинами, полученными в чётко определённых условиях с учётом отдельных факторов, влияющих на биологическую вариацию. Референтные величины в настоящее время установлены для ограниченного количества показателей (приблизительно 150). Установление референтных интервалов колебаний для каждого лабораторного параметра имеет существенное значение для всей проблемы надёжности лабораторной информации, так как сравнение с ними служит основанием для принятия диагностических и лечебных решений.
При оценке результатов лабораторных исследований необходимо помнить, что референтные величины являются статистическими данными 95% популяции, и отклонения за пределы диапазона не обязательно указывают на наличие патологии.
Как правило, стандартный набор биохимических исследований, применяемых в обычных лечебных учреждениях, включает не менее 10−12 тестов. Вероятность того, результаты всех 12 тестов окажутся нормальными, невелика. При статистическом анализе установлено, что при определении 8 показателей результат одного из них будет «патологическим» приблизительно у 25% здоровых лиц, а при проведении 20 тестов одно или более отклонений от нормы выявят у 55% [Statland B.E. et al., 1977]. Приведённые данные подтверждают мысль о том, что каждое лабораторное исследование следует назначать обдуманно, по строгим показаниям, а перечень скрининговых тестов должен быть ограниченным.
Таким образом, приблизительно у 5% здоровых людей выявляют «ненормальные» лабораторные показатели, поэтому не все значения, выходящие за пределы нормы, следует расценивать как патологические. И напротив, не всегда показатель, лежащий в интервале M±2SD, следует считать нормальным, так как диапазон многих параметров достаточно широк. Например, в норме гематокрит (Ht) у мужчин варьирует от 42 до 52%. Массивная кровопотеря может привести к падению Ht от 52 до 42%. Показатель 42% не вызовет тревоги у врачей, поскольку он относится к диапазону нормальных величин, хотя для конкретного пациента такое снижение может быть

4 ■ Глава 1
клинически значимым. Поэтому каждый врач должен помнить об изменчивости нормы, связанной с внутрииндивидуальными и межиндивидуальными вариациями. По этой же причине лучшими референтными величинами для конкретного пациента следует считать стабильные результаты лабораторных исследований, полученные при его обследовании в течение нескольких лет.
Факторы, оказывающие влияние на результаты исследований
При оценке результатов лабораторных исследований необходимо учитывать целый ряд проблем, основные из которых приведены ниже.
■Проблема многообразия факторов, влияющих на результаты исследований.
■Проблема биологической вариации лабораторных параметров, включая понятие «нормативного лабораторного показателя» (референтной величины).
■Понятие о диагностически значимых (патологических) отклонениях лабораторных результатов.
■Понятие о диагностической чувствительности и специфичности лабораторных тестов, их значимости для дифференциальной диагностики.
■Проблема порогов решений (пороговых величин лабораторных показателей, требующих принятия диагностических или лечебных решений).
На рис. 1-2 представлена последовательность оценки результатов лабораторных исследований, которая может оказать значительную помощь практическому врачу. Из схемы видно, что оценка результатов лабораторных исследований включает в себя не только анализ их качества на чисто техническом и аналитическом уровне, но и анализ биологической вариабельности для того, чтобы результаты исследований были максимально информативными и надёжными в диагностическом, лечебном и прогностическом смысле.
БИОЛОГИЧЕСКАЯ ВАРИАЦИЯ
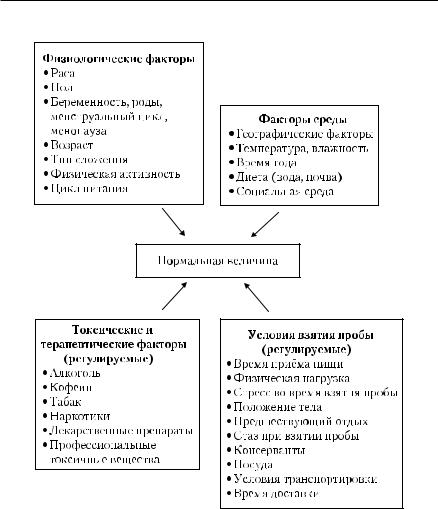
Результаты лабораторных исследований подвержены влиянию биологической и аналитической вариации. Если аналитическая вариация зависит от условий выполнения теста, то величина биологической вариации — от целого комплекса факторов. Общая биологическая вариация исследуемых показателей обусловлена внутрииндивидуальной вариацией, наблюдаемой у одного и того же человека в результате влияния биологических ритмов (разное время дня, года), и межиндивидуальной вариацией, вызванной как эндогенными, так и экзогенными факторами, главные из которых представлены на рис. 1-3.
Факторы биологической вариации (физиологические факторы, факторы среды, условия взятия пробы, токсичные и терапевтические факторы) могут оказать влияние на результаты лабораторных исследований. Часть из них способна вызывать реальные отклонения лабораторных результатов от референтных значений вне связи с патологическим процессом [Меньшиков В.В., 1995]. К таким факторам относят следующие.
■Физиологические закономерности (влияние расы, пола, возраста, типа сложения, характера и объёма привычной активности, питания).
■Влияние окружающей среды (климат, геомагнитные факторы, время года и суток, состав воды и почвы в зоне обитания, социально-бытовая среда).

Технология оценки результатов лабораторных исследований ■ 5
Рис. 1-2. Последовательность оценки результатов лабораторных исследований
■Воздействие профессиональных и бытовых токсичных средств [алкоголь, никотин, наркотики) и ятрогенные влияния (диагностические и лечебные процедуры, лекарственные средства (ЛС)].
■Условия взятия пробы (приём пищи, физическая нагрузка, положение тела, стресс во время взятия пробы и др.).
■Методика взятия крови (способ взятия, средства и посуда, консерванты и т.д.).
■Неправильный (по времени) забор материала.
■Условия (температура, встряхивание, влияние света) и время транспортировки биоматериала на исследования в лабораторию.
6 ■ Глава 1
Рис. 1-3. Факторы, влияющие на биологическую вариацию [Гаранина Е.Н., 1997].
Рассмотрим влияние наиболее важных факторов на результаты лабораторных анализов.
Приём пищи. Режим питания, состав принимаемой пищи, перерывы в её приёме оказывают существенное влияние на ряд показателей лабораторных исследований. После 48 ч голодания может увеличиваться концентрация билирубина в крови. Голодание в течение 72 ч снижает концентрацию глюкозы в крови у здоровых людей до 2,5 ммоль/л (45 мг%), увеличивает

Технология оценки результатов лабораторных исследований ■ 7
концентрацию триглицеридов (ТГ), свободных жирных кислот без значительных изменений концентрации холестерина (ХС) [Statland B.E. et al., 1973].
Употребление жирной пищи может повысить концентрацию калия, ТГ и щелочной фосфатазы. Активность щелочной фосфатазы в таких случаях может особенно увеличиваться у людей с О- или В-группой крови [Remes K. еt al., 1994]. Физиологические изменения после употребления жирной пище в виде гиперхиломикронемии могут увеличивать мутность сыворотки (плазмы) крови и тем самым влиять на результаты измерения оптической плотности. Повышение концентрации липидов в сыворотке крови может быть после употребления пациентом масла, крема или сыра, что приведёт к ложным результатам и потребует повторного анализа.
Потребление большого количества мяса, то есть пищи с высоким содержанием белка, может увеличить концентрации мочевины и аммиака в сыворотке крови, уратов в моче. Пища с высоким отношением ненасыщенных жирных кислот к насыщенным может вызвать снижение концентрации ХС в сыворотке крови, а пища, богатая пуринами, вызывает увеличение концентрации уратов. Бананы, ананасы, томаты, авокадо богаты серотонином. При их употреблении за 3 дня до исследования мочи на 5-оксииндолуксусную кислоту даже у здорового человека её концентрация может быть повышенной. Напитки, богатые кофеином, увеличивают концентрацию свободных жирных кислот и вызывают выход катехоламинов из надпочечников. Приём алкоголя увеличивает в крови концентрацию лактата, мочевой кислоты и ТГ.
Общее правило для исключения влияния принимаемой пищи на результаты лабораторных исследования — забор крови после 12-часового голодания.
Физические упражнения. Физическая нагрузка может оказывать как преходящее, так и длительное влияние на различные параметры гомеостаза. Преходящие изменения включают в себя вначале снижение, а затем увеличение концентрации свободных жирных кислот в крови, повышение на 180% концентрации аммиака и на 300% — лактата, увеличение активности креатинкиназы (КК), аспартат аминотрансферазы (АСТ), лактат дегидрогеназы (ЛДГ) [Garza D., Becan-McBride К., 1989]. Физические упражнения активируют свёртывание крови, фибринолиз и функциональную активность тромбоцитов. Изменения указанных показателей связаны с активацией метаболизма, они обычно возвращаются к исходным (до физической нагрузки) значениям вскоре после прекращения физической деятельности. Тем не менее активность некоторых ферментов (альдолаза, КК, АСТ, ЛДГ) может оставаться повышенной в течение 24 ч после 1-часовой интенсивной физической нагрузки. Длительная физическая нагрузка увеличивает концентрацию в крови половых гормонов, включая тестостерон, андростендион и лютеинизирующий гормон (ЛГ) [Henry J.B, 1996].
Эмоциональный стресс может вызывать преходящий лейкоцитоз, снижение концентрации железа и изменение уровня катехоламинов в крови. Сильное беспокойство, сопровождаемое гипервентиляцией, вызывает дисбаланс кислотно-основного состояния (КОС) с увеличением концентрации лактата и жирных кислот в крови.
Другие факторы. Среди других факторов, влияющих на результаты исследований, имеют значение суточные ритмы гомеостаза, возраст, пол, беременность, географическое положение местности, высота над уровнем моря, температура окружающей среды, курение. У курильщиков может

8 ■ Глава 1
быть повышена концентрация карбоксигемоглобина (HbCО), катехоламинов в плазме крови и кортизола в сыворотке крови. Изменения концентрации этих гормонов часто приводят к снижению количества эозинофилов, в то время как содержание нейтрофилов, моноцитов и свободных жирных кислот увеличивается. Курение приводит к увеличению концентрации гемоглобина (Hb), количества эритроцитов, среднего объёма эритроцита (MCV) и снижению количества лейкоцитов. В связи с этим лабораториям рекомендуется устанавливать свои локальные референтные (нормальные) величины для своей популяции.
Для того чтобы уменьшить влияние приведённых факторов на результаты анализов, перед забором крови на исследование необходимо воздержание от физических нагрузок и приёма алкоголя, изменений в питании в течение 24 ч. Пациент не должен принимать пищу после ужина, ему необходимо лечь спать накануне в обычное для него время и встать не позднее чем за 1 ч до взятия крови [Alstorm T. et al., 1993]. Рекомендуется производить забор крови у пациента в ранние утренние часы после 12-часового ночного голодания (базовое состояние), что позволяет максимально стандартизировать условия исследования.
Лекарственные средства. Некоторые ЛС могут оказывать существенное влияние на результаты исследований. Например, приём ацетилсалициловой кислоты при определении времени длительности кровотечения по Дуке следует отменить за 7−10 дней до исследования, в противном случае можно получить патологический результат. В случае, если принимаемое пациентом ЛС может повлиять на результат анализа, и при невозможности его отмены необходимо информировать об этом лабораторию.
Влияние ЛС на результаты лабораторных исследований может быть двух типов.
■Физиологическое влияние in vivo (в организме пациента) ЛС и их метаболитов.
■Влияние in vitro (на химическую реакцию, используемую для опреде-
ления показателя) благодаря химическим и физическим свойствам ЛС (интерференция).
Физиологическое влияние ЛС и их метаболитов во многом известны практическим врачам (более подробно — см. главу 6). Рассмотрим значение интерференции, то есть вмешательства постороннего фактора в результаты анализа.
Интерференция может быть вызвана наличием в пробе биоматериала как эндогенного, так и экзогенного вещества. К основным эндогенным интерферирующим факторам относят следующие.
■Гемолиз, то есть разрушение эритроцитов с выходом в жидкую часть крови ряда внутриклеточных компонентов (Hb, ЛДГ, калия, магния и др.), что изменяет истинные результаты определения концентрации/ активности таких компонентов крови, как билирубин, липаза, КК, ЛДГ, калий, магний и др.
■Липемия, извращающая результаты ряда колориметрических и нефелометрических методов исследования (особенно при исследовании фосфора, общего билирубина, мочевой кислоты, общего белка, электролитов).
■Парапротеинемия, вызывающая изменения результатов определения некоторыми методами фосфатов, мочевины, КК, ЛДГ, амилазы.

Технология оценки результатов лабораторных исследований ■ 9
Наиболее частые экзогенные интерферирующие факторы — ЛС или их метаболиты. Так, при определении катехоламинов флуориметрическим методом в моче интенсивную флюоресценцию может вызывать принимаемый пациентом тетрациклин; метаболит пропранолола 4-гидроксипропранолол интерферирует при определении билирубина методами Йендрассика−Грофа и Эвелина−Меллоя.
Выявить интерференцию ЛС — одна из задач врача клинической лабораторной диагностики. Важный шаг для решения этой проблемы — контакт с клиницистом для выяснения характера принимаемых пациентом препаратов.
Положение тела при заборе крови также влияет на ряд показателей. Так, смена пациентом положения лёжа на положение сидя или стоя приводит
кгидростатическому проникновению воды и фильтрующихся веществ из внутрисосудистого пространства в интерстициальное. Вещества, имеющие большую молекулярную массу (белки), и клетки крови со связанными с ними веществами не проходят в ткани, поэтому их концентрация в крови повышается (ферменты, общий белок, альбумин, железо, билирубин, ХС, ТГ, ЛС, связанные с белками, кальций). Могут увеличиваться концентрация Hb, Ht, количество лейкоцитов.
Место и техника забора крови также могут оказать существенное влияние на результаты лабораторных тестов (например, наложение жгута на период времени более 2 мин при заборе крови из вены может привести
кгемоконцентрации и увеличению концентрации в крови белков, факторов коагуляции, содержания клеточных элементов). Лучшее место забора крови на анализы — локтевая вена. Следует также отметить, что венозная кровь — лучший материал не только для определения биохимических, гормональных, серологических, иммунологических показателей, но и для общеклинического исследования. Это обусловлено тем, что применяемые в настоящее время гематологические анализаторы, с помощью которых проводят общеклинические исследования крови (подсчёт клеток, определение Hb, Ht и др.), предназначены для работы с венозной кровью, и в большинстве своём в странах, где их производят, они сертифицированы и стандартизированы для работы только с венозной кровью. Выпускаемые фирмами калибровочные и контрольные материалы также предназначены для калибровки гематологических анализаторов по венозной крови. Помимо этого, при заборе крови из пальца возможен ряд методических особенностей, которые стандартизировать очень трудно (холодные, цианотичные, отёчные пальцы, необходимость в разведении исследуемой крови и др.), что приводит к значительным разбросам в получаемых результатах и как следствие — к необходимости повторных исследований для уточнения результата. Для общеклинического исследования кровь из пальца рекомендуют забирать в следующих случаях.
■При ожогах, занимающих большую площадь поверхности тела пациента.
■При наличии у пациента очень мелких вен или их малой доступности.
■При выраженном ожирении пациента.
■При установленной склонности к венозному тромбозу.
■У новорождённых.
Пункцию артерии для забора крови используют редко (преимущественно для исследования газового состава артериальной крови).

10 ■ Глава 1
Время и условия транспортировки проб биологического материала также играют важную роль в обеспечении качества результатов лабораторных исследований. При доставке материала в лабораторию всегда необходимо помнить об особенностях некоторых проб. Например, при заборе артериальной крови для исследования газового состава ёмкость с кровью должна быть хорошо закупорена, погружена в ледяную воду и как можно скорее доставлена в лабораторию, поскольку гликолиз в эритроцитах и лейкоцитах вызывает снижение рН, если проба будет находиться приблизительно 20 мин при комнатной температуре. Эти требования необходимо соблюдать и при исследовании капиллярной крови, которую забирают в гепаринизированные капилляры. Кровь для исследования на адренокортикотропный гормон (АКТГ), ангиотензин I, II, ренин также должна быть сразу после забора помещена в лёд и как можно быстрее доставлена в лабораторию.
В целом, чтобы избежать влияния временного фактора на результаты анализов, доставку материала в лабораторию необходимо производить как можно быстрее. Чем раньше сыворотка отделена от эритроцитов, тем меньше влияние гликолиза (значит, меньшим будет влияние на концентрацию глюкозы, фосфора и активность некоторых ферментов). Концентрация билирубина в крови снижается под воздействием света (особенно яркого солнечного). Действие света также повышает активность щелочной фосфатазы. Фактор времени очень важен и при бактериологических исследованиях (некоторые бактерии погибают при комнатной температуре).
Время доставки биоматериала в лабораторию должно укладываться в интервалы, представленные в табл. 1-1. При их соблюдении удаётся максимально снизить негативное влияние временного фактора на результаты лабораторных анализов.
Таблица 1-1. Сроки доставки проб в лабораторию [Garza D., Becan-McBride K., 1989]
Исследования |
Максимально допустимое время |
|
с момента забора материала, мин |
||
|
||
|
|
|
Микроскопия мочи |
90 |
|
Кал на амебиаз |
Немедленно |
|
Общеклинический анализ крови |
60 |
|
Биохимический анализ крови |
|
|
на глюкозу |
20 |
|
на ферменты |
30 |
|
на К+, Nа+, Cl−, НСО − |
30 |
|
3 |
|
|
Свёртываемость крови |
45 |
|
Микробиологические анализы |
|
|
рутинная бактериологическая культура |
90 |
|
тампоны (мазок) со средой |
90 |
|
тампоны (мазок) без среды |
20 |
|
жидкие образцы (кровь, моча и т.д.) |
40 |
Указанные нормативы времени доставки должен знать каждый врачклиницист. При их нарушении необходим повторный забор проб, так как исключить влияние фактора времени на отклонения в результатах исследований не представляется возможным.

Технология оценки результатов лабораторных исследований ■ 11
Кроме всего перечисленного, величина биологической вариации зависит от физиологической функции, выполняемой в организме анализируемым веществом. Наименьшая биологическая вариация характерна для веществ, наиболее важных для стабильности состава и объёма внеклеточных жидкостей и крови (натрий, хлориды, кальций, магний, альбумин, общий белок, углекислый газ). Вариация средней степени характерна для веществ, участвующих в процессах анаболизма (глюкоза, ХС, фосфор). Наибольшей биологической вариацией обладают компоненты сыворотки крови, которые являются конечными продуктами катаболизма (мочевая кислота, мочевина, креатинин), а также выделяемые из тканей вещества и ферменты [ЛДГ, АСТ, аланин аминотрансфераза (АЛТ) и др.].
АНАЛИТИЧЕСКАЯ ВАРИАЦИЯ
Большое влияние на результаты лабораторных исследований оказывает аналитическая вариация используемого метода исследования. Основные критерии, по которым оценивают метод исследования, — точность, воспроизводимость, специфичность, чувствительность.
■Точность характеризует достоверность метода в определении точного значения величины (концентрации) вещества. Например, систематическая разница между результатами определения натрия в одной пробе более 3 ммоль/л считают неприемлемой. С другой стороны, более значительная разница между концентрациями некоторых гормонов, определяемых ИФА с различными АТ, считают приемлемой, так как использование различных препаратов АТ даёт различные матричные эффекты. По этой причине устанавливают различные интервалы референтных величин для отдельных иммуноферментных методов определения гормонов.
■Воспроизводимость метода оценивают путём измерения концентрации вещества в одной и той же пробе несколько раз в один день и в одной серии проб. На следующий день делают такие же измерения с той же самой пробой. Обычно отклонения при измерениях подчиняются закону Гаусса, что говорит о стабильности метода. Для каждого ряда измерений рассчитывают среднюю величину (Хср). Затем находят разницу между значением каждого измерения и этой средней и рассчитывают среднеквадратическое отклонение (S) и коэффициент вариации (V). Определяют коэффициент вариации в другие дни, и если он не превышает 5%, то метод исследования считают адекватным. Для ферментов V может достигать 10%. В обязанность каждой лаборатории входит проверка воспроизводимости методов, которую оценивают по величине стандартного отклонения (SD). Например, воспроизводимость при
определении концентрации общего ХС в сыворотке крови в хорошей лаборатории обычно составляет в среднем ±0,13 ммоль/л. Известно, что 95% доверительный интервал составляет ±2SD, что в данном случае
соответствует 0,26 ммоль/л. Таким образом, каждый результат считают истинным, если он находится в пределах этих границ (±0,52 ммоль/л). Так, концентрация общего ХС в сыворотке крови 5,18 ммоль/л означает, что истинное значение находится в пределах между 4,92 и 5,44 ммоль/л.
■Специфичность — способность метода измерять лишь тот компонент,
для определения которого он предназначен. Для оценки аналитической специфичности используют примеси, которые, исходя из химической структуры, являются репрезентативными представителями тех групп веществ, которые с физиологической точки зрения имеют
