Блокаторы H2
.docx|
|
|
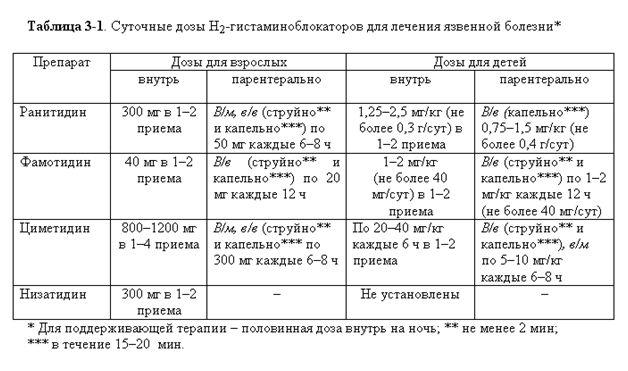
Блокаторы H1- и H2-рецепторов В настоящее время различают два вида гистаминовых рецепторов (H1 и H2), располагающихся в различных органах и тканях. При возбуждении этих рецепторов происходит целый ряд изменений в организме. Блокаторы H1-рецепторов представлены преимущественно средствами, применяемыми для лечения и профилактики аллергических реакций (димедрол, супрастин, диазолин и т.д.), а угнетение ими H1-рецепторов ЦНС позволяет использовать их в качестве седативных средств. Известно, что под влиянием гистамина происходит стимуляция всех пищеварительных, слюнных, желудочных и поджелудочной желез, желчеотделения. Однако наиболее выраженная стимуляция наблюдается со стороны париетальных клеток желудка, продуцирующих соляную кислоту. H2-рецепторы желудка сопряжены с аденилатциклазой, и под влиянием гистамина увеличивается уровень циклического АМФ, который может активировать карбоангидразу, участвующую в образовании свободных ионов хлора и водорода. Блокаторы H2-рецепторов тормозят выработку париетальными клетками соляной кислоты, а также пепсина. Антагонисты H2-рецепторов гистамина К антагонистам H2-рецепторов относят циметидин, ранитидин, фамотидин, низатидин и роксатидин. Циметидин (тагомет, цинемет) является производным имидазола и близок по структуре к гистамину, в качестве заместителя в боковой цепи содержит гуаниновую группировку. Ранитидин вместо имидазольного кольца имеет фурановое и иные заместители в боковой цепи. Подобные изменения в структуре молекулы ранитидина заметно снизили его липофильность по сравнению с циметидином и повысили селективность действия в отношении H2-рецепторов гистамина париетальных клеток. Циметидин, в отличие от гастрозепина и ранитидина, уменьшает уровень содержания восстановленного цитохрома P450 и значительно подавляет анилин-гидроксилазную активность монооксигеназ печени. Циметидин подавляет активность лекарственно-метаболизирующей функции печени на 26% за счет подавления активности цитохрома P450 в то же время ранитидин и гастрозепин практически не влияют на эту функцию. На основании фармакокинетических исследований можно считать, что гастрозепин и ранитидин являются препаратами выбора при сочетанных формах поражения печени и язвенной болезни. Применение циметидина в силу ингибирующего действия на цитохром P450, при сочетании этих заболеваний противопоказано. Его не следует сочетать с другими лекарственными средствами, с которыми возможна интерференция на уровне лекарственно-метаболизирующей системы печени (антикоагулянты, транквилизаторы бензодиазепинового ряда и др.). С возрастом у больных язвенной болезнью падает объем распределения, плазменный, почечный клиренс препарата, удлиняется период полуэлиминации, что требует коррекции дозы. Фармакокинетика циметидина меняется при различных патологических состояниях, особенно при хронической почечной недостаточности. В дозе 300 мг препарат тормозит базальную кислую секрецию у больных с дуоденальной язвой на 95% в течение 5 ч и ночную секрецию на 80%. После отмены циметидина кислая желудочная секреция не повышается. Циметидин снижает не только концентрацию H+-ионов, но и объем желудочной секреции, т.е. тормозит и секрецию пепсина, не влияя на его концентрацию. Клинические наблюдения показали, что степень угнетения базального кислотовыделения в меньшей степени зависит от дозы и в большей — от концентрации циметидина в крови. Большая зависимость от дозы препарата выявлена при изменении ночной секреции. Так, циметидин в дозах 200, 300 и 400 мг снижает ночное кислотовыделение на 56, 89 и 95% соответственно. Ночное мониторирование pH позволяет определить оптимальную индивидуальную дозу препарата. Циметидин угнетает также гистаминстимулированную индуцированную инсулином, кофеином или пентагастрином секрецию соляной кислоты. Отсутствие эффекта на циметидин, видимо, можно объяснить наследственной или приобретенной патологией H2-рецепторов, недостаточной индивидуальной дозой препарата, причастностью к гиперхлоргидрии и другими факторами. Показано, что этот препарат взаимодействует с участками связывания H2-рецепторов, локализованных в плазматической мембране. Гипергастринемия, которую можно было бы ожидать при выраженном торможении желудочного кислотовыделения, найдена не всеми исследователями. Повышение концентрации гастрина в сыворотке крови связывают с обнаруженной на фоне лечения циметидином гиперплазией гастринпродуцирующих клеток (G-клетки) в антральном отделе желудка, которая выявлена у ряда больных с дуоденальной язвой, получавших препарат в дозе 1000 мг в день в течение 1 мес. Предполагают, что гиперплазия этих клеток может способствовать возникновению быстрого рецидива язвы после отмены циметидина. Существенного влияния на концентрацию пепсина циметидин не оказывает, лишь несколько снижается его выделение за счет уменьшения объема желудочного секрета. Было показано, что препарат стимулирует желудочное сокращение, хотя одновременно снижает тонус пилорического сфинктера, что ускоряет эвакуацию содержимого из желудка. Такой эффект циметидина связывают с гипергастринемией, возникающей у ряда больных на фоне его приема. Известно, что гастрин стимулирует сокращение желудка, особенно его антрального отдела, и снижает тонус пилорического сфинктера. После лечения циметидином у большинства больных нормализовалась моторная деятельность желудка и двенадцатиперстной кишки. Однако ингибирующее действие циметидина на двигательную активность гастродуоденальной системы по силе и продолжительности уступает влиянию периферических M-холиноблокаторов. Фармакокинетика. Биодоступность циметидина у здоровых — 72%, а у больных язвенной болезнью — 60% после приема 200 мг препарата, T1/2 составляет 2 ч, клиренс плазмы — 490 мл/мин, почечный клиренс — 390 мл/мин. С возрастом и при повышении массы тела клиренс препарата увеличивается. Терапевтическая концентрация циметидина равна 0,5 мкг/мл. Препарат метаболизируется в печени, частично выводится с мочой, частично с калом. Проходит через плаценту и экскретируется с молоком. Циметидин — потенциальный ингибитор микросом печени (оксигеназной активности) и, в частности, угнетает микросомальный метаболизм варфарина, диазепама, дифенина и пропранолола. Препарат назначают при язвенной болезни желудка и двенадцатиперстной кишки, синдроме Золлингера — Эллисона, остром желудочном кровотечении, эзофагите, рефлюкс-эзофагите. На фоне лечения циметидином по сравнению с плацебо дуоденальная язва рубцуется у большинства больных: у 82,6% при лечении циметидином и у 48% на фоне плацебо. Примерно у половины больных дуоденальная язва заживает в первые 2 нед, у 67% — через 3 нед и у 89% — через 4 нед; язва желудка у 57-64% — через 4 нед и у 91% – через 8 нед. Следует отметить, что параллелизм между заживлением гастродуоденальной язвы и степенью подавления желудочного кислотовыделения наблюдается не всегда. В ряде случаев при безуспешной монотерапии рекомендуется сочетать циметидин с препаратами другого механизма (сукралфат, периферические M-холиноблокаторы или антагонист M-холинорецепторов желудка — пирензепин), что повышает частоту заживления дуоденальной язвы и вызывает меньше осложнений. Довольно долго обсуждался вопрос об оптимальной дозе циметидина. Считали, что для заживления дуоденальной язвы лучше назначать циметидин в дозе 1 г в день. Поскольку дневная секреция подавляется буферным действием пищи, большее значение имеет медикаментозное торможение ночной секреции. Анализируя большой литературный материал, пришли к выводу, что при 5-кратном введении циметидина в дозе 1 г/сут, при двукратном введении по 400 мг во время первого завтрака и на ночь и при однократном введении ночной дозы в 800 мг достигается одинаковый антацидный эффект. В связи с этим в последние годы циметидин стали назначать однократно на ночь в дозе 800 мг. Лечение длительное, годами. Противопоказания к применению препарата отсутствуют, хотя с осторожностью следует использовать при хронических гепатитах и циррозах. При обострении язвенной болезни с выраженным болевым синдромом и кровотечением начинают с внутривенного введения: 200 мг капельно (в течение 1,5-2 ч), повторяя через 6 ч, затем в таблетках по 200 мг (1 таблетка) 3 раза в день и 400 мг на ночь в течение 4-6 недель; или по 400 мг 2 раза, далее поддерживающая доза 400 мг на ночь (до 6-12 мес). Отменять препарат надо постепенно в течение 7-14 сут — иначе будет рецидив вследствие гиперпродукции соляной кислоты. Побочные действия связаны с воздействием циметидина на ЦНС (сомнамбулизм, дезориентация, депрессия), развитием половой слабости и гинекомастии, проходящих после отмены препарата. Ранитидин (зонтаг, пепторан, ранисан), как и циметидин, является H2-блокатором. Ранитидин превосходит циметидин по подавлению выработки соляной кислоты в 4-5 раз и по более длительному эффекту (10-12 ч), меньше побочных действий (очень редко бывает головная боль, тошнота, запоры, сыпь). У больных язвенной болезнью ранитидин вызывает не только выраженное торможение желудочной секреции, стимулированной пентагастрином, гистамином и приемом пищи, но и торможение 24-часового внутрижелудочного кислотовыделения и ночной секреции. При приеме ранитидина ночная секреция уменьшается на 90%, а циметидина — на 70%. Уровень сывороточного гастрина не меняется как у здоровых лиц в базальных условиях при внутривенном или внутридуоденальном введении ранитидина в антисекреторных дозах, так и у больных с дуоденальной язвой после мнимого кормления, приема пищи или введения пентагастрина и пептона. В механизме антисекреторного действия ранитидина, помимо H2-рецепторов париетальных клеток, по-видимому, определенную роль играет его способность усиливать инактивацию гистамина, связанную с повышением активности гистаминметилтрансферазы. Ранитидин, как и циметидин, снижает выделение пепсина благодаря уменьшению объема желудочного секрета; при этом концентрация фермента не меняется. Характерно, что стимулированная секреция пепсина у здоровых лиц и больных язвенной болезнью двенадцатиперстной кишки уменьшается в меньшей степени, чем кислотовыделение. Ранитидин влияет и на двигательную функцию гастродуоденальной системы, поскольку он обладает некоторой холинергической активностью. Известно, что он вызывает сокращение нижнего пищеводного сфинктера и замедляет опорожнение желудка. В многочисленных публикациях приводятся данные о высокой эффективности ранитидина при язвенной болезни двенадцатиперстной кишки. Двойное слепое исследование показало, что в суточной дозе 200 мг он приводит к заживлению дуоденальной язвы через 4 нед у 83-92% больных, а плацебо — у 29-46 % больных. Выраженным язвозаживляющим действием обладает и ранитидин в дозе 300 мг/сут. Фармакокинетика. Распределение ранитидина описывается по двухкомпонентной модели. Биоусвояемость препарата составляет около 50%. При внутреннем применении T1/2 равняется 3 ч, а при внутривенном — 2 ч. В печени препарат подвергается окислению и деметилированию с образованием N-дезметилранитидина и S-оксида, которые вместе с неизмененным препаратом (25%) экскретируются с мочой. В отличие от циметидина ранитидин не угнетает метаболизм в печени таких препаратов, как феназон, амидопирин, диазепам, гексобарбитал, пропранолол. Показания к назначению ранитидина те же, что и к назначению циметидина. Принимают препарат по 150 мг 2 раза в день, реже — в больших дозах (300 мг дважды в день). Иногда применяют внутривенно в дозе 75-150 мг (реже 300 мг). Доза ранитидина должна быть снижена наполовину при наличии ХПН. Показано, что препарат в дозе 150 мг два раза в день приводит к заживлению язвы желудка через 2, 4, 6, 8 нед у 9, 42, 60 и 87% больных соответственно. Серьезных противопоказаний к приему препарата нет. Побочные реакции наблюдаются реже, чем при использовании циметидина. Исследования в 20 различных центрах 356 больных язвенной болезнью двенадцатиперстной кишки показали, что язва заживает через 8 нед у 95,8% больных, принимающих ранитидин в дозе 150 мг два раза в день, и у 94,8%-300 мг однократно. По данным некоторых исследователей, применение препарата однократно в 18 ч в дозе 300 мг приводит к заживлению язвы даже у 100% больных. Эти исследования показывают, что ранитидин следует назначать однократно в дозе 300 мг вечером. Это удобнее для больных, особенно при проведении амбулаторного лечения. Дневное кислотовыделение нейтрализуется буферным действием пищи. Ранитидин в суточной дозе 300 мг в течение 8 нед успешно применяется для лечения больных с резистентными к циметидину язвами. Однако эффективное лечение обостренной язвенной болезни ранитидином, равно как и другими блокаторами гистаминовых H2-рецепторов, не гарантирует от рецидива заболевания. Последний возникает почти у половины больных в течение 6 мес, если не проводилась профилактическая терапия. Длительная (в течение 3-4 лет при дуоденальной язве и 2-3 лет при медиогастральной) поддерживающая, постоянная или прерывистая, терапия ранитидином в дозе 150 мг на ночь уменьшает частоту рецидивов язвенной болезни. Препарат предупреждает у большинства больных рецидив заболевания независимо от локализации язвы, в то время как на фоне антацидов или плацебо язвы рецидивируют чаще. Так, при длительном применении поддерживающих доз ранитидина (150 мг на ночь в течение 2 лет) рецидив дуоденальной язвы возник лишь у 18% больных, а на фоне плацебо — у 87%. Противорецидивное лечение следует проводить злостным курильщикам; больным с длительным анамнезом и осложненной формой язвенной болезни; пожилым лицам, имеющим сопутствующие заболевания и противопоказания для хирургического лечения; больным, получающим длительное время стероидные гормоны и нестероидные противовоспалительные препараты; больным, склонным к возникновению симптоматических пептических язв (больные хроническими обструктивными заболеваниями легких, циррозом печени, заболеваниями почек с почечной недостаточностью, ревматоидным атритом). Остальным больным лечение проводят лишь при появлении рецидивов (“терапия по требованию”). Фамотидин (ульфамид, фамосан) относится к H2-блокаторам и как ранитидин обладает антисекреторным действием. Более значительна у фамотидина и продолжительность этого эффекта. Так же как ранитидин в дозе 150 мг, фамотидин в дозе 40 мг в отношении антисекреторного действия при введении однократно в 18 ч оказался более эффективным, чем при приеме его поздно вечером. Торможение базальной секреции при раннем и позднем введении фамотидина продолжается соответственно 10,1 и 7,1 ч, а при введении ранитидина — соответственно 10,7 и 7,3 ч. Фамотидин не только способствует заживлению язвы, но и предупреждает ее рецидивы. Пролонгированное в течение года лечение фамотидином, как и другими блокаторами H2-рецепторов, приводит к уменьшению числа рецидивов дуоденальной язвы с 70 до 25%, причем поддерживающая доза препарата составляет 20 мг на ночь. Эта доза препарата снижает секрецию соляной кислоты и пепсина, стимулированную пентагастрином, которая остается пониженной в течение 12 ч. Фармакокинетика. Биодоступность препарата составляет 37-45%, препарат в крови слабо связывается с белком (на 15-22%), довольно быстро распределяется в органах и тканях: желудочно-кишечном тракте, почках, печени, поджелудочной железе. Препарат биотрансформируется путем сульфооксидации: степень биотрансформации довольно индивидуальна и колеблется от 35 до 89%. Большая часть препарата выделяется с мочой в неизмененном виде. Степень почечного выведения прямо зависит от величины клубочковой фильтрации и канальцевой секреции. T1/2 у здоровых при приеме 20 мг составляет 3 ч, у больных — 19 ч, а у пожилых здоровых лиц — 7 ч, объем распределения соответственно — 434, 886 и 640 нг/мл ч. Максимальная концентрация в крови у молодых и пожилых здоровых составляла 70 и 100 нг/мл, а у больных ХПН — 120 нг/мл. Выводится фамотидин не только путем клубочковой фильтрации, но и путем канальцевой секреции. Фамотидин оказывает влияние на печеночную элиминацию диазепама и канальцевую экскрецию новокаинамида. Применяется в дозе 20-40 мг на ночь однократно. По противоязвенной активности несколько превосходит ранитидин. Синтезированы препараты четвертого и пятого поколений блокаторов H2-рецепторов — низатидин и роксатидин. Сравнение действия на базальную желудочную секрецию низатидина с ранитидином в одинаковых дозах (150 мг) не выявило статистических различий. Обнаружено отчетливое язвозаживляющее действие этих препаратов. За 4-6 нед гастродуоденальная язва заживает более чем у 90% больных. Препараты четвертого и пятого поколений практически лишены побочного действия. Заслуживает особого внимания то обстоятельство, что за последние 20 лет число операций по поводу язвенной болезни снизилось примерно в 8 раз в связи с применением блокаторов H2-рецепторов, которое явилось альтернативой хирургического лечения. Например, 10-летние наблюдения показали, что применение циметидина позволило 64% больных избежать операции. Блокаторы H2-рецепторов нашли применение не только при язвенной болезни, но и при других заболеваниях, для которых характерно гиперацидное состояние (синдром Золлингера-Эллисона) или в патогенезе которых гиперхлоргидрия играет определенную роль (терминальный рефлюкс-эзофагит, пептическая язва пищевода). У больных с рефлюкс-эзофагитом на фоне приема препаратов этой группы исчезали характерные для него клинические проявления и эндоскопические изменения. Состояние слизистой оболочки пищевода нормализовалось. Для лечения слабо и умеренно выраженного рефлюкс-эзофагита целесообразно назначать циметидин в дозе 400 мг, ранитидин в дозе 300 мг на ночь. Отмечен параллелизм между эффективностью препарата и уменьшением объема и скорости желудочной секреции, времени рефлюкса. Эти препараты предотвращают также развитие пептической стриктуры при рефлюкс-эзофагите. Они способствуют заживлению язвы пищевода (язвы Беррета) у большей части больных. Побочные эффекты. Гематологические нарушения (у 1 на 100 000 больных, получавших H2-блокаторы) проявляются грануло- и тромбоцитопенией. При нарушении функции печени и почек возможны возбуждение, дизориентация, беспокойство, галлюцинации, страх или депрессия, ступор или кома, особенно у лиц молодого и пожилого возраста. Со стороны почек наблюдают преходящее снижение выделения креатинина, значительно реже — интерстициальный нефрит. Изменения эндокринной системы при применении циметидина характеризуются повышением уровня сывороточного пролактина, гинекомастией, галактореей, снижением либидо, числа сперматозоидов и импотенцией. Изредка препараты данной группы вызывают незначительное повышение активности трансаминаз. Со стороны иммунной системы отмечают умеренную стимуляцию T-клеточных реакций. Другие побочные эффекты единичны и требуют дальнейшего изучения. Нежелательные побочные явления при лечении циметидином наблюдаются чаще. Ранитидин менее липофилен, с трудом преодолевает ГЭБ.
|
|
|