
Основы иммунологии
.pdf
Прямая и непрямая антииммуноглобулиновая реакция Кумбса
Эти реакции используются для выявления "неполных" (неагглютинирующих) антител, которые образуются при различных заболеваниях: резус-конфликте, аутоиммунных заболеваниях, некоторых инфекциях. Для постановки этих реакций необходима антиглобулиновая сыворотка, которую получают путем иммунизации кролика иммуноглобулинами человека. Такая сыворотка содержит полные (бивалентные) антитела-антииммуноглобулины (рис 5.3.)
АНТИГЕНЫ |
НЕПОЛНЫЕ РЕАКЦИЯ НЕ ВИДНА |
|
АНТИТЕЛА |
||
|
АНТИГЛОБУЛИНОВАЯ |
МАКРОАГРЕГАТ |
СЫВОРОТКА (ПОЛНЫЕ |
(РЕАКЦИЯ |
АНТИТЕЛА) |
ВИДНА) |
Рис. 5.3. Реакция Кумбса
Прямая реакция позволяет уже адсорбированные на клетках неполные АТ. Для этого к отмытым эритроцитам из крови больного добавляют антииммуноглобулиновую сыворотку. Если на эритроцитах есть неполные антитела (иммуноглобулины), что наблюдается при гемолитической анемии, резус-конфликте (эритроциты пуповинной крови новорожденного), то они агглютинируются.
Непрямая реакция выявляет свободные антиэритроцитарные антитела в сыворотке крови больного. К этой сыворотке добавляют отмытые эритроциты донора 0(I) группы крови. Смесь инкубируют при 370С в течение 30 минут и отмывают эритроциты. Затем к ним
131
добавляют антииммуноглобулиновую сыворотку. Если в сыворотке больного были неполные антиэритроцитарные антитела, то наступит агглютинация.
Реакции преципитации
Воснове реакций преципитации лежит образование и выпадение
восадок комплексов антиген-антитело. В реакции участвуют
растворимые антигены – преципитиногены (продукты микроорганизмов, тканей, химические вещества и лекарства). Антитела (преципитины), соединяясь с растворимыми антигенами, вызывают их агрегацию, что проявляется в помутнении прозрачных жидкостей или выпадении осадка (преципитата). Диагностические преципитирующие сыворотки выпускают с высоким титром антител. Их получают путем иммунизации лабораторных животных соответствующим антигеном. Титром преципитирующей сыворотки является минимальное количество антигена, которое данная сыворотка может преципитировать.
Иммунодиффузия в геле лежит в основе реакции преципитации по Манчини, которая используется для определения классов иммуноглобулинов в сыворотке крови (см. гл. «Оценка иммунного статуса, характеристика В-лимфоцитов»).
Реакции преципитации используются для: определения антигенов бактерий, тканей человека и животных; диагностики некоторых инфекционных заболеваний; определения видовой принадлежности белка в судебной медицине; выявления примесей в мясных, рыбных, мучных изделиях в санитарной практике.
Реакцию преципитации можно проводить в жидкой и плотной среде – (в агаре или геле).
Реакция преципитации в жидкой среде (кольцепреципитация).
Реакцию ставят в узких пробирках, куда вносят преципитирующую антисыворотку, а сверху осторожно наслаивают прозрачный раствор антигена. При положительной реакции через несколько минут на границе соприкосновения двух жидкостей появится кольцо преципитации. При малых количествах реагентов реакцию можно проводить в капиллярах (микропреципитация).
132
Реакция преципитации в агаре.
Сущность реакции в том, что антигены и антитела, помещенные в разные лунки в агаре, диффундируют навстречу друг другу и при взаимодействии образуют комплекс, который осаждается в виде линии преципитации.
Метод определения токсигенности микробов в реакции преципитации.
Принцип иммунодиффузии в геле положен в основу метода, который применяется для изучения токсигенности (способности вырабатывать токсин) бактерий. Например, для обнаружения дифтерийного токсина на чашку Петри с агаром посередине накладывают полоску фильтровальной бумаги, пропитанную антитоксической сывороткой. Рядом засевают исследуемые культуры бактерий. Если они выделяют токсин, то при взаимодействии с антитоксинами между колониями и полоской бумаги образуются линии преципитации.
Реакции лизиса
Сущность этих реакций состоит в том, что при взаимодействии специфических антител с антигенами клеток (эритроцитов, бактерий, лейкоцитов), на их поверхности образуется комплекс, который активирует добавленный комплемент по классическому пути, вследствие чего наступает лизис этих клеток. Многие бактерии устойчивы к литическому действию комплемента или их лизис происходит медленно. Отсюда реакция иммунного лизиса бактерий (реакция бактериолиза) в настоящее время применяется редко.
Реакция лизиса используется для типирования (выявления) антигенов системы HLA на лимфоцитах. К типируемым лимфоцитам добавляют антисыворотки против различных HLAантигенов, затем их отмывают и добавляют комплемент. Если соответствующий антиген есть, то наступает лизис лимфоцитов. Нежизнеспособные клетки в отличие от живых окрашиваются трипановым синим.
133
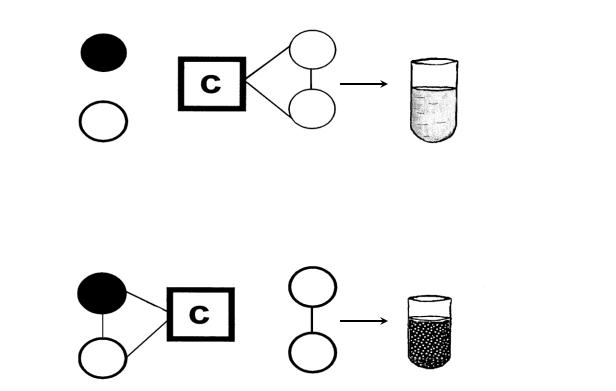
Реакция связывания комплемента (РСК).
Еще одной разновидностью реакций лизиса является реакция связывания комплемента (РСК).
В РСК помимо антигена и антител принимает участие комплемент, который способен связываться с комплексом антигенантитело. РСК позволяет выявлять антигены при использовании известных антисывороток или антитела с помощью антигеновдиагностикумов.
Образование комплексов антиген-антитело и фиксация комплемента не сопровождаются видимыми изменениями. Для обнаружения связывания комплемента используют дополнительную
индикаторную гемолитическую систему (рис. 5.4.)
АГ Э
|
|
|
|
|
|
|
|
отрицательная РСК |
|
|
+ |
|
|
|
|
|
(гемолиз) |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ГС |
|
|
|
|
|
|
|
|
||||
АТ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|||
|
|
|
|
|
||||
|
|
|
|
Гемсистема |
|
|||
|
|
|
|
|
|
|
|
|
АГ |
|
Э |
|
|
|
|
|
|
положительная РСК (гемолиза нет)
|
|
ГС |
АТ |
|
|
|
|
|
|
|
|
АГ – антиген; АТ – антитела; С – комплемент; Э – эритроциты барана; ГА – гемолитическая сыворотка. Объяснения в тексте.
Рис. 5.4. Схема реакции связывания комплемента
134

Гемолитическая система состоит из эритроцитов барана, обработанных гемолитической сывороткой против эритроцитов барана. Эту антисыворотку предварительно прогревают при 56 С 30 мин для разрушения ее комплемента. В присутствии комплемента (сыворотки морской свинки) происходит лизис этих эритроцитов.
Принцип метода состоит в том, что если в опытной системе образовался комплекс антиген-антитело, который связал добавленный комплемент, то не будет лизиса эритроцитов в индикаторной гемолитической системе (РСК положительная, выявлен антиген или антитело). Если в опытной системе комплекс антиген-антитело не формируется, комплемент остается свободным, взаимодействует с гемолитической системой и вызывает лизис эритроцитов (РСК отрицательная, есть гемолиз, см.)
РСК лежит в основе реакции Вассермана, которая применяется для диагностики сифилиса. Также она используется для иммунодиагностики эпидемического сыпного тифа.
Реакции нейтрализации экзотоксинов и вирусов
Реакция нейтрализации экзотоксина происходит при его взаимодействии с антитоксической сывороткой (антителаантитоксины). В результате образования комплекса антиген-антитело токсин теряет свои ядовитые свойства.
Реакцию нейтрализации проводят с целью обнаружения и титрования токсинов, анатоксинов или антитоксинов.
Токсины получают путем фильтрования жидкой питательной среды или исследуемого материала, где размножались токсигенные бактерии. При обработке формалином в течение 30-45 дней при температуре 370С токсин превращается в анатоксин, который используют для иммунизации животных с целью получения антитоксической сыворотки.
Разработано несколько вариантов реакции нейтрализации токсинов.
Реакция флоккуляции основана на способности токсина или анатоксина при смешивании в эквивалентных соотношениях с антитоксической сывороткой образовывать помутнение в пробирке. Механизм флоккуляции аналогичен механизму реакции
135
преципитации. Используют для количественного определения токсинов или антитоксинов.
Реакция нейтрализации токсинов in vivo.
Для определения типа токсина его смешивают с диагностической антитоксической сывороткой и эту смесь вводят белым мышам. При нейтрализации токсина антитоксической сывороткой мыши не погибают, что указывает на вид токсина.
Реакция нейтрализации вирусов.
Данная реакция используется для идентификации вирусов. Для этого к исследуемому материалу, содержащему неизвестный вирус, добавляют специфическую противовирусную сыворотку. После инкубации эту смесь вводят либо в куриный эмбрион, либо лабораторному животному, либо в культуру клеток. Наиболее распространена реакция нейтрализации вирусов в культуре клеток. Здесь в культуральную среду добавляется индикатор. Если антитела соответствуют вирусу (нейтрализуют его), то клеточная культура развивается нормально. При этом происходит выделение кислых продуктов клеточного метаболизма, рН среды снижается, и индикатор изменяет свой цвет. В контроле вирус быстро разрушает клеточную культуру, рН не меняется, и цвет среды остается прежним.
На этом же принципе основана реакция ингибиции метаболизма для идентификации микоплазм.
Методы, основанные на связывании меченых антигенов и антител
Эти методы высокочувствительны. В качестве метки антигенов или антител применяют флюоресцентные красители, радиоактивные изотопы, ферменты и др.
Иммунофлюоресцентные методы
Прямой метод иммунофлюоресценции (по Кунсу) основан на взаимодействии антител, меченых флюорохромом, с антигеном, который находится на клетке, в клетке или в тканях. В качестве флюорохрома используют флюоресцеинизотиоционат (ФИТЦ). Он
136
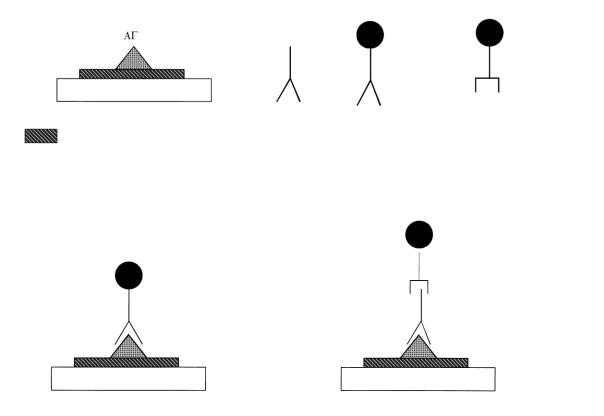
дает зеленое свечение в ультрафиолетовых лучах, а тетраметилродаминизотиоцианат – оранжево-красное свечение. Прямой метод одноэтапный: на фиксированный мазок клеток с антигеном наносят диагностическую сыворотку с антителами, мечеными ФИТЦ, инкубируют, отмывают и, при положительном результате, учитывают свечение в люминесцентном микроскопе
(рис. 5.4).
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
исследуемый материал |
|
антитела |
антитела, меченые |
меченый |
||||||
|
|
|
|
|
|
флюоресцеином |
флюоресцеином |
|||
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
антииммуноглобулин |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
ПРЯМОЙ ТЕСТ |
|
|
|
|
НЕПРЯМОЙ ТЕСТ |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 5.4. Метод иммунной флюоресценции
Непрямой метод иммунофлюоресценции заключается в том, что первоначально антиген обрабатывают обычной диагностической сывороткой, которую получают путем иммунизации кроликов соответствующим антигеном. Для обнаружения образовавшегося комплекса антиген-антитело используют меченую флюорохромом антисыворотку против иммуноглобулинов кролика. Такую сыворотку получают путем иммунизации барана иммуноглобулинами кролика. Непрямой метод дает возможность обнаруживать различные
137
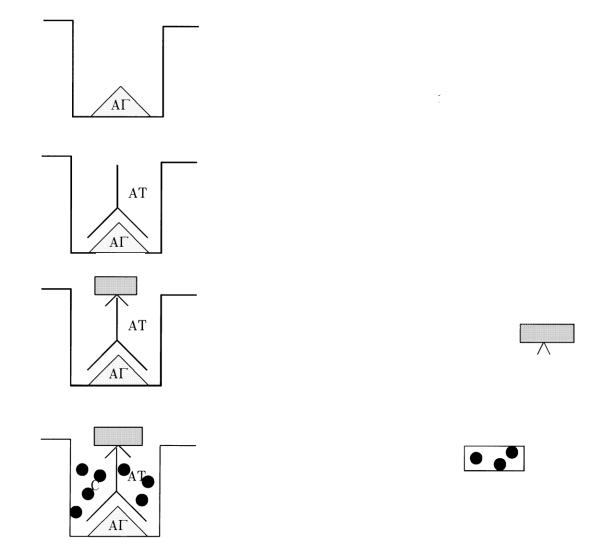
комплексы антиген-антитело с помощью одной меченой антиглобулиновой сыворотки.
Метод иммунной флюоресценции применяют для идентификации бактерий, риккетсий, вирусов, а также для определения рецепторов и антигенов клеток человека и животных.
Иммуноферментный анализ.
В методах иммуноферментного анализа (ИФА) используют иммунореагенты, меченные ферментами (рис. 5.5). Наиболее широко применяется твердофазный ИФА. В качестве твердой фазы чаще всего используют полистироловые или поливиниловые планшеты или шарики, на которых адсорбированы антигены или антитела.
Антиген сорбирован на планшете
Отмывка
Добавление сыворотки, содержащей антитела
Отмывка
АТ-Ф
Добавление антииммуноглобулиновых антител, меченых ферментом, отмывка
АТ-Ф
Добавление субстрата фермента (изменение цвета)
Оценка реакции
Рис. 5.5. Принцип выявления антител в твердофазном ИФА
138
Для выявления антител известный антиген адсорбируют в лунках полистироловой пластины. Затем вносят исследуемую сыворотку, в которой хотят обнаружить антитела к данному антигену. После инкубации лунки промывают для удаления несвязавшихся белков и вносят в них антииммуноглобулиновые антитела, меченные ферментом (обычно пероксидазой). После инкубации и отмывания в лунки добавляют специфичный для фермента субстрат (перекись водорода) и хромоген (орто-фенилендиамин) для регистрации конечных продуктов расщепления субстрата. О наличии и количестве антител судят по изменению цвета и интенсивности окраски раствора. Для регистрация окраски используют специальные спектрофотометры с вертикальным ходом луча (ридерымультисканы).
Методы ИФА обладают высокой чувствительностью и специфичностью и получили широкое распространение в различных областях биологии и медицины.
Иммуноблотинг (вестерн-блотинг).
Часто бывает, что АГ представляет собой сложную смесь разнородных молекул. С другой стороны, к такому комплексному АГ вырабатывается набор различных АТ. Для одновременного обнаружения различных фракций АГ либо АТ в исследуемом материале применяют метод вестерн-блотинга. В частности, он используется при диагностике ВИЧ-инфекции для обнаружения АТ к различным вирусным АГ. Для этого известный набор вирусных белковых АГ подвергают электрофорезу в полиакриламидном геле. АГ мигрируют в геле в зависимости от их молекулярной массы и заряда. После окончания электрофореза на пластину с гелем накладывают лист нитроцеллюлозной мембраны (НЦМ) и проводят повторный электрофорез в поперечном направлении. АГ выходят из геля и прикрепляются к листу нитроцеллюлозной мембраны.
Далее лист НЦМ с отпечатками АГ (блот – отпечаток) обрабатывают сывороткой больного, содержащей АТ. Если АТ есть, то они связываются с НЦМ по месту локализации различных фракций АГ.
Далее метод не отличается от гетерогенного иммуноферментного анализа: НЦМ промывают для удаления несвязавшихся белков и вносят в них антииммуноглобулиновые антитела, меченные ферментом (пероксидазой). После инкубации и отмывания НЦМ
139

помещают в раствор субстрата (перекись водорода) и хромогена (диаминобензидин и др.) О количестве фракций антител к различным АГ фрагментам судят по появлению нескольких окрашенных пятен на НЦМ.
Радиоиммунологический анализ.
Принцип радиоиммунологического анализа (РИА) основан на выявлении комплекса АГ-АТ, в котором один из иммунореагентов был мечен радиоактивным изотопом. Обычно используют изотопы йода (125I или 131I). Учет реакции проводят по убыванию или по возрастанию радиоактивности (в зависимости от методики РИА) с помощью специальных счетчиков - или -излучения. Метод высокочувствителен, но постепенно вытесняется иммуноферментным анализом, учитывая небезопасность работы с радиоактивными изотопами и необходимость в сложном регистрирующем оборудовании.
Однако там, где в качестве АГ выступает низкомолекулярный гаптен (например, лекарственные препараты, стероидные и пептидные гормоны и др.) РИА используется весьма широко. Существуют его гетерогенные варианты, аналогичные ИФА, а также конкурентные варианты.
В последнем случае на твердую фазу (например, полистироловые шарики) сорбируют известные АТ в комплексе с радиоактивно меченым АГ (например, лекарственным препаратом) в известной концентрации. К этому комплексу добавляют исследуемый материал, содержащий неизвестную концентрацию изучаемого лекарственного препарата-АГ. Он вытесняет из комплекса меченый АГ пропорционально своей концентрации. Радиоактивность вытесненного АГ измеряют с помощью счетчика и определяют концентрацию неизвестного АГ.
Клеточные методы оценки иммунитета
Реакция бласттрансформации лимфоцитов (РБТЛ).
Переход малых лимфоцитов в бластные формы, способные к пролиферации и дальнейшей дифференцировке называется бласттрансформацией и сопровождается морфологическими изменениями лимфоцитов. Бласты – крупные, округлой формы
140
