
Pervye_voprosy по фарм экзамену
.pdf
а) при ожирении, липофобные ЛС не растворимы в жировой ткани необходимо вычислить идеаль ный вес по росту (формула Брока: идеальный вес = рост (в см) - 100) и пересчитать Vd на идеальный вес по росту.
б) при отеках нуж но вычислить избыточный объѐм воды = избыточный вес – идеальный, Vd надо увеличивать на литр каждого избыточного килограмма воды.
Зависимость основных фармакокинетических параметров от различных факторов:
1. Всасывание ЛС: при возраста абсорбция ЛС, его метаболизм в ходе пресистемной элиминации, изменяется биодоступность ЛС.
2.Объем распределения Vd: с возрастом и при ож ирении,  при отеках
при отеках
3.Период полувыведения: изменяется с возрастом и при ожирении (т.к. уменьшается Vd)
4.Клиренс: определяется функциональ ным состоянием почек и печени
20. Почечный клиренс лекарств, механизмы, их количественные и качественные характеристики.
Почечный клиренс - это мера объема плазмы крови, которая очищается от лекарственного вещества в единицу времени почками: Cl (мл/мин) = U × V/P, где U - концентрация ЛС в мл мочи, V – объем мочи, выделяемой в мин и P = концентрация ЛС в мл плазмы.
Механизмы почечного клиренса и их характеристика:
1.Фильтрация: ЛС, выделяемое толь ко фильтрацией {инсулин} будет иметь клиренс, равный СКФ (125-130 мл/мин) Определяется: почечным кровотоком, несвязанной фракцией ЛС и фильтрационной способностью почек. Большинство препаратов имеет низкие молекулярные массы и поэтому свободно фильтруется от плазмы в кл убочке.
2.Активная секреция: ЛС, выделяемое фильтрацией и полной секрецией {парааминогиппуриевая кислота}, будет иметь клиренс, равный почечному плазменному клиренсу (650 мл/мин)
Почечный каналец содержит две транспортных системы, которые могут выделить препараты в ультрафильтрат, одна для органических кислот и другая для органических оснований. Эти системы требуют энергии для активного транспорта против градиента концентраций; они – место конкуренции за переносчика одних лекарственных веществ с другими.
Определяется: максималь ной скоростью секреции, объемом мочи
3.Реабсорбция: значения клиренса меж ду 130 и 650 мл/мин предполагают, что ЛС фильтруется, выделяется, и частично повторно реабсорбируется Реабсорбция происходит на протяжении всего почечного канала и зависит от полярности ЛС, реабсорбируются неполярные, липофильные.
Определяется: величиной рН первичной и ионизацией ЛС Ряд таких показателей как возраст, совместное употребление нескольких лекарственных препаратов, болезни значительно влияют на почечный клиренс:
а) почечная недостаточность уменьшение клиренса ЛС высокий уровень ЛС в крови б) гломерулонефрит потеря сывороточного белка, который обычно был доступен и связывал ЛС увеличение уровня свободной фракции ЛС в плазме
21. Факторы, влияющие на почечный клиренс лекарств. Зависимость клиренса от физико-химических свойств лекарственных средств.
Факторы, влияющие на почечный Cl:
а) гломерулярная фильтрация б) скорость почечного кровотока
в) максимальная скорость секреции г) объѐм мочи д) несвязанная фракция ЛС в крови
Зависимость почечного клиренса от физико-химических свойств ЛВ:
Общие закономерности: 1) полярные ЛС не реабсорбируются, неполярные – реабсорбируются 2) ионные ЛС секретируются, не ионные – не секретируются.
I. Неполярные неионогенные вещества: фильтруются толь ко в несвязанных формах, не секретируются, реабсорбируются Почечный клиренс мал и определяется: а) фракцией ЛС, несвязанной в крови б) объемом мочи
II. Полярные неионогенные вещества: фильтруются в несвязанной форме, не секретируют, не реабсо рбируются Почечный клиренс высокий, определяется: а) фракцией ЛС, несвязанной в крови б) скоростью гломерулярной фильтрации
III. Ионизированные в моче неполярные в неионной форме: фильтруются, активно секретируются, неполярные реабсорбируются Почечный клиренс определяется: а) фракцией ЛС, несвязанной в крови б) фракцией ЛС, ионизированной в моче в) объемом мочи
IV. Ионизированные в моче полярные в неионизированном виде: фильтруются, активно секретируются, не реабсорбируются Почечный клиренс определяется: а) почечным кровотоком и скоростью гломерулярной фильтрации б) максимальной скоростью секреции
11
22. Печеночный клиренс лекарств, его детерминанты и ограничения. Энтерогепатический цикл лекарственных средств.
Механизмы печеночного клиренса:
1) метаболизм (биотрансформация) путем окис ления, восстановления, алкилирования, гидролиза, коньюгации и т.д. Основная стратегия метаболизма ксенобиотиков: неполярные вещества полярные (гидрофильные) метаболиты, выводимые с мочой.
2) секреция (выведение нетрансформированных веществ в желчь)
Только полярные вещества с молекулярной массой > 250 активной транспортируются в желчь (органические кислоты, основания).
Детерминанты печеночного клиренса:
а) Скорость кровотока в печени б) Максимальная скорость экскреции или метаболических превращений в) Km – константа Михаэлиса
г) Несвязанная с белком фракция
Ограничения печеночного клиренса:
1.Если Vmax/Km велико → Cl печ = скорости кровотока в печени
2.Если Vmax/Km средние величины → Cl = сумма всех факторов
3.Если Vmax/Km мало → Cl печ мал, ограничен
Энтерогепатический цикл ЛС - ряд препаратов и продуктов их превращения в значительном количестве выводится с желчью в кишечник, откуда частично выводится с экс крементами, а частично - повторно всасывается в кровь, вновь попадает в печень и в ыводится в кишечник.
Печеночная элиминация препаратов может быть значительно изменена болезнью печени, возрастом, диетой,
генетикой, продолжительность назначения лекарственных средств (например, вследствие индукции печеночных ферментов), и других факторов.
23. Коррекция лекарственной терапии при заболеваниях печени и почек. Общие подходы. Коррекция режима дозирования под контролем общего клиренса препарата.
1.Отменить препараты, которые не являются необходимыми
2.При заболеваниях почек использовать препараты, выделяющиеся с печенью и наоборот.
3.Снизить дозу или увеличить интервал между введениями
4.Тщательный мониторинг за побочными и токсическими эффектами
5.При отсутствии фармакологического эффекта повышать дозу необходимо медленно и под контролем фармакологических и токсических эффектов
6.При возможности определить концентрацию вещества в плазме и корригировать терапию по С l препарата индивидуально
7.Использовать косвенный способ оценки Cl.
Коррекция реж има дозирования под контролем общего клиренса препарата:
Коррекция дозы: Динд.=Дт ипичн.×Clинд./Clтипичн.
При непрерывном внутривенном введении препарата: Скорость введения индивидуаль ная = Скорость введения
типичная × Cl инд. / Cl т ипичн.
При прерывистом введении: 1) изменить дозу 2) изменить интервал 3) изменить оба параметра. Например, при уменьшении клиренса на 50% мож но уменьшить на 50% дозу и сохранить интервал или увеличить в два раза интервал и сохранить дозу. Предпочтительно уменьшать дозу и сохранять интервал введения.
24. Коррекция лекарственной тера пии при поражении печени и режима дозирования под контролем остаточной функции почек.
Заболевания печени могут снижать клиренс и удлинять период полувыведения многих ЛС. Однако у некоторых препаратов, которые элиминируются печенью, не происходит изменения этих показателей при нарушениях функции печени, поэтому заболевания печени не всегда влияют на собственный печеночный клиренс. В настоящее время нет надежного маркера, который можно было бы использовать для предсказания печеночного клиренса подобного клиренсу креатинина.
Клиренс креатинина – важ нейший количественный индикатор функции почек, на основе которого можно скоректировать режим дозирования Нам известно:
а) остаточная функция почек, определяющаяся клиренсом креатинина у данного больного Clкр/больного б) общий клиренс данного ЛС (СlЛС /общий) и доля почечного клиренса ЛС в общем клиренсе
в) нормаль ный клиренс креатинина Clкр/норма по нормограмме 3) Css и F для данного ЛС (из справочника)
Найти: дозу ЛС для данного больного
ClЛС /почечный норма = ClЛС /общий Х долю почечного клиренса ЛС в общем клиренсе
СlЛС /почечный больного = Clкр/больного / Сlкр/норма * ClЛС/почечный норма ClЛС /не почечный норма = ClЛС /общий – ClЛС /почечный норма
ClЛС /общий больного = СlЛС /почечный больного + ClЛС /не почечный норма
Доза данного ЛС внутрь при нормальной функции почек равна: ПДнорма = Css X Cl / F
12

Доза данного ЛС внутрь для нашего больного равна: ПДбольного = ПДнорма Х СlЛС /общий больного / СlЛС /общий
Ответ: ПДбольного
25. Факторы, изменяющие клиренс лекарственных веществ. Стратегия индивидуальной лекарственной терапии.
1.Взаимодействия ЛС на уровне: почечной секреции, биохимической трансформации, явлений ферментативной индукции
2.Болезни почек: нарушения кровотока, острые и хронические поражения почек, исходы длитель ных почечных заболеваний
3.Болезни печени: алкогольный цирроз, первичный цирроз, гепатиты, гепатомы
4.Болезни ЖКТ и эндокринных органов
5.Индивидуальная непереносимость {отсутствие ферментов ацетилирования – непереносимость аспирина} Признание важной роли концентрации как связующего звена фармакокинетики и фармакод инамики способствует созданию стратегии целевой концентрации - оптимизации дозы у да нного больного на основе измерения концентрации ЛС. Она складывается из следующ их этапов:
1.Выбор целевой концентрации
2.Расчет Vd и Cl на основе типовых значений и внесения поправок с учетом таких факторов как масса тела и функция почек.
3.Ввод загрузочной дозы или поддерживающей дозы, рассчитанных с учетом значений TC, V d и Cl.
4.Регистрация реакции больного и определение концентрации ЛС
5.Пересмотр Vd и Cl на основе результатов измерения концентрации.
6.Повтор шагов 3-6 с целью подбора необходимой для оптимальной реакции на лекарство поддерж ивающей дозы.
26. Биотрансформация лекарственных средств, ее биол огический смысл, основная направленность и влияние на активность лекарств. Основные фазы метаболических превращений лекарств в организме.
Биотрансформация ЛС – химические превращения ЛС в организме.
Биологический смысл биотрансформации ЛС: создание субстрата, удобного для последующей утилизации (в качестве энергетического или пластического материала) или в ускорении выведения ЛС из организма.
Основная направленность метаболических превращений ЛС: неполярные ЛС → полярные (гидрофильные)
метаболиты, выводимые с мочой.
Выделяют две фазы метаболических реакций ЛС:
1) метаболическая трансформация (несинтетические реакции, фаза 1) - превращение веществ за счет микросомального и внемикросомального окисления, восстановления и гидролиза 2) конъюгация (синтетические реакции, фаза 2) - биосинтетический процесс, сопровождающийся
присоединением к лекарственному веществу или его метаболитам ряда химических группировок или молекул эндогенных соединений путем а) образования глюкуронидов б) эфиров глицерина в) сульф оэфиров г) ацетилирования д) метилирования
Влияние биотрансформации на фармакологическую активность ЛС:
1)чаще всего метаболиты биотрансформации не обладают фармакологической активностью или их активность снижена по сравнению с исходным веществом
2)в некоторых случаях метаболиты могут сохранять активность и даже превосходить по активности исходное вещество (кодеин метаболизируется до более фармакологически а ктивного морфина)
3)иногда в ходе биотрансформации образуются токсичные вещества (метаболиты изониазида, л идокаина)
4)иногда в ходе биотрансформации образуются метаболиты с противополож ными фармакол огическими свойствами
(метаболиты неселективных агонистов 2- адренорецепторов обладают свойствами блокаторов этих рецепторов) 5) ряд веществ является пролекарствами, которые исходно не дают фармакологических эффектов, но в ходе
биотрансформации преобразуются в БАВ (неактивная L-допа, проникая через ГЭБ, превращается в мозге в активный дофамин, при этом нет системных эффектов дофамина).
27. Клиническое значение биотрансформации лекарств. Влияние пола, возраста, массы тела, экологических факторов, курения, алкоголя на биотрансформацию л екарств. Метаболическое взаимодействие лекарств. Болезни, влияющие на их биотрансформацию.
Клиническое значение биотрансформации ЛС: т.к. доза и частота приема, необходимые для достижения эффективной концентрации в крови и тканях, могут варьировать у больных из-за индивидуальных различий в распределении, скорости метаболизма и элиминации ЛС, важен их учет в клинической практике.
Влияние на биотрансформацию ЛС различных факторов:
а) функциональное состояние печени: при ее заболеваниях клиренс ЛС обычно уменьшается, а пер иод полуэлиминации возрастает.
б) влияние факторов среды: курение способствует индукции цитохрома P450, в результате чего ускоряется метаболизм ЛС в ходе микросомального окисления в) у вегетарианцев биотрансформация ЛС замедлена
г) у пож илых и молодых пациентов характерна повышенная чувствитель ность к фармакологическому или токсическому действию ЛС (у лиц пож илого возраста и у детей до 6 мес активность микрос омаль ного окисления снижена)
13
д) у мужчин метаболизм некоторых ЛС происходит быстрее, чем у женщин, т.к. андрогены стимулируют синтез микросомальных ферментов печени {этанол} е) высокое содержание в пище белков и интенсивная физическая нагрузка: ускорение метаболизма ЛС.
ж) алкоголь и ож ирение замедляют метаболизм ЛС Метаболическое взаимодействие ЛС:
1)индукция ферментов метаболизма ЛС – абсолютное увеличение их количества и активности вследствие воздействия на них опре деленных ЛС. Индукция ведет к ускорению метаболизма ЛС и (как правило, но не всегда) к снижению их фармакологической активности (рифампицин, барбитураты – индукторы цитохрома P450)
2)ингибирование ферментов метаболизма ЛС – угнетение активности ферментов метаболизма под действием некоторых ксенобиотиков:
а) конкурентное метаболическое взаимодействие – ЛС с высоким аффинитетом к определенным ферментам снижают метаболизм ЛС с более низким аффинитетом к этим ферментам (верапамил)
б) связывание с геном, индуцирующим синтез определенных изоферментов цитохрома P450 (цимедин) в) прямая инактивация изоферментов цитохрома P450 (флавоноиды)
Болезни, влияющие на метаболизм ЛС:
а) болезни почек (нарушение почечного кровотока, острые и хронические заболевания почек, исходы длительных почечных заболеваний)
б) болезни печени (первичный и алкогольный циррозы, гепатиты, гепатомы) в) болезни ЖКТ и эндокринных органов
в) индивидуальная непереносимость некоторых ЛС (отсутствие ферментов ацетилирования – непереносимость аспирина)
28. Пути и механизмы выведения лекарств из организма. Возможности управления выведением лекарств.
Пути и механизмы выведения ЛС: элиминация ЛС печенью и почками и некоторыми другими органами: а) почками путем фильтрации, секреции, реабсорбции б) печенью путем биотрансформации, экскреции с желчью
в) через легкие, слюну, пот, молоко и т.д. путем секреции, испарения
Возможности управления процессами выведения ЛС:
1.управление pH: в щелочной моче повышается выведение кислых соединений, в кислой – выведение основных соединений
2.применение желчегонных препаратов (холензим, аллохол)
3.гемодиализ, перитонеальный диализ, гемосорбция, лимфосорбция
4.форсированный диурез (в/в NaCl или глюкоза для водной нагрузки + фуросемид или маннитол)
5.промывание желудка, применение клизм
29. Концепция рецепторов в фармакологии, молекулярная природа рецепторов, сигнальные механизмы действия лекарств (типы трансмембранной сигнализации и вторичные посредники).
Рецепторы – молекулярные компоненты клетки или организма, котор ые взаимодействуют с ЛС и индуцируют ряд биохимических событий, ведущих к развитию фармакологического эффекта.
Концепция рецепторов в фармакологии:
1.Рецепторы детерминируют количественные закономерности действия ЛС
2.Рецепторы ответственны за селективность действия ЛС
3.Рецепторы посредники действия фармакологических антагонистов
Концепция рецепторов - основа целенаправленного применения лекарственных средств, влияющих на регуляторные, биохимические процессы и коммуникации.
Молекулярная природа рецепторов:
1.регуляторные белки, посредники действия различных химических сигналов: нейромедиаторов, гормонов, аутокоидов
2.ферменты и трансмембранные белки переносчики ( Na+, K+ АТФаза)
3.структурные белки (тубулин, белки цитоскелета, клеточная поверхность)
4. ядерные белки и нуклеиновые кислоты Сигнальные механизмы действия лекарств:
1)проникновение растворимых в липидах лигандов через мембрану и их действие на внутриклето чные рецепторы.
2)сигнальная молекула связывается с внеклеточным доменом трансмембранного белка и активирует ферментативную активность его цитоплазматического домена.
3)сигнальная молекула связывается с ионным каналом и регулирует его открытие.
4)сигнальная молекула связывается с рецептором на поверхности клетки, который сопряжен с эффекторным ферментом посредством G-белка. G-белок активирует вторичный посре дник.
Типы трансмембранной сигнализации:
а) через 1-TMS-рецепторы, обладающие и не обладающие тирозинкиназной активностью б) через 7-ТMS-рецепторы, связанные с G-белком
в) через ионные каналы (лиганд-зависимые, потенциал-зависимые, щелевые контакты) Вторичные посредники: цАМФ, ионы Ca2+, ДАГ, ИФ3.
14
30. Физико-химические и химические механизмы действия лекарственных веществ. а) Физико-химическое взаимодействие с биосубстратом – неэлектролитное действие.
Основные фармакологические эффекты: 1) наркотическое 2) обще депрессивное 3) парализующее 4) местно раздражающее 5) мембранолитическое действия.
Химическая природа веществ: химически инертные углеводороды, эфиры, спирты, альдегиды, барб итураты, газовые наркотические средства Механизм действия – обратимое деструирование мембран.
б) Химический (молекулярно-биохимический) механизм действия лекарственных средств.
Основные типы химического взаимодействия с биосубстратом:
1.Слабые (нековалентные, обратимые взаимодействия) (водородные, ионные, монод ипольные, гидрофобные).
2.Ковалентные связи (алкилирование).
Значение нековалентных взаимодействий ЛС: действие неспецифично, не зависит от химического строения вещества. Значение ковалентных взаимодействий ЛС: действие специфично, критически зависит от химических строения, реализиуется посредством влияния на рецепторы.
31. Селективность и специфичность действия лекарств.
Терапевтические, побочные и токсические эффекты лекарств, их природа с позиций концепции рецепторов. Терапевтическая стратегия борьбы с побочными и токсическими эффектами лекарств.
Специфичность – это когда ЛС связывается со строго специфичным ему типом рецептора.
Селективность - это когда ЛС способно связываться с одним или несколькими типами рецепторов более точно, чем с другими.
Терапевтическое действие — основной желательный фармакологический эффект, ожидаемый от данного фармакологического препарата.
Побочные эффекты – те эффекты, которые возникают при применении веществ в терапевтических дозах и составляют спектр их фармакологического действия.
Токсические эффекты – нежелательные эффекты, проявляющиеся у данного ЛС при выходе из терапевтического диапазона.
Связи терапевтичес кого и токсического эффектов ЛС на основе анализа рецепторно-эффекторных механизмов:
1)терапевтический и токсический эффекты, опосредуемые одним и тем же рецепторно-эффекторным механизмом
{празозин действует как альфа-селективный антагонист на рецепторы ГМК сосудов и оказывает гипотензивное действие при эссенциаль ной гипертензии, но при его большой дозе у больного может возникнуть постураль ная гипотензия}
2)терапевтический и токсический эффекты, опосредуемые идентичными рецепторами, но различными тканями или различными эффекторными путями. {сердечные гликозиды используют для увеличения сократительной способности миокарда, в тоже время они нарушают функцию ЖКТ, зрения за счет блокады Na+/K+-АТФазы клеточной мембраны}
3)терапевтический и токсический эффекты, опосредуемый различными типами рецепторов {например, норадреналин оказывает гипертензивное действие через a1-Ар, но при этом вызывает тахикардию через b1-Ар}
Терапевтическая стратегия борьбы с терапевтическими и побочными эффектами ЛС:
1.ЛС всегда следует вводить в наименьшей дозе, которая вызывает приемлемый терапевтический эффект
2.Снижение дозы одного ЛС за счет назначения другого ЛС со сходным действием, но через иные рецепторы и с иным профилем токсичности.
3.Селективность действия ЛС может быть увеличена путем управления концентрацией ЛС в районе рецепторов различных отделов организма (местное применение ЛС – ингаляционное применение сальбутамола при бронхиальной астме)
32. Термины и понятия количественной фармакологии: эффект, эффективность, акт ивность, агонист (полный, частичный), антагонист. Клиническое различие понятий активность и эффективность лекарств.
Эффект (ответ) – количественный выход реакции взаимодействия клетки, органа, системы или организма с фармакологическим агентом.
Эффективность – мера реакции по оси эффекта – величина отклика биологической системы на фармакологическое воздействие; это способность ЛС оказывать максимально возможное для него действие. Т.е. фактически это максимальная величина эффекта, которую мож но достигнуть при введении данного лекарства. Численно характеризуется величиной Еmax. Чем выше Еmax, тем выше эффективность лекарства
Активность – мера чувствитель ности к ЛС по оси концентраций, характеризует аффинность (сродство лиганда к рецептору), показывает, какая доза (концентрация) ЛС способна вызвать развитие стандартного эффекта, равного 50% от максимально возможного для этого лекарства . Численно характеризуется величиной ЕС50 или ED50. Чем выше активность ЛС, тем меньшая его доза требуется для воспроизведения терапевтического эффекта.
Эффективность: 1=2>3 Активность: 1>3>2
15
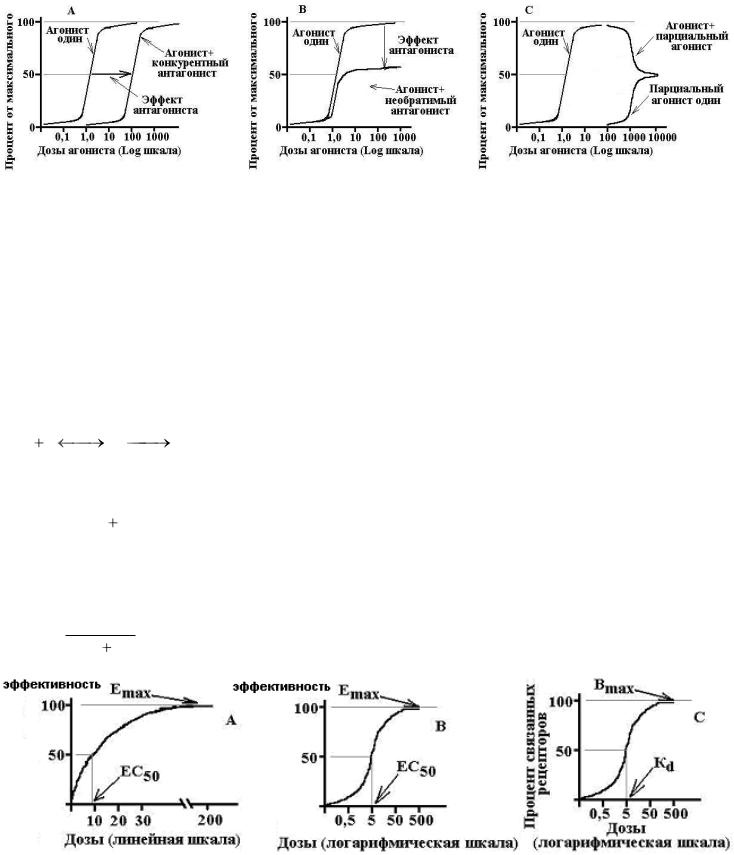
В клинической деятельности важ нее знать эффективность, а не активность, т.к. нас больше интересует способность ЛС вызывать определенное действие в организме.
Агонист – лиганд, который связывается с рецептором и вызывает биологическую реакцию, срабатывание физиологической системы. Полный агонист – максимальный отклик, частичный – вызывают меньшую реакцию даже при оккупации всех рецепторов.
Антагонист - лиганды занимающие рецепторы или изменяющ ие их таким образом, что они утрачивают способность взаимодействовать с другими лигандами, но сами не вызывающ ие биологической реакции (блокируют действие агонистов).
Конкурентные антагонисты - взаимодействуют с рецепторами обратимо и тем самым конкурируют с агонистами. Увеличение концентрации агониста может полностью устранить эффект антагониста. Конкурентный антагонист сдвигает кривую «доза-эффект» для агониста, увеличивает EC50, не влияет на Emax.
Неконкурентные антагонисты - необратимо изменяют сродство рецепторов к агонисту, связывание часто происходит не с активным участком рецептора, увеличение концентрации агониста не устраняет действие антагониста. Неконкурентный антагонист снижает Emax, не изменяет EC50, кривая «доза-эффект» сжимается относительно вертикальной оси.
33. Количественные закономерности действия лекарств. Закон уменьшения отклика биологических систем. Модель Кларка и ее следствия. Общий вид зависимости концентрация – эффект в нормальных и логнормальных координатах.
Модель Кларка-Ариенса:
1.Взаимодействие меж ду лигандом (L) и рецептором (R) обратимы.
2.Все рецепторы для данного лиганда – эквивалентны и независимы (их насыщение не влияет на другие рецепторы).
3.Эффект прямо пропорционален числу занятых рецепторов.
4.Лиганд существует в двух состояниях: свободном и связанном с рецептором.
|
R L |
|
RL |
|
эффект |
А) |
|
Kd |
|
Ke |
, где Kd – константа равновесия, Ke – внутренняя активность. |
|
|
|
|
Б) Т.к. при возрастании количества лигандов в какой-то момент времени все рецепторы окажутся заняты, то максима льно возмож ное количество образованных комплексов лигандрецептор описывается формулой:
[RL] = [R] × |
[L] |
(1) |
|
|
|
||
Kd [L] |
|||
Эффект определяется вероятностью активации рецептора при связывании с лигандом, т.е. его внутренней активностью (Ке), поэтому E = Ke×[RL]. При этом эффект максимален при Ке=1 и минимален и Ке=0. Естественно,
что максимальный эффект описывается соотношением Emax = Ke×[Rобщий], где [Rобщий] – общее число рецепторов для данного лиганда
Эффект зависит и от концентрации лиганда на рецепторах [С], поэтому
[C]
E = Emax EC50 [C] (2)
Из приведенных соотношений вытекает, что EC50=Kd
16

Emax – максимальный эффект, Bmax – максимальное число связанных рецепторов, EC50 – концентрация ЛС, при которой возникает эффект, равный половине от максимального, Kd – константа диссоциации вещества от рецептора, при
которой связано 50% рецепторов.
Закону убывания отклика соответствует параболическая зависимость «концентрация – эффективность». Ответ на малые дозы ЛС обычно возрастает прямо пропорционально дозе. Однако при увеличении дозы прирост ответной реакции снижается и в конечном счете может быть достигнута доза, при которой не происходит дальнейшего увеличения ответа (за счет оккупации всех рецепторов для данного лиганда).
34. Градуальная и квантовая оценка эффекта, сущность и клинические приложения. Количественная оценка активности и эффективности лекарств в экспериментальной и клинической пра ктике.
Все фармакологические эффекты можно условно разделить на две категории:
а) градуальные (непрерывные, интегральные) эффекты – такие эффекты ЛС, которые могут быть измерены количественно { действие гипотензивных ЛС – по уровню АД}. Описываются градуальной «кривой доза-эффект» (см. в. 36), на основе которой можно оценить: 1) индивидуальную чувствительность к ЛС 2) активность ЛС 3) максимальную эффективность ЛС б) квантовые эффекты – такие эффекты ЛС, которые являются дискретной величиной, качественным признаком,
т.е. описываются всего лишь несколькими вариантами состояний {головная боль после приема анальгетика или есть, или нет}. Описывается квантовой кривой доза-эффект, где отмечают зависимость проявления эффекта в популяции от величины принимаемой дозы ЛС. График зависимости доза-эффект при этом имеет куполообразный вид и идентичен Гауссовой кривой нормального распределения. На основе квантовой кривой можно : 1) оценить популяционную чувств ительность ЛС 2) отметить наличие эффекта при данной дозе 3) выбрать среднюю терапевтическую дозу.
Различия между градуальной и квантовой характеристикой «доза-эффект»:
Параметр |
Градуальная кривая |
Квантовая кривая |
Характер эффекта |
Количественный |
Качественный |
Возможность построения |
У индивидуума |
В популяции |
Сила ЛС |
Определяется величиной EC50 (ED50) |
Определяется величиной EC50 (ED50) |
Эффективность |
Определяе тся величиной Emax |
Не может быть определена без |
|
|
специального анализа |
Вид кривой |
Экспоненциальная зависимость (S- |
Кривая Гауссова распределения |
|
образная в полулогарифмических |
|
|
координатах) |
|
Количественная оценка активности и эффективности ЛС проводится на ос нове построения кривых «доза-эффект» и их последующей оценке (см. в.35)
35. Виды действия лекарственных средств. Изменение действия лекарств при их повторном введ ении.
Виды действия ЛС:
1. Местное действие – действие вещества, возникающее на месте его приложения (анестетик – на слизистую оболочку)
2. Резорбтивное (системное) действие – действие вещества, развивающееся после его всасывания, поступления в общий кровоток, а затем в ткани. Зависит от путей введения ЛС и их способности проникать через биологиче ские барьеры.
Как при местном, так и резорбтивном действии лекарственные средс тва могут оказывать либо прямое, либо рефлекторное влияние:
а) прямое влияние - непосредственный контакт с органом-мишенью (адреналин на сердце).
б) рефлекторное – изменение ф ункции органов или нервных центров путем влияния на экстеро- и интерорецепторы (горчичники при патологии органов дыхания рефлекторно улучшают их трофику)
Изменения действия ЛС при их повторном введении: 1. Кумуляция – увеличение эффекта вследствие накопления в организме ЛС:
а) материаль ная кумуляция - накопление действующего вещества в организме {сердечные гл икозиды} б) функциональная кумуляция – нарастающие изменения функции систем организма {изменения функции ЦНС
при хроническом алкоголизме}.
2. Толерантность (привыкание) - снижение ответной реакции организма на повторные введения ЛС; для того, чтобы восстановить реакцию на ЛС, его приходится вводить во все бóльших и бóльших дозах {диазепам}:
а) истинная толерантность – наблюдается как при энтеральном, так и при парентеральном введении ЛС, не зависит от степени его всасывания в кровоток. В ее основе - фармакодинамические механизмы привыкания:
1) десенситизация – снижение чувствительности рецептора к лекарственному средству { -адреномиметики при длительном применении приводят к фосфорилированию -адренорецепторов, которые не способны ответить на - адреномиметики}
2) Down-регуляция – снижение числа рецепторов к лекарственному средству {при п овторных введениях наркотических анальгетиков количество опиоидных рецепторов снижается и требуются все бóльшие и бóль шие дозы лекарства, чтобы вызвать желаемый ответ} . Если ЛС блокирует рецепторы, то механизм толерантности к
17

нему может быть связан с up-регуляцией – увеличением числа рецепторов к лекарственному средству ( - адреноблокаторы)
3) включение компенсаторных механизмов регуляции (при повторных введениях гипотензивных препаратов ко ллапс возникает значитель но реже, чем при первом введении за счет адаптации барореце пторов)
б) относительная толерантность (псевдотолера нтность) - развивается только при введении ЛС внутрь и связан со снижением скорости и полноты всасывания лекарства
3.Тахифилаксия – состояние, при котором частое введение ЛС вызывает развитие толерантности уже через несколько часов, но при достаточно редких введениях ЛС его эффект сохраняется в полной мере. Развитие толерантности связано обычно с истощением эффе кторных систем.
4.Лекарственная зависимость – непреодолимое стремление к приему вещества, вводимого ранее. Выделяют психическую (кокаин) и физическую (морфин) лекарственную зависимости.
5.Гиперчувствительность – аллергическая или другая иммунологическая реакция на ЛС при повторном введении.
36. Зависимость действия лекарств от возраста, пола и индивидуальных особенностей организма. Значение суточных ритмов.
а) от возраста: у детей и у пож илых чувствитель ность к ЛС повышена (т.к. у детей существует недостаточность многих ферментов, функции почек, повышенная проницаемость ГЭБ, в пожилом возрасте замедлено всасывание ЛС, менее эффективно протекает метаболизм, понижена скорость экскреции препаратов почками):
Дети |
Пож илые |
|
1. У новорожденных снижена чувствительность к сердечным |
1. |
Резко возрастает чувствительность к сердечным |
гликозидам, т.к. у них на единицу площади кардиомиоцита |
гликозидам в связи со снижением числа Na+/K+- |
|
больше Na+/K+-АТФаз (мишеней действия гликозидов). |
АТФаз. |
|
2. У детей ниже чувствительность к сукцинилхолину и |
2. |
Снижается чувствитель ность к - |
атракурию, но повышена чувствительность ко всем другим |
адреноблокаторам. |
|
миорелаксантам. |
3. |
Повышается чувствитель ность к блокаторам |
3. Психотропные средства могут вызвать у детей аномальные |
кальциевых каналов, т.к. ослабляется |
|
реакции: психостимуляторы – могут повышать концентрацию |
барорефлекс. |
|
внимания и снижать моторную гиперактивность, |
4. |
Отмечается атипичная реакция на |
транквилизаторы – напротив, способны вызвать т.н. атипичное |
психотропные лекарственные средства, подобная |
|
возбуж дение. |
реакции детей. |
|
б) от пола: |
|
|
1)гипотензивные средства – клонидин, -адреноблокаторы, диуретики могут вызывать нарушение сексуальных функций у мужчин, но не влияют на работу репродуктивной системы женщ ин.
2)анаболические стероиды вызывают бóльший эффект в организме женщин, чем в организме мужчин.
в) от индивидуальных особенностей организма: дефицит или избыток тех или иных ферментов метаболизма ЛС приводит к увеличению или уменьшению их действия (дефицит псевдохолинэстеразы крови – аномально длительная миорелаксация при применении сукцинилхол ина)
г) от суточных ритмов: изменение действия ЛС на организм количественно и качественно в завис имости от времени суток (максимальное действие при максимальной активности).
37. Вариабельность и изменчивость действия лекарств. Гипо- и гиперреактивность, толерантность и тахифилаксия, гиперчувствительность и идиосинкразия. Причины вариабельности действия лекарств и рациональная стратегия терапии.
Вариабельность отражает разности меж ду индивидуумами в ответ на данное лекарственное средство.
Причины вариабельности действия ЛС:
1)изменение концентрации вещества в зоне рецептора – из-за различий в скорости всасывания, его распределения, метаболизма, элиминации
2)вариации в концентрации эндогенного лиганда, рецептора – пропранолол (β-адреноблокатор) замедляет ЧСС у людей с повышенным уровнем катехоламинов в крови, но не влияет на фоновую ЧСС у спортсменов.
3)изменение плотности или функции рецепторов.
4)изменение компонентов реакции, расположенных дистальнее рецептора.
Рациональная стратегия терапии: назначение и дозировка ЛС с учетом вышеперечисленных причин вариабельности действия ЛС.
Гипореактивность – снижение эффекта данной дозы ЛС по сравнению с тем эффектом, который наблюдается у большинства пациентов. Гиперреакцивность - повышение эффекта данной дозы ЛС по сравнению с тем эффектом, который наблюдается у большинства пациентов.
Толерантность, тахифилаксия, гиперчувствительность – см. в.36 Идиосинкразия – извращенная реакция организма на данное ЛС, связанная с генетическими особенностями
метаболизма ЛС или с индивидуальной иммунологической реактивностью, в т.ч. с аллергическими реакциями.
38. Оценка безопасности лекарств. Терапевтический индекс и стандартные границы безопасности.
Оценка безопасности осуществляется на двух уровнях:
а) доклиническом (получения сведений о токсичности ЛС, влияния на репродуктивные функции, э мбриотоксичность и тератогенность, отдаленные эффекты)
18
б) клиническом (дальнейшая оценка эффективности и безопасности ЛС)
Если после того, как достигается плато эффекта, доза ЛС будет продолжать расти, то через определенный промежуток времени начнет проявляться его токсическое действие. Зависимость токсического действия от дозы
(концентрации) ЛС носит такой же характер, как и его полезный эффект и может быть описана градуальной или квантовой кривыми. На этих кривых также может быть определена величина TD50 или ТС50 – токсическая доза (концентрация) ЛС, которая вызывает токсический эффект, равный 50% от максимального (для квантовой кривой – токсический эффект у 50% лиц в популяции). Иногда, вместо TD50 пользуются показателем LD50 – летальная доза, которая вызывает гибель 50% объектов в популяции.
Оценка безопасности ЛС характеризуется на основе градуль ных или квантовых кривых «д оза-эффект» и следующих показателей:
а) терапевтический индекс – это соотношение между токсической и эффективной дозами лекарства, которые вызывают появление полумаксимального эффекта: ТИ=TD50/ED50. Чем больше величина терапевтического индекса, тем более безопасным является лекарство.
б) терапевтическая широта (терапевтическое окно) – это диапазон доз между минимальной терапевтической и минимальной токсической дозами ЛС. Является более корректным п оказателем безопасности ЛС, посколь ку позволяет учитывать степень нарастания нежелательных эффектов на кривой «доза-эффект».
в) фактор надежной безопасности – это отношение минимальной токсическо й дозы к максимальной эффективной (ФНБ =TD1/ED99), показывает, во сколько раз может быть превышена терапевтическая доза лекарства без риска развития интоксикации (нежелательных эффе ктов).
г) терапевтический коридор – это диапазон эффективных концентраций ле карственного вещества в крови, которые необходимо создать и поддерживать в организме, чтобы обеспечить достижение желаемого терапевтического действия.
39.Фармакокинетическое взаимодействие ЛС Взаимодействие ЛС – это изменение выраженности и характера эффе ктов при одновременном или предварительном применении несколь ких лекарств.
Фармакокинетическое взаимодействие: 1) на этапе всасывания.
При введении per os взаимодействие детерминируют:
1.кислотность среды
2.прямое взаимодействие в ЖКТ
Тетрациклины взаимодействуют с каль цием, аллюминием, железом, магнием с образованием хелатных комплексов. Холестирамин нарушает всасывание производных кислот, препаратов каль ция, варвар ина, дигоксина, дигитоксина, жирорастворимых витаминов, триметоприма, клиндамицина, цефалексин, тетрациклина. Препараты железа лучше всасываются с витамином С. Препараты железа с карбонатами, тетрациклинами плохо всасываются.
3. моторика ЖКТ
Замедляют перистальтику: некоторые антидепрессанты, противогистаминные ЛС, фенотиаз иновые антипсихотические, наркотические ЛС, повышают абсорбцию дигоксина, кортикостероидов, антикоагулянтов, снижают всасывание леводопы.
Усиливают перистальтику и увеличивают эвакуацию из ЖКТ: метоклопрамид, слабительные.
Снижают всасывание ЛС: фенобарбитал – гризеофульвина, аспирин – индометацина и диклофенака, ПАСК – рифампицина.
Способы контроля всасывания при парентеральном введении: местные анестетики + адреналин + фенилэфрин – снижается всасывание местных анестетиков
4.кишечная флора
5.изменение механизма в сасывания
2)при распределении и депонировании:
1.прямое взаимодействие в плазме крови: гентамицин + ампициллин или карбенициллин – снижают
активность гентамицина
2. конкурентное вытеснение из связи с альбуминами в плазме крови: индометацин, дигитоксин, варфарин связаны с белками крови на 90-98%, следовательно, повышение свободной фракции ЛС в два раза – резкое возрастание токсических эффектов; НПВС вытесняют: варфарин, фенитоин, метотрексат.
Детерминаты, определяющие клиническое значение такого взаимодействия:
величина Vd (большая – нет проблем, малая - возможны)
влияние одного ЛС вещества на активность механизмов транспорта через механизмы других ЛС:
дозозависимо повышается транспорт ЛС – инсулин, АКТГ, а нгиотензин, кинины и др.; инсулин повышает концентрацию изониазида толь ко в легких, а концентрацию хлопромазина – только в ГМК.
3.вытеснение из связи с белками ткани: хинидин вытесняет дигоксин + снижает экскрецию почками, поэтому повышается риск токсичности дигоксина
3) в процессе метаболизма
ЛС могут повышать или снижать активность цитохрома Р450 и его ферментов {этанол повышает активность определенных изоферментов цитохрома}
Ингибиторы ферментов, часто вступающих во взаимодействие: 1. АБ: ципрофлоксацин, эритромицин, изониазид, метронидазол
19

2.Сердечно-сосудистые препараты: амиодарон, дилтиазем, хинидин, верапамил
3.Антидепрессанты: флуоксетин, сертрален
4.Антисекреторные препараты: циметидин, омепразол
5.Антиревматические препараты: аллопуринол
6.Фунгициды: флуконазол, интраканазол, кетоконазол, миконазол
7.Противовирусные: индинавир, ретонавир, саквинавир
8.Другие: дисульфирам, вальпроат натрия
Препараты, дающие токсические эффекты при ингибировании МАО: адреномиметики, симпатомиметики, антипаркинсонические, наркотические анальгетики, фенотиазины, седативные, антигипертензивные диуретики, гипогликемические ЛС
4) в процессе выведения - более 90% ЛС экскретируются с мочой. Влияние на рН мочи и на степень ионизации ЛС, на их липофиль ность и их реабсорбцию
1. взаимодействие во время пассивной диффузии: часть ЛС экскретируется в неизменном виде, часть ЛС ионизируется при рН мочи 4,6-8,2. Ощелачивание мочи клинически важно: отравления ацетилсалициловой кислотой или фенобарбиталом, при приеме сульфаниламидов (снижение риска кристаллурии), приеме хинидина. Повышение кислотности мочи: повышается экскреция амфетамина (имеет практическое значение для выявления этого ЛС у спортсменов)
2. взаимодействие в период активного транспорта: пробенезид + пенициллин повышает продолжительность движения пенициллина, пробенецид + салицилаты – устранение урикозурического действия пробенецида, пенициллин + СА – снижение экскреции пенициллина Влияние состава мочи на экскрецию ЛВ:
Увеличение сахара в моче – увеличение экскреции: витамина С, хлорамфеникола, морфина, изониазида, глутатиона и их метаболитов.
40.Фармакодинамическое взаимодействие лекарственных средств. Антагонизм, синергизм, их виды. Характер изменения эффекта лекарств (активности, эффективности) в зависимости от типа антагонизма.
Фармакодинамическое взаим одействие – это взаимодействие ЛС, связанное с изменением фармакодинамики одного из них под влиянием другого {под влиянием тиреоидных гормонов усиливается синтез -адренорецепторов в миокарде и усиливается влияние адреналина на ми окард}.
Примеры клинически значимых нежелательных синергичных взаимодействий:
НПВС + варварин – увеличение риска кровотечения алкоголь + бензодиазепины – потенцирование седативного эффекта
ингибиторы АПФ + К+-сберегающие диуретики – увеличение риска гиперкалиемии верапамил + -Адреноблокаторы – брадикардия и асистолия
Алкоголь является силь ным индуктором микросомальных ферментов, приводит к развитию толерантности к ЛС (особенно к наркозным и снотворным средствам), увеличивает риск развития лекарстве нной зависимости.
При взаимодействии ЛС возмож но развитие следующих состояний: а) усиление эффектов комбинации ЛС б) ослабление эффектов комбинации ЛС в) лекарственная несовместимость Усиление эффектов комбинации ЛС реализуется в трех вариантах:
1) суммирование эффектов или аддитивное взаимодействие – вид лекарственного взаимодействия при котором эффект комбинации равен простой сумме эффектов каждого из ЛС в отдельности. Т.е. 1+1=2. Характерен для ЛС из одной фармакологической группы, которые имеют общую мишень действия {кислотонейтрализующая активность комбинации гидроокиси алюминия и магния равна сумме их кислотонейтрализующих способностей в отдель ности}
2)синергизм – вид взаимодействия, при котором эффект комбинации превышает сумму э ффектов каждого из веществ взятых по отдельности. Т.е. 1+1=3. Синергизм может касаться как желаемых (терапевтических), так и нежелатель ных эффектов лекарств. Сочетанное введение тиазидного диурет ика дихлотиазида и ингибитора АПФ эналаприла приводит к усилению гипотензивного действия каждого из средств, что применяется при лечении АГ. Однако одновременное назначение аминогликозидных антибиотиков (гентамицина) и петлевого диуретика фуросемида вызывает резкое возрастание риска ототоксического действия и развития глухоты.
3)потенцирование – вид лекарственного взаимодействия, при котором одно из ЛС, которое само по себе не оказывает данного эффекта, может приводить к резкому усилению действия другого лекарственного средства. Т.е.
1+0=3 {клавулановая кислота не обладает противомикробным действием, но способна ус иливать эффект - лактамного антибиотика амоксициллина за счет того, что она блокирует -лактамазу; адреналин не оказывает местноанестезирующего действия, но при добавлении к раствору ультракаина он резко удлиняет его анестезирующий эффект за счет замедления всасывания анестетика из места инъекции}.
Ослабление эффектов ЛС при их совместном применении называют антагонизмом:
1) химический антагонизм или антидотизм – химическое взаимодействие веществ между собой с образованием неактивных продуктов {химический антагонист ионов железа дефероксамин, который связывает их в неактивные комплексы; протамина сульфат, молекула которого имеет избыточный положительный заряд - химический антагонист гепарина, молекула которого имеет избыточный отрицательный заряд}. Химический антагонизм лежит в основе действия антидотов (противоядий).
20
