
- •Основы электрохимии и электрохимических технологий
- •Введение
- •Окислительно-восстановительные реакции.
- •Правила уравнивания окислительно-восстановительных реакций.
- •Порядок уравнивания окислительно-восстановительных реакций, т.Е. Приведение их в форму, обеспечивающую закон сохранения энергии (баланс массы и заряда).
- •Демонстрация переноса электронов в окислительно-восстановительных реакциях. Гальванический элемент.
- •Лекция 2. Законы Фарадея и скорость электрохимического процесса Выход по току. Применение закона Фарадея к расчету скорости обработки металлов.
- •Скорость электрохимической обработки
- •Электрохимический эквивалент сплава и практический электрохимический эквивалент.
- •Лекция 3. Равновесный потенциал электрода Электрод, ячейка. Напряжение электрода и ячейки. Равновесный потенциал. Виды равновесных потенциалов.
- •Равновесный потенциал.
- •Виды равновесных потенциалов.
- •Лекция 4. Основы теории электролитической диссоциации Равновесные явления в растворах электролитов. Теория электролитической диссоциации. Ион - дипольное и ион - ионное взаимодействие в электролитах.
- •Теория Дюбая – Гюккеля и ион - ионное взаимодействие в растворах электролитов.
- •Гидролиз солей.
- •Буферные растворы.
- •Ионные равновесия при растворении. Произведение растворимости.
- •Лекция 6 Электропроводность электролитов
- •Экспериментальное определение электропроводности.
- •Особые случаи электропроводности электролитов.
- •Электроды первого рода. Потенциал ионно-металлического электрода.
- •Электроды второго рода.
- •Хлорсеребряный электрод.
- •Окислительно – восстановительные (redox) системы.
- •Водородный электрод.
- •Хингидронный электрод.
- •Мембранный потенциал или потенциал Донана.
- •Методы изучения двойного электрического слоя.
- •Модельные представления о строении двойного электрического слоя.
- •Форма поляризационной кривой при наличии стадии массопереноса.
- •Лекция 11 Теория замедленного разряда.
- •Свойства уравнения теории замедленного разряда.
- •Лекция 12 Поляризация (перенапряжение) при образовании новой фазы. Перенапряжение при лимитирующей стадии образования двумерных и трёхмерных зародышей.
- •Перенапряжение поверхностной диффузии при электроосаждении металлов.
- •Перенапряжение образования пузырьков газа и связь размеров пузырьков с потенциалом.
- •Предельные токи при электроосаждении. Эффект м.А.Лошкарёва.
- •Электрические процессы в условиях медленной гомогенной химической реакции.
- •Критерии определения природы лимитирующейстадии.
- •Лекция 14 Примеры механизмов некоторых электрохимических реакций.
- •Примеры механизмов различных электрохимических реакций. Реакция выделения водорода (водородный электрод).
- •Кинетическая теория коррозии.
- •Коррозия при кислородной деполяризации.
- •Роль локальных элементов в возникновении коррозии и достижении её скорости.
- •Методы защиты от коррозии.
- •Пассивность металлов.
- •Электрохимическая размерная обработка металлов и сплавов
- •Основы прикладной электрохимии и электрохимических технологий Лекция 1 Основные особенности электрохимических технологий.
- •Конструктивные принципы электрохимических реакторов
- •Межэлектродный зазор
- •Токовые нагрузки
- •Сепараторы
- •Подвод и отвод компонентов реакции
- •Корректировка состава электролита
- •Масштабный фактор
- •Подбор коррозионностойких материалов
- •Экономические показатели
- •Классификация основных процессов переноса при химической и электрохимической технологии
- •Лекция 2. Распределение тока и рассеивающая способность электролитов Распределение тока. Виды распределения тока. Параметр Вагнера. Рассеивающая (локализующая) способность электролитов
- •Первичное распределение тока.
- •Вторичное распределение тока.
- •Третичное распределение тока.
- •Распределение тока при высоких плотностях тока (при наличии поверхностного тепловыделения)
- •Распределение скоростей осаждения или растворения при наличии зависимости выхода по току от плотности тока
- •Методы расчёта распределения тока.
- •Методы экспериментального определения рассеивающей (локализующей) способности электролита
- •Лекция 3. Химические источники тока (хит). Основные характеристики хит
- •Лекция 4 Первичные хит (хит первого рода, элементы)
- •Сухие марганцево-цинковые (мц) элементы
- •Первичные хит с магниевыми и литиевыми анодами
- •Первичные хит с литиевыми анодами
- •Хит с твердым электролитом
- •Лекция 5 Вторичные хит (аккумуляторы).
- •Свинцовые кислотные аккумуляторы
- •Основные неисправности свинцовых кислотных аккумуляторов.
- •Щелочные аккумуляторы
- •Лекция 6 Топливные элементы.
- •Лекция 7. Электролиз водных растворов без выделения металлов Производство водорода и кислорода
- •Производство тяжелой воды
- •Интенсификация электрохимических методов получения водорода
- •Лекция 8. Электрохимическое производство хлора, щелочи и гипохлотрта натрия
- •Теоретические основы электролиза растворов хлоридов
- •Электролиз с твердым катодом и фильтрующей диафрагмой
- •Электролиз с ртутным катодом.
- •Перспективы развития хлорной промышленности
- •Электросинтез гипохлорита натрия
- •Лекция 9 Электрохимические покрытия металлами и сплавами. Теоретические основы.
- •Два метода нанесения покрытий при электролизе
- •Назначение металлических покрытий металлами и сплавами
- •Управление свойствами и размерами покрытий
- •Использование нестационарного электролиза
- •Лекция 10 Электролитическое осаждение железа.
- •Катодный процесс при электроосаждении железа.
- •Электролиты железнения и режимы электролиза
- •Анодный процесс.
- •Лекция 11. Хромирование. Свойства и области применения хромовых покрытий
- •Некоторые особенности процесса хромирования
- •Электролиты и режимы электролиза.
- •Физико-механические свойства хромовых покрытий
- •Лекция 12. Меднение Область применения
- •Сравнительная характеристика медных электролитов.
- •Борфтористоводородные электролиты
- •Цианистые электролиты
- •Пирофосфатные электролиты
- •Лекция 13. Анодная и химическая обработка металлов Оксидирование
- •Электрохимическое и химическое полирование
- •Лекция 14. Электролиз расплавов. Общие сведения.
- •Строение расплавленных солей
- •Электропроводность расплавленных солей
- •Выход по току и удельный расход энергии при электролизе расплавов
- •Влияние физико-химических свойств электролита на процесс электролиза
- •Некоторые специфические явления при электролизе расплавов
- •Лекция 15. Производство алюминия
- •Переработка алюминиевых руд
- •Получение криолита
- •Электроды и другие материалы
- •Электролиз криолит-глиноземного расплава
- •Состав электролита
- •Конструкция и эксплуатация электролизеров
- •Рафинирование алюминия
- •Электролиз хлорида алюминия
- •Лекция 16. Гидроэлектрометаллургия
- •Лекция 17. Электролиз в металлургии благородных металлов
- •Вопросы для самопроверки, задачи и упражнения
- •Заключение Основные направления современного этапа развития электрохимии и электрохимических технологий
- •Литература
Лекция 14 Примеры механизмов некоторых электрохимических реакций.
Известно (см. лекцию 11), что как правило,
величина коэффициента переноса ~ 0,5 при обычных широко используемых
значениях электродных потенциалов.
Однако, как было показано Л.И.Кришталиком,
возможно и другое поведение коэффициента
переноса, который будет в этом случае
зависеть от электродного потенциала и
принимать значения![]() .
Случай, когда
.
Случай, когда![]() ,
называется безбарьерным разрядом.
,
называется безбарьерным разрядом.
Как следует из уравнения (11.12) при
![]() ,
должна отсутствовать зависимость
скорости процесса от потенциала для
прямого процесса, очевидно, что для
обратного процесса она должна быть
максимальной (безбарьерный процесс,
,
должна отсутствовать зависимость
скорости процесса от потенциала для
прямого процесса, очевидно, что для
обратного процесса она должна быть
максимальной (безбарьерный процесс,![]() ).
).
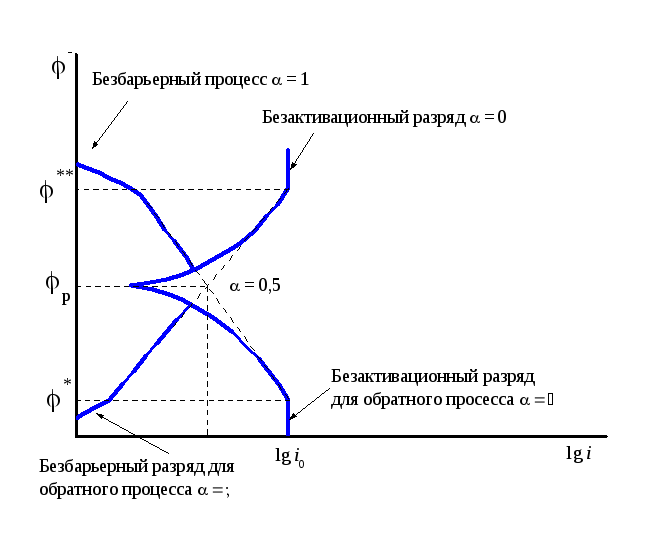
Рис. 14.1 Зависимость
![]() от потенциала в широком интервале
потенциалов (обычный, безбарьерный и
безактивационный разряд).
от потенциала в широком интервале
потенциалов (обычный, безбарьерный и
безактивационный разряд).
Зависимость
![]() от потенциала была обнаружена
экспериментально, однако наличие
безактивационного разряда, т.е. предельных
токов собственно электрохимического
процесса зафиксировать не удалось,
поскольку они наблюдаются при очень
высоких плотностях тока. Так, например,
для реакции выделения водорода на ртути,
он должен наблюдаться при плотности
тока ~ 105А/см2.
от потенциала была обнаружена
экспериментально, однако наличие
безактивационного разряда, т.е. предельных
токов собственно электрохимического
процесса зафиксировать не удалось,
поскольку они наблюдаются при очень
высоких плотностях тока. Так, например,
для реакции выделения водорода на ртути,
он должен наблюдаться при плотности
тока ~ 105А/см2.
При потенциалах *и**(см.
рис. 14.1) должны изменяться наклоны
поляризационных кривых вследствие
перехода от обычного разряда к
безбарьерному. В отличие от обычного
процесса, для которого наклон определяется
соотношением![]() ,
для безбарьерного он будет меньше этой
величины (рис. 14.1). Поскольку безбарьерный
процесс наблюдается при очень низких
плотностях тока, а безактивационный (= 0) при очень высоких экспериментально
их зафиксировать, как правило, нелегко.
,
для безбарьерного он будет меньше этой
величины (рис. 14.1). Поскольку безбарьерный
процесс наблюдается при очень низких
плотностях тока, а безактивационный (= 0) при очень высоких экспериментально
их зафиксировать, как правило, нелегко.
При этих же потенциалах должен наблюдаться переход к безактивационному процессу (предельному катодному или анодному току, не связанному с диффузионными ограниченииями, а обусловленному переходом к процессам с = 0). Однако использование косвенных методов показывает, что в ионных системах без энергии активации протекают, например, многие реакции нейтрализации.
Примеры механизмов различных электрохимических реакций. Реакция выделения водорода (водородный электрод).
Таблица 14.1.
Токи обмена для разряда ионов H+на различных электродах в водных растворахHClилиH2SO4
|
Электрод |
|
Электрод |
|
|
Hg In Zn Bi Ga (ж) |
710-13 810-12 510-11 110-10 310-10 |
Ag Cu Au Fe Pt |
110-8 1,510-7 310-7 310-6
|
Реакция катодного выделения водорода является многостадийной и механизм её протекания различный на различных электродах. Для нее могут наблюдаться следующие механизмы:
электрохимическая десорбция (реакция Я.Гейровского) наблюдается на ртути, индии, таллии, висмуте, кадмии и др.
![]() (14.а)
(14.а)
![]() (14.б)
(14.б)
В щелочных растворах реакция (14.б) может протекать с участием молекул воды.
![]() (14.в)
(14.в)
Как следует из механизма (14.а) и (14.в) медленной является электрохимическая стадия получения адсорбированного водорода, стадии (14.б) и (14.в) равновесные. Как видно из данных сопоставления с плотностями тока обмена, механизм Априводит в основном к существенной необратимости реакции выделения водорода (низкие плотности тока обмена).
(вольфрам, молибден, ниобий, тантал).
![]() (14.г)
(14.г)
![]() (14.д)
(14.д)
то есть замедленной является последующая электрохимическая стадия.
удаление адсорбированного водорода может происходить путём рекомбинации при медленной стадии разряда.
![]() (14.е)
(14.е)
![]() (14.ж)
(14.ж)
замедленной является гетерогенная химическая стадия рекомбинации адсорбированного водорода (анодно активированные металлы платиновой группы).
![]() (14.з)
(14.з)
![]() (14.и)
(14.и)
Растворение железа в щелочных растворах (Б.Н.Кабанов, Д.И.Лейкис, Р.Х. Бурштэйн, А.М.Фрумкин).
![]() (14.к)
(14.к)
![]() (14.л)
(14.л)
![]() (14.м)
(14.м)
![]() (14.н)
(14.н)
Очевидно, что в рассмотренной последовательности реакций замедленной является стадия переноса второго электрона с образованием адсорбционного оксида железа (14.л). А стадия последней химической реакции является быстрой.
Лекция 15 Анодное растворение и электрохимическая коррозия металлов.
Основные положения кинетической теории коррозии. Коррозия технических металлов и методы защиты от коррозии. Пассивность металлов. Основы электрохимической размерной обработки металлов.
В тех случаях, когда металл является анодом, возможно протекание нескольких типов реакций:
1. анодное растворение металла:
![]() ; (15.а)
; (15.а)
2. окисление компонентов воды (растворителя) с выделением кислорода; при этом металл не растворяется, например:
![]() ; (15.б)
; (15.б)
окисление компонентов раствора, например хлорид-иона:
![]() . (15.в)
. (15.в)
Во всех трёх случаях на аноде происходит окисление, но в случае 1 (15.а) компоненты металла переходят в раствор, то есть осуществляется анодное растворение, а в случае 2 и 3 имеет место окисление компонентов раствора без изменения состояния твёрдой фазы. Реакция (15.а) может протекать с участием воды с образованием оксида:
![]() . (15.г)
. (15.г)
В этом случае на поверхности металла образуется нерастворимая оксидная плёнка. Иными словами металл может быть растворимым анодом, а может быть нерастворимым в зависимости от электрохимических условий и состава раствора, то есть, изменяя состав раствора и электрохимические условия, можно управлять этим процессом. В некоторых случаях целесообразно достигать условий, при которых анод нерастворим, в других же, например, при травлении металлов и полупроводников или электрохимической размерной обработке (ЭХРО), необходимо создание условий для растворения анода.
Очень интересен случай, когда для одного и того же металла, в одних и тех же электролитах при определённых условиях металл не растворяется, а при других происходит его интенсивное анодное растворение. Иными словами, в электрохимических системах процессом растворения анода или его пассивацией можно управлять.
Очень важным процессом, широко распространённым в природе явлением, является процесс взаимодействия металла с компонентами окружающей среды. Этот процесс приводит к самопроизвольному разрушению металла, которое называется коррозией. Коррозия в общем случае является электрохимическим процессом, а, следовательно, методы борьбы с коррозией должны быть, в том числе и электрохимическими.
Первой теорией коррозии была теория, разработанная известным итальянским физиком Де ла Ривом. Согласно этой теории определяющую роль в процессе коррозии металла играют примеси, поскольку было замечено, что технические металлы, содержащие большое количество примесей, существенно в большей степени подвергаются коррозии, чем абсолютно чистый металл.
В дальнейшем мы рассмотрим роль легирующих компонентов и примесей в процессе коррозии и покажем, что при их наличии коррозия действительно усиливается, но наличие примесей не является основной причиной и движущей силой коррозии. В настоящее время общепринятой является кинетическая теория коррозии, объясняющая коррозионные процессы кинетическими закономерностями растворения металлов (окисления) и восстановления компонентов растворителя (окислителя).
