
- •Закон мозлі
- •9 Квантово-механічна модель атома корпускулярно-хвильовий дуалізм
- •Принцип невизначеності
- •Хвильове рівняння шредінгера
- •Хвильові функції та електронні орбіталі
- •Характеристика стану електрона за квантовими числами
- •Атомні ядра склад і будова атомних ядер
- •Властивості взаємодіючих атомів
- •Валентність
- •Метод валентних зв'язків умови утворення ковалентного зв'язку
- •Водневий зв'язок природа й енергія водневого зв'язку
- •Міжчастинкові взаємодії доказ існування міжчастинкових сил
- •Вандерваальсова взаємодія молекул
- •Іонно-молекулярна взаємодія
- •Будова твердого тіла загальна характеристика твердого стану речовини
- •Будова ідеальних кристалів 7.2.1. Основні положення
- •Кристалічна гратка
- •Типи кристалічних ґраток
- •Будова іонних кристалів основні типи кристалічних ґраток іонних сполук
- •Металічний стан і його особливості кристалічна структура металів
- •Хімічний зв'язок у металах
Будова іонних кристалів основні типи кристалічних ґраток іонних сполук
Структура іонних кристалів підпорядкована правилу Гольдш-мідта (див. 7.2.1) та закономірностям найщільніших упаковок (див. 7.2.4). За Гольдшмідтом структура кристала визначається кількістю його структурних одиниць, їх відносними розмірами та поляризаційними властивостями.
Стійкою буде така структура, яка забезпечує максимальну кількість контактів між іонами протилежного заряду і перешкоджає відштовхуванню іонів з однаковими зарядами. Кількість таких контактів визначає КЧ центрального іона. Знаючи співвідношення іонних радіусів, можна приблизно передбачити КЧ.
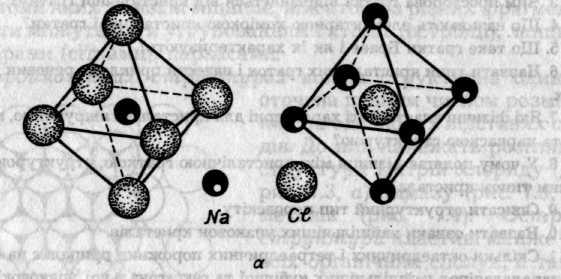
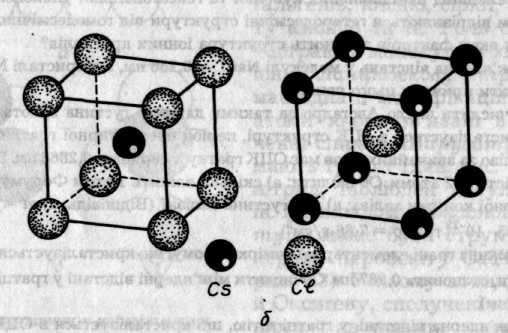
Рис. 7.8. Взаємна координація іонів у кристалах: а — NaCl; б — CsCl
У структурі Натрій хлориду аніони Хлору (га = 0,181 нм) утворють ГЦК найщільнішу упаковку. Катіони Натрію (гк = 0,098 нм) заповнюють октаедричні порожнини. Відношення rk : ra = 0,54, тому структурі відповідає координація 6:6. Елементарна комірка містить чотири іони Натрію й чотири іони Хлору, тобто чотири формульні одиниці NaCl (рис. 7.8,а).
У Цезій хлориді катіон Цезію (гк = 0,168 нм) більший за катіон Натрію і його може оточувати більше число іонів Хлору. Відношення гк : гa = 0,93, тому реалізується координація 8:8. Іони Цезію та іони Хлору утворюють примітивні кубічні ґратки, які ніби вставлені одна в одну, тому в центрі кожного куба з хлорид-іонів міститься іон Цезію, і навпаки (рис. 7.8,6).
У структурі сфалериту ZnS іони одного з елементів займають вузли ГЦК ґратки, а іони іншого елемента — половину тетраедричних порожнин. Відношення гк : га = 0,34, тому кожний іон Цинку оточений чотирма іонами Сульфуру, і навпаки.
Металічний стан і його особливості кристалічна структура металів
Більшість металів кристалізується в одному з трьох типів кристалічної ґратки (див. рис. 7.4): щільна гексагональна (Mg, Be, Zn), щільна кубічна гранецентрована (Al, Cu, Ag, Au, Ni), кубічна об'ємноцентрована (лужні метали, Cr, V, Pb, W та ін.). У перших двох ґратках кожний атом на однаковій відстані оточений 12 іншими атомами. Таке розміщення відповідає най-щільнішому заповненню простору однаковими сферами. ОЦК грат-ка більш пориста. Кожний атом має вісім рівновіддалених сусідів і шість більш віддалених, тому можна вважати, що КЧ центрального атома дорівнює 14. Між кулями найщільнішої упаковки містяться октаедричні та тетраедричні порожнини, наявність яких пояснює деякі властивості металів та їхніх сполук.
Багатьом металам, особливо перехідним, властивий поліморфізм.
У кристалічних ґратках металів можуть бути як точкові, так і лінійні дефекти, які впливають на їхні фізико-хімічні властивості.
Хімічний зв'язок у металах
Наявність вільних електронів визначає всю сукупність властивостей речовин у металічному стані: високу електро- і теплопровідність; позитивний температурний коефіцієнт електроопору, здатність добре відбивати світлові хвилі (що зумовлює їхній характерний блиск і непрозорість), високу пластичність (ковкість), термоелектронну емісію, явище фотоефекту, магнітні властивості та ін.
На відміну від ковалентних і іонних сполук у металах невелике число електронів одночасно зв'язує велике число атомних ядер. Узагальненням валентних електронів металічний зв'язок дещо нагадує ковалентний. Проте у металів узагальнені електрони не належать окремим парам атомів, вони повністю делокалізовані. Цим пояснюється відсутність просторової напрямленості та насичуваності металічного зв'язку. Делокалізація валентних електронів є наслідком багатоцентрового характеру металічного зв'язку й причиною високої електро- та теплопровідності металів.
Отже, металічний зв'язок є багатоцентровим хімічним зв'язком з дефіцитом електронів і базується на узагальненні зовнішніх електронів атомів. Тому він характерний лише для конденсованого стану речовини. У газуватому стані атоми всіх речовин, у тому числі й металів, зв'язані між собою тільки ковалентним зв'язком.
Для характеристики енергії зв'язку в металічній гратці користуються поняттям енергії, атомізацгі. Порівняно невеликими енергіями атомізації характеризуються s- і р-метали, для яких зверху вниз по періодичній системі енергії атомізації закономірно зменшуються (наприклад для калію, рубідію і цезію вони становлять відповідно 94,5; 82,0; 78,0 кДж/моль). ДлясІ-металів зв'язки значно міцніші й зі збільшенням атомної маси зростають. Наприклад, для міді, срібла й золота енергії атомізації дорівнюють 339,0; 286,1 і 354,0 кДж/моль. Це пояснюється тим, що металічний зв'язок не виключає деякої частки ковалентності. При переході від лужних до перехідних металів частка ковалентного зв'язку між атомами зростає за рахунок d-електронів.
Електрони провідності в кристалі сполучені міцніше, ніж валентні електрони у молекулі з двох атомів, хоча їх зв'язуюча сила розподілена між великою кількістю атомів. Наприклад, енергія атомізації кристалічного літію дорівнює 163,2 кДж/моль при довжині зв'язку 0,3 нм, а енергія зв'язку в молекулі Li2 становить 108,8 кДж/моль. Отже, в розрахунку на моль атомів енергія зв'язку в кристалі зростає втричі. Довжина зв'язку в кристалі Li (0,3 нм) більша, ніж у молекулі Li2 (0,267 нм).
За надвисоких тисків металічні властивості характерні для багатьох неметалів. Зокрема, сірка стає добрим провідником електричного струму при 4*1010 Па. Цікавою є поведінка металів при низьких температурах. Послідовно збільшуючись зі зниженням температури, електропровідність деяких металів раптово зростає практично до нескінченності. Це явище, відкрите в 1911 р. голландським фізиком Камерлінг-Оннесом, має назву надпровідності. Воно поширюється і на деякі металіди (речовини, що характеризуються переважно металічним типом зв'язку). Найвища температура переходу в надпровідний стан (~100 К) у складних оксидів типу YBa2Cu3O7 (Беднорц, Мюллер, 1986).
