
- •Закон мозлі
- •9 Квантово-механічна модель атома корпускулярно-хвильовий дуалізм
- •Принцип невизначеності
- •Хвильове рівняння шредінгера
- •Хвильові функції та електронні орбіталі
- •Характеристика стану електрона за квантовими числами
- •Атомні ядра склад і будова атомних ядер
- •Властивості взаємодіючих атомів
- •Валентність
- •Метод валентних зв'язків умови утворення ковалентного зв'язку
- •Водневий зв'язок природа й енергія водневого зв'язку
- •Міжчастинкові взаємодії доказ існування міжчастинкових сил
- •Вандерваальсова взаємодія молекул
- •Іонно-молекулярна взаємодія
- •Будова твердого тіла загальна характеристика твердого стану речовини
- •Будова ідеальних кристалів 7.2.1. Основні положення
- •Кристалічна гратка
- •Типи кристалічних ґраток
- •Будова іонних кристалів основні типи кристалічних ґраток іонних сполук
- •Металічний стан і його особливості кристалічна структура металів
- •Хімічний зв'язок у металах
Хвильове рівняння шредінгера
Невизначеність місцеперебування та імпульсу електрона настільки велика, що доцільно взагалі відмовитися від аналізу траєкторії його руху. Проте можна використати ймовірнісний підхід.
У будь-якій теорії систему характеризують за допомогою рівняння стану, яке описує залежність між основними характеристиками — параметрами системи. Закони руху та енергетичного стану мікрочастинок вивчає хвильова (квантова) механіка, два варіанти якої запропонували незалежно один від одного Шредінгер (хвильова механіка) і Гейзенберг (матрична механіка).
Зручніше користуватися варіантом Шредінгера, в якому рух мікрочастинки описується хвильовим рівнянням, а її місцеперебування визначають за ймовірнісним принципом. Рівняння Шредінгера (1926) подібне до рівнянь Ньютона в класичній механіці. Його можна одержати на основі певної аналогії з рівняннями інших хвильових процесів — оптичних або акустичних.
Шредінгер стверджував, що стан рухливого електрона в атомній системі можна описати рівнянням стоячої електромагнітної хвилі. На відміну від механічних хвиль, які поширюються необмежено з постійною довжиною та спадною амплітудою, стоячі хвилі утворюються в обмежених коливних системах, не переміщаються в просторі й можуть мати тільки певні значення довжин, видуг і вузлів (рис. 5.8). Напрямок хвиль та їх знак змінюються при переході через вузол, де амплітуда дорівнює нулю. Оскільки атомна система тривимірна, то ввівши в рівняння одновимірної стоячої хвилі три координати й підставивши замість довжини хвилі її значення з рівняння де Бройля (5.19), Шредінгер одержав рівняння, яке пов'язує енергію електрона з просторовими координатами та хвильовою функцією, що відповідає амплітуді тривимірного хвильового процесу: \|/(х, у, z). Проте хвилі де Бройля не є матеріальними, тобто вони не пов'язані з переносом речовини або енергії, а є хвилями ймовірності. Хвилеподібно змінюється лише ймовірність перебування електрона.

Для електрона в атомі водню та подібних одноелектронних систем рівняння має вигляд
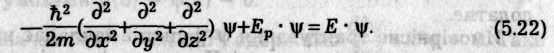
Це
диференціальне лінійне рівняння другого
порядку в частинних похідних, в якому
![]() —
стала Дірака; т
—
маса електрона; Ер
—
потенціальна енергія електрона в даній
точці; Е— повна енергія електрона; \|/ —
хвильова функція.
—
стала Дірака; т
—
маса електрона; Ер
—
потенціальна енергія електрона в даній
точці; Е— повна енергія електрона; \|/ —
хвильова функція.
Іноді
суму других похідних від \|/ по х,
у, z
позначають
як
![]() \|/
тобто
\|/
тобто
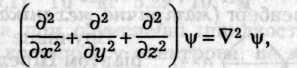
де
![]() —
оператор
Лапласа (лапласіан) —
символ операції подвійного
диференціювання по координатах. Тоді
рівняння набуває вигляду
—
оператор
Лапласа (лапласіан) —
символ операції подвійного
диференціювання по координатах. Тоді
рівняння набуває вигляду
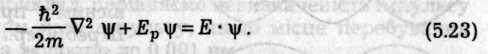
Якщо всі математичні діїлнад хвильовою функцією лівої частини рівняння позначити знаком Я, тоді воно матиме найбільш лаконічну форму
![]()
де![]() —
оператор повної енергії системи —оператор
Гамільтона (гамільтоніан); Е —
власне значення оператора
—
оператор повної енергії системи —оператор
Гамільтона (гамільтоніан); Е —
власне значення оператора
![]() ;
\|/ — власна функція оператора
;
\|/ — власна функція оператора![]() .
(Зауважимо, що вираз
.
(Зауважимо, що вираз![]() \|/
означає певну дію над \|/ , а не добуток
двох величин, як виразЕ
• \|/).
Якщо подіяти оператором енергії на
хвильову функцію, то одержимо цю функцію,
помножену на ті значення енергії, які
може мати система.
\|/
означає певну дію над \|/ , а не добуток
двох величин, як виразЕ
• \|/).
Якщо подіяти оператором енергії на
хвильову функцію, то одержимо цю функцію,
помножену на ті значення енергії, які
може мати система.
Рівняння Шредінгера описує стаціонарні стани системи, які не залежать від часу, а отже, не містить понять швидкості руху електрона чи траєкторії. Його називають координатним на відміну від часового рівняння, яке служить для опису процесів у часі. Розв'язати рівняння — означає знайти енергію електрона та значення хвильової функції, що відповідають його різним енергетичним станам.
Кожний з незліченної кількості дозволених розв'язків рівняння називають власною хвильовою функцією стану електрона в атомі— \|/-функцією. \|/-функція має обмежений фізичний зміст, проте добуток \|/2 • dv дорівнює ймовірності локалізації електрона в елементарному об'ємі dv атомного простору. Якщо поділити цю ймовірність на об'єм, то одержимо ймовірність перебування електрона в одиниці об'єму, або густину ймовірності \|/2. Хвильова функція може бути як додатною, так і від'ємною, але квадрат її модуля |\|/|2 (точніше \|/·\|/*), що має зміст імовірності, завжди число дійсне й додатне.
Ймовірнісне трактування \|/-функції накладає на неї ряд обмежень — вимог регулярності. Хвильова функція повинна бути:
1) скінченною, тобто не перетворюватись на нескінченність ні за яких значень аргументів;
2) однозначною, тобто в будь-якій точці мати лише одне значення;
3) неперервною, оскільки стан квантової системи в просторі змінюється неперервно;
4) граничною, тобто перетворюватись на нуль у нескінченності (асимптотично);
5)
нормованою,
тобто
підлягати залежності
![]() \|/2dv
=
1,
яка показує, що ймовірність перебування
електрона в усьому об'ємі атома дорівнює
одиниці. Перелічені обмеження
еквівалентні квантовим умовам
Бора.
\|/2dv
=
1,
яка показує, що ймовірність перебування
електрона в усьому об'ємі атома дорівнює
одиниці. Перелічені обмеження
еквівалентні квантовим умовам
Бора.

Розглянемо
рух електрона з зарядом — е у полі
ядра з зарядом +е.
Якщо
прийняти заряди за точкові, то
центрально-симетричне поле ядра буде
кулонівським з потенціальною
енергією Ер
=
-е2/4![]() - Підставивши її значення в рівняння
(5.23), отримаємо хвильове рівняння для
атома водню.
- Підставивши її значення в рівняння
(5.23), отримаємо хвильове рівняння для
атома водню.

Розв'язання цього рівняння пов'язане зі складними математичними викладками, однак основні його особливості зберігаються, якщо прийняти спрощену систему з аналогічними характеристиками. Для прикладу розглянемо одновимірний рух електрона в прямокутній потенціальній ямі завширшки а та з нескінченно високими стінками (рис. 5.9).
