
Московский Государственный Университет
Инженерной Экологии
Кафедра ОИЭ и ХТ
Группа Н-40
Студент
Дата работы
Лабораторная работа №3
Исследование процесса каталитического крекинга газойля
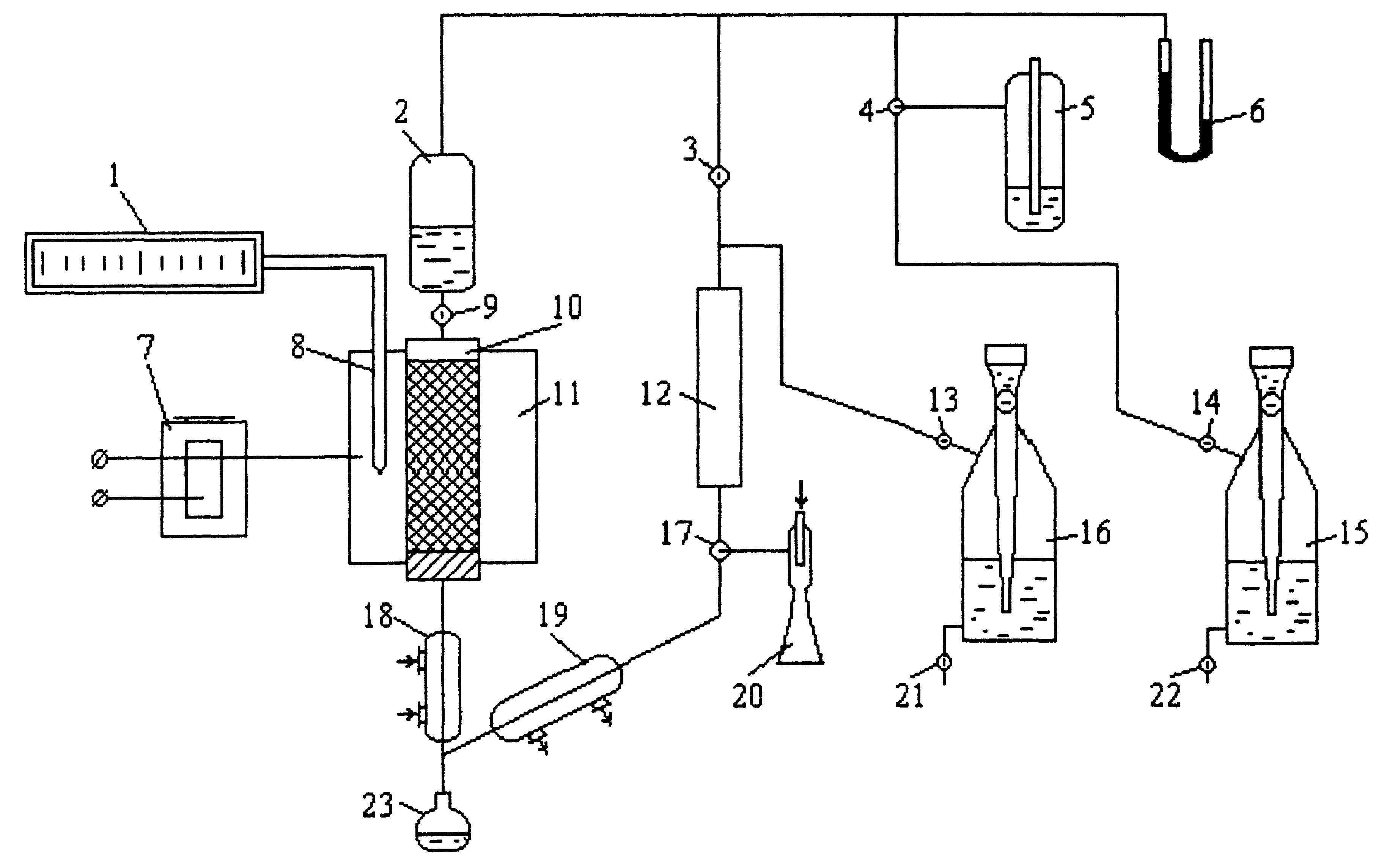
Таблица 3.4
Исходные данные и результаты исследования процесса каталитического крекинга

Таблица 3.5
Материальный баланс реактора каталитического крекинга
|
Приход |
Масса, г |
% мас. |
Расход |
Масса, г |
% мас. |
|
1. Газойль (mГ,0) |
|
100 |
1. Непрореагировавший газойль (mГ) |
|
|
|
|
|
|
2.Бензин в жидких продуктах (mБ') |
|
|
|
|
|
|
3. Газовый бензин (mБ'') |
|
|
|
|
|
|
4. Крекинг-газ* (mКГ) |
|
|
|
|
|
|
5. Кокс и потери (mК) |
|
|
* При расчете массы крекинг-газа используют его среднюю молекулярную массу, равную 30.
Цель работы- нахождение кинетических характеристик процесса и определение на их основе оптимальных технологических показателей процесса каталитического крекинга.
Теоретические основы
Природная нефть является ценным сырьем для получения различных видов нефтепродуктов: топлив, смазочных масел, растворителей, полупродуктов для процессов нефтехимического синтеза, полимеров и т.п.
При производстве ряда важнейших продуктов и для повышения их качества в нефтеперерабатывающей промышленности широко используют каталитические процессы переработки, один из которых - каталитический крекинг.
В данном процессе целевым продуктом является высокооктановый бензин (октановое число примерно 90). Кроме того, получают углеводородный газ, имеющий в своем составе смеси пропан-пропилена, бутан-бетиленов и пентан-амиленов, содержание изомерных соединений в котором достигает 25-40 %. Это делает газы каталитического крекинга ценным сырьем для нефтехимического синтеза. Продуктами крекинга являются также легкий и тяжелый газойль.
В качестве сырья каталитического крекинга используют керосиногазойлевые фракции, вакуумный газойль прямой гонки и др. Процесс каталитического крекинга проводят в паровой фазе при 720-800 К (450-530 °С) под давлением не выше 0,15 МПа в присутствии алюмосиликатного цеолитсодержащего катализатора. Кристаллические алюмосиликаты с добавками синтетических цеолитов (до 20 %) имеют высокую механическую прочность, устойчивы к истиранию, термостойки и обеспечивают достаточно высокий выход бензина (до 45-50 %).
В настоящее время в промышленности применяют, в основном, два типа установок каталитического крекинга:
с плотным слоем циркулирующего шарикового катализатора;
с псевдоожиженным слоем циркулирующего микросферического катализатора.
Особенностью каталитического крекинга является быстрая дезактивация катализатора (через 10-15 мин его работы) за счет отложения углеродистых остатков и превращения их в кокс. Поэтому катализатор необходимо часто регенерировать путем выжигания воздухом кокса с поверхности катализатора.
Основой процесса крекинга служат реакции расщепления углеводородов по связям С-С,процессы дегидрирования, гидрирования, деалкилирования, алкилирования, изомеризации, полимеризации.
Различные классы углеводородов по своей склонности к химическим превращениям при каталитическом крекинге располагаются в ряд: алкены > арены с большим числом боковых цепей > циклоалкены > алканы.
Такая последовательность объясняется избирательностью адсорбции различных углеводородов на поверхности катализатора. В первую очередь на катализаторе адсорбируются ненасыщенные, богатые энергией соединения: диалкены, алкены, арены. Наименьшей адсорбционной способностью обладают алканы и поэтому скорость их превращения на несколько порядков ниже, чем скорость превращения алкенов и аренов. Селективная адсорбция обуславливает последовательный ход процесса, при котором углеводороды, сильно сорбируемые катализатором, тормозят расщепление слабо сорбируемых углеводородов.
Алкены, помимо реакций расщепления, вступают в реакции полимеризации, изомеризации, циклизации. У аренов при каталитическом крекинге, в основном, отщепляются боковые цепи, при этом в продуктах крекинга накапливается бензол.
С6Н5- R = С6Н6+ R
Циклоалканы вступают в реакцию распада кольца с образованием алкенов, например,
С3Н9- СН3 = С6Н12
С3Н10= С2Н4+ С3Н6,
а также в реакции дегидрирования и деалкилирования, например,
С6Н11С3Н7= С6Н6 + С3Н8+ 2Н2
Алканы расщепляются на алканы меньшей молекулярной массы, например,
С12Н26= С6Н14+ С6Н12
Полученные углеводороды участвуют во вторичных реакциях изомеризации, циклизации, дегидрогенизации и алкилирования.
При крекинге газойля весь этот комплекс сложных параллельных и последовательных реакций в первом приближении (без учета вторичных взаимодействий) можно представить в виде двух последовательных реакций расщепления, каждая из которых является реакцией первого порядка
![]()
(3.9)
где Г- газойль (усредненная молекула углеводородов, входящих в состав газойля);Б- бензин (усредненная молекула углеводородов, входящих в состав бензина);КГ -крекинг-газ (усредненная молекула углеводородов, входящих в состав крекинг-газа);k1 -константа скорости реакции расщепления газойля;k2 -константа скорости реакции расщепления бензина.
Система линейных кинетических уравнений крекинга газойля по принятой упрощенной схеме имеет вид:
WrГ=k1CГ(3.10)
WrБ = -2k1СГ + k2CБ (3.11)
WrКГ = -k1CГ - З,7k2CБ (3.12)
Крекинг газойля в лабораторных условиях можно провести в обогреваемом электропечью трубчатом реакторе с неподвижным слоем алюмосиликатного катализатора. Такой реактор можно рассматривать как стационарный изотермический реактор, близкий к идеальному вытеснению, в основе математического описания которого лежит одно или несколько уравнений материального баланса по участникам реакции
![]()
(3.13)
где τ- время пребывания реагентов в реакторе;cj - молярная концентрация компонентаJ(газойля, бензина или крекинг-газа);WrJ(CJ)- кинетическое уравнение реакции по
компоненту J.
Д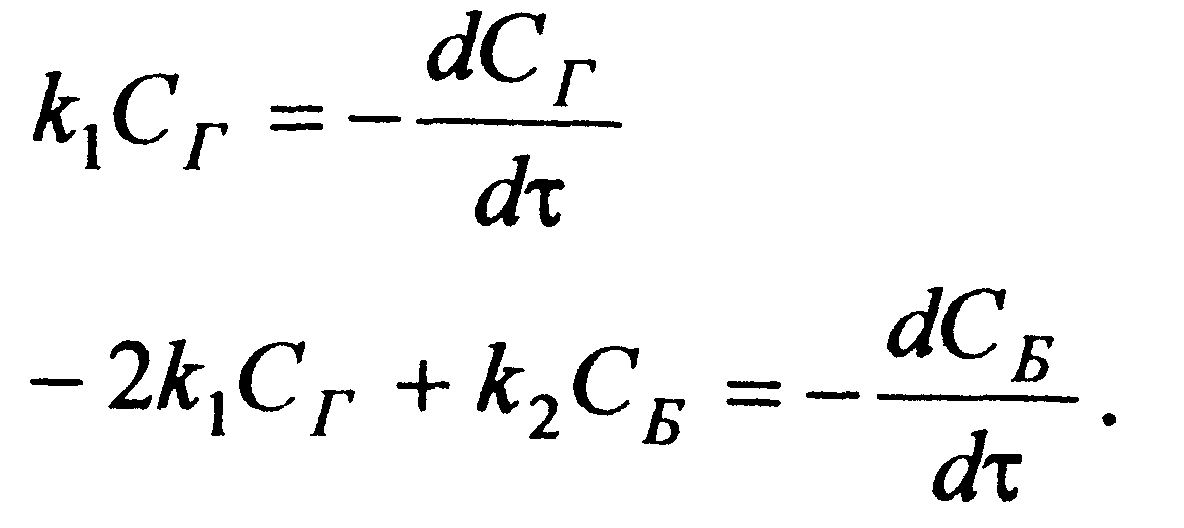 ля
математического описания приведенной
системы последовательных реакций (3.9),
протекающих в реакторе идеального
вытеснения, необходимо составить два
уравнения материального баланса
типа уравнений (3.13) по исходному реагенту
(газойлю) и промежуточному продукту
(бензину)
ля
математического описания приведенной
системы последовательных реакций (3.9),
протекающих в реакторе идеального
вытеснения, необходимо составить два
уравнения материального баланса
типа уравнений (3.13) по исходному реагенту
(газойлю) и промежуточному продукту
(бензину)
(3.14)
(3.15)
Эту систему дифференциальных уравнений можно решить при начальных условиях:
τ= 0;СГ=СГ,0;СБ= 0 (3.16)
Следует иметь в виду, что приведенная схема уравнений не учитывает изменения констант скоростей k1 и k2 в результате зауглероживания катализатора (в связи с чем падает его активность). Так как продолжительность лабораторного эксперимента относительно невелика, то этим явлением можно пренебречь.
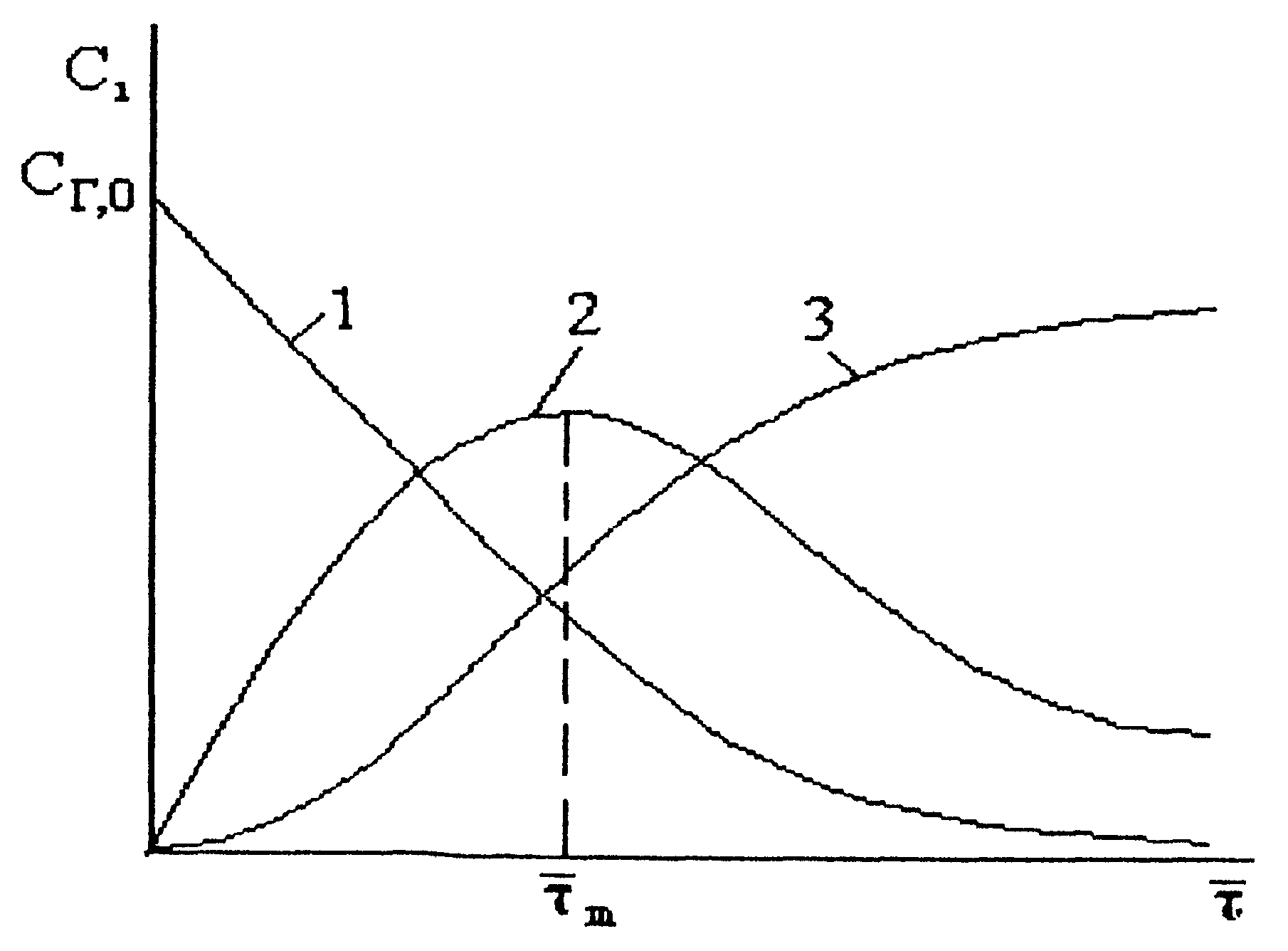
Рис. 3.4. Зависимость концентраций исходного реагента газойля (1), промежуточного продукта - бензина (2) и конечного продукта - крекинг-газа (3) от среднего времени пребывания в реакторе τ.
При решении уравнений (3.14) и (3.15) с начальными условиями (3.16) получаем зависимости концентраций газойля и бензина от среднего времени пребывания реагентов в реакторе
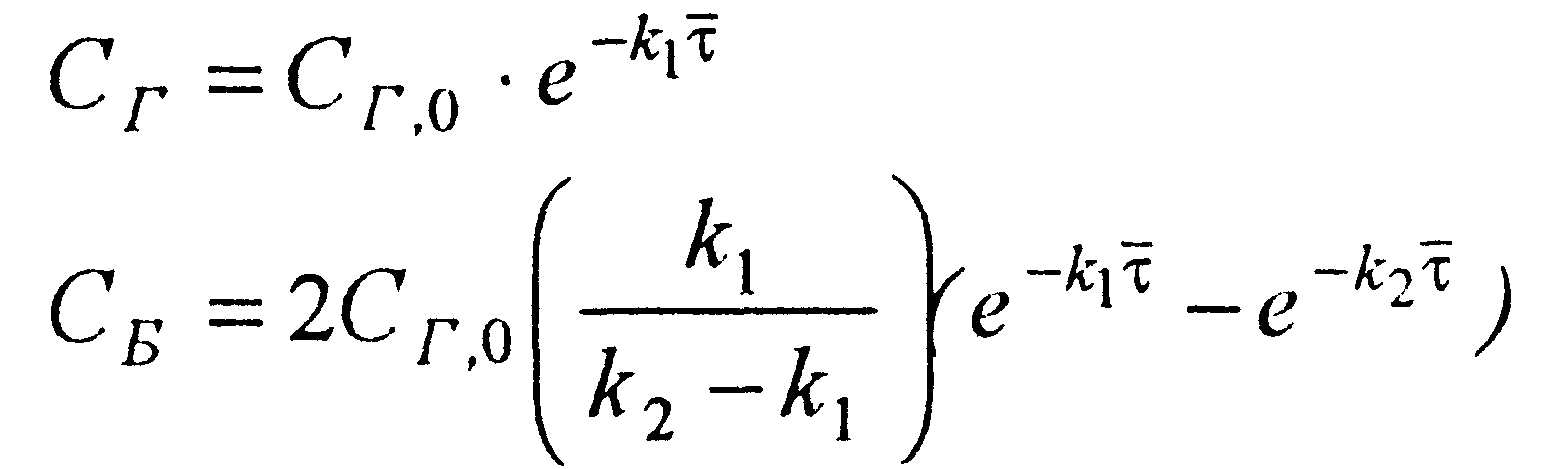
(3.17)
(3.18)
На рис. 3.4 представлены графики зависимостей СГ(τ),CБ(τ)иСКГ(τ). Из рисунка следует, что зависимость концентрации бензина от среднего времени пребывания в реактореτимеет максимум. Оптимальное среднее время пребыванияτm, отвечающее максимальной концентрации бензина, можно определить, приравняв нулю производнуюdCБ/dτ.При этом получим
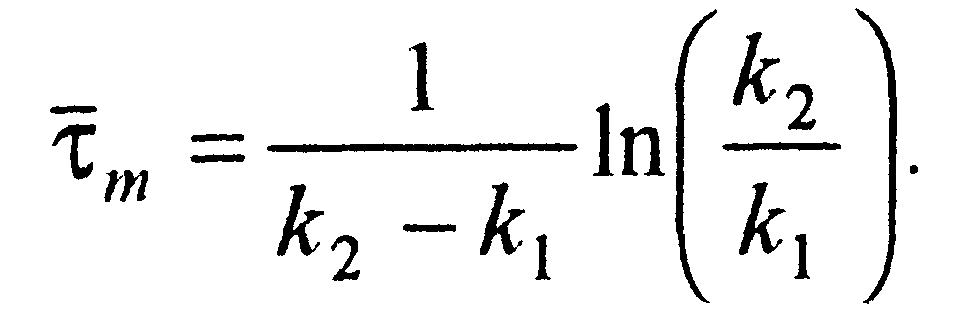
(3.19)
Концентрация бензина, соответствующая τm, будет максимальной
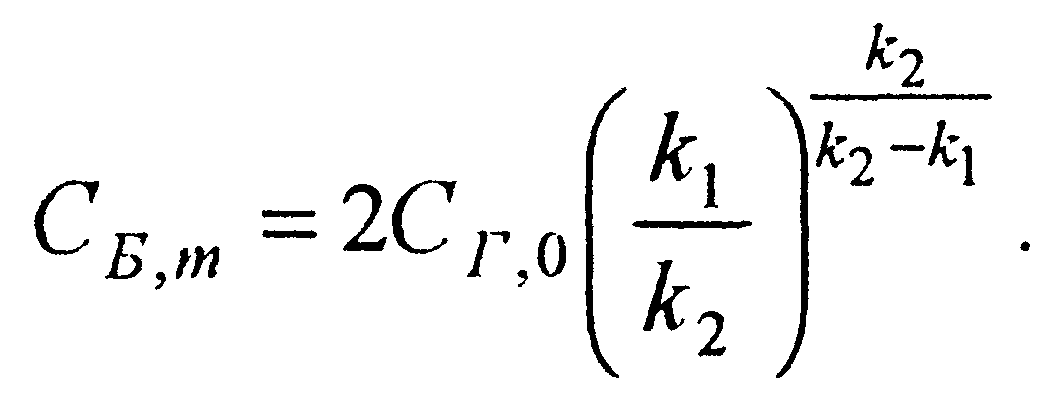
(3.20)
В случае, если бензин является целевым продуктом каталитического крекинга, то при организации промышленного производства следует стремиться к достижению высокого выхода этого продукта
![]()
(3.21)
где nБ, mБ и мб -соответственно число молей, масса и молекулярная масса бензина; nГ,0, тГ,0 и MГ –соответственно исходное количество молей, первоначальная масса и молекулярная масса газойля; ψ -нормировочный множитель, учитывающий стехиометрию реакции (для реакции крекинга газойля ψ = 2).
В соответствии с уравнениями (3.20) и (3.21) максимально возможный выход бензина может быть рассчитан по уравнению
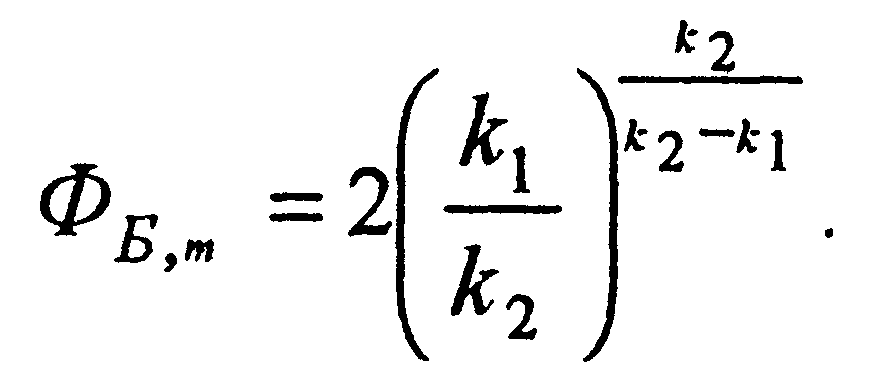
(3.22)
