
- •Теоретические основы энерго- и ресурсосбережения в химических технологиях.
- •Курс лекций.
- •Москва 2004.
- •Содержание
- •Введение.
- •Горячий воздух
- •Влажный воздух
- •Сухой воздух
- •Горячий кокс
- •Холодный кокс
- •II. Процессы преобразования энергии в сберегающих устройствах химических технологий.
- •Теоретические основы процессов тепломассопереноса в энерго- и ресурсосберегающих устройствах.
- •1. Теплопроводность
- •Тепловой поток через плоскую стенку.
- •2. Конвекция
- •Теплоотдачи в замкнутом объёме.
- •2.3. Теплопередача от основания теплообменника через оребренную поверхность.
- •2.4 Тепловой расчёт рекуператоров.
- •2.5. Аэродинамический (гидравлический) расчёт теплообменных устройств.
- •Излучение.
- •3.2. Лучистый теплообмен тел в прозрачной среде.
- •Лучистый теплообмен между двумя серыми телами, произвольно размещёнными в пространстве.
- •Формулы для расчётов коэффициентов облучённости и взаимных поверхностей для замкнутой системы двух излучающих тел.
- •Результативное излучение.
- •Действие экранов.
- •3.3. Лучистый теплообмен в поглощающей среде.
- •Серая среда.
- •Излучение газов.
- •- Тепловая мощность излучения
- •Поправка на парциальное давление водяных паров, при .
- •Поправка на взаимное перекрытие полос излучения углекислоты и водяных паров.
- •Приближённый метод расчёта .
- •Излучение запылённых потоков газа.
- •Теплообмен в топках котельных агрегатов.
- •3.4. Совместные действия излучения, конвекции и теплопроводности.
- •Механизм переноса тепла.
Московский Государственный Университет Инженерной Экологии
Кафедра « Э и РС»
Теоретические основы энерго- и ресурсосбережения в химических технологиях.
Курс лекций.
Москва 2004.
Содержание
Введение ………………………………………………………………………………....... 3
Схемы и принципы энерго- и ресурсосбережения в химических технологиях…..8
Энерготехнологические схемы химических производств…………........……….8
Схемы установок для получения ценных вторичных продуктов при огневой переработке отходов химических производств ...................................................21
Процессы преобразования энергии в сберегающих устройствах химических технологий ……………………………………………………………………..........37
Теоретические основы процессов тепломассопереноса в энерго- и ресурсосберегающих устройствах ………………………………………………....39
Теплопроводность ………………………………………………………………39
Конвекция……………………………………………………………….……….49
Естественная (свободная) конвекция………………………………….
Принудительная конвекция различных форм ………………………….
Теплоотдача при обтекании отдельных форм……………. …………….
Теплоотдача при течении теплоносителей в каналах…………..
Теплоотдача при обтекании сложных компактных поверхностей…….
Теплопередача от основания теплообменника через оребрённую поверхность…………………………………………………………………63
Тепловой расчёт теплообменных устройств……………………….…..…65
Гидравлический расчёт теплообменных устройств……………………...68
Излучение ……………………………………………………………………..
Основные законы теплового излучения
Лучистый теплообмен тел в прозрачной среде
Пример 3.1…………………….
Пример 3.2.
Пример 3.3.
Пример 3.4.
Результативное излучение
Пример 3.5…………………….
Пример 3.6…………………….
Действие экранов
Пример 3.7…………………….
Лучистый теплообмен в поглощающей среде………………………
Излучение газов
Пример 3.8…………………….
Пример 3.9…………………….
Пример 3.10…………………….
Излучение запылённых потоков газа……………………..
Пример 3.11…………………….
Теплообмен в топках котельных агрегатов
Пример 3.12…………………….
Пример 3.13…………………….
Совместное действие излучения, конвекции и теплопроводности…
Пример расчёта……………………………………..
Литература……………………………………………………………………………………
Введение.
Химическая технология связана с целевым превращением природных ресурсов в продукт потребления, при наличии химических превращений.
Химическая технология– это наука о наиболееэкономичных и экологически обоснованныхметодах химической переработки сырых природных материалов, предметов потребления и средств производства. Понятие химической технологии связано с разнообразием упомянутых методов. В химических технологиях главными направлениями прогресса являются:
Экономия топливно-энергетических и материальных ресурсов. Соответственно получило распространение понятие и предмет изучения «химическая энерготехнология»;
Разработка технических решений, удовлетворяющих требованиям защиты окружающей среды от воздействия негативных результатов вредных химических производств.
Соответственно получает развитие таких дисциплин как «Энерго- и ресурсосберегающие технологии в инженерной защите окружающей среды», «Энерго- и ресурсосберегающее оборудование в инженерной защите окружающей среды».
В результате можно сказать, что одной из главных задач цивилизованного развития общества являются оптимальные технологические и технические решения в сфере производственной деятельности человека. Эти решения включают в себя технические и социальные аспекты и их развитие порождает многообразие научных методов, одним из которых является изучаемая нами дисциплина: «Теоретические основы энерго- и ресурсосбережения в химических технологиях».
Поскольку химические технологии являются частью производственной деятельности и в то же время неизбежно связаны со всеми другими направлениями техники, то изучение теоретических основ должно базироваться на фундаментальных науках: физике, химии; а в связи со спецификой предлагаемой дисциплины - на её разделах: основах теплопередачи, термодинамики, которые уже изучались вами на предыдущих курсах.
В настоящем курсе основное внимание будет уделено методам оптимальных (экономичных) технических решений энерго- и ресурсосбережения. Здесь основной целью разработки любого химико-технологического процесса является решение задач минимизации затрат и соответственно утилизации потерь тепловой энергии и отходов. Поэтому для любого устройства, работающего при изменении химического и фазового состояния сырья и продукта, а именно: реактора, топливосжигающего устройства, необходимо предусматривать вспомогательные энерго- и ресурсосберегающее оборудование. Последнее использует традиционные тепло- и массообменные устройства: регенераторы, абсорберы, тепловые насосы, котлы-утилизаторы.
Прежде чем перейти к изучению теоретических основ упомянутых энерготехнологических приемов и устройств, необходимо определить отношение изучаемой дисциплины к инженерной экологии; а именно рассмотреть Основные задачи энерго- и ресурсосбережения в инженерной защите окружающей среды.
Эти задачи в самом общем виде следует рассматривать как задачи управления процессами взаимодействия человека и природы. Человек, равно как фауна, флора и элементы самой природы, является её частью и их взаимодействие усложняется по мере научно-технического прогресса.
Очевидно, что технический прогресс кроме положительных сторон (увеличение объёма производства продуктов потребления), сопровождается ростом отрицательного воздействия на среду обитания. Особенно сильно это противоречие в химических производствах. Устранить это противоречие невозможно, как невозможно исключить развитие природных процессов, так как деятельность человека является их естественным элементом. Однако это противоречие можно значительно ослабить путём оптимального управления процессами преобразования природных ресурсов, в частности за счёт экономии топлива, сырья, за счёт организации безотходных производств, утилизации и нейтрализацией вредных выбросов. Указанные вредные выбросы – это отходы производства, имеющие определённый энергетический потенциал. В химических производствах их следует представить как вторичные энергоресурсы. В частности такие ресурсы – это уходящие в атмосферу дымовые газы из устройств различного назначения. Они могут использоваться для предварительного подогрева первичных энергоресурсов – например воздуха для топливно-воздушной смеси перед сжигающим устройством.
Задачи энерго- и ресурсосбережения в химических технологиях не имеют принципиального отличия от тех же проблем в любых производствах, за исключением особенностей, связанных с различными химическими реакциями.
Подход к решению общей проблемы энерго- и ресурсосбережения удобен при использовании понятий энергия и эксергия.
Энергия – способность материи совершать работу в условно принятых границах: например, понятие «удельная теплота сгорания топлива» - есть тепловая энергия, полученная продуктами реакции окисления единицы его массы.
Для реакции горения (окисления углерода):
![]()
Следует определить
удельную теплоту Qсгорания
топлива, каковым является углерод.
Согласно определениюQесть тепловая энергия, полученная
продуктом![]() реакции окисления единицы массы
реакции окисления единицы массы![]() . Из справочных данных теплота
экзотермической реакции образования
. Из справочных данных теплота
экзотермической реакции образования![]() (из
исходных компонентов, взятых при Т=293К)
составляет 393559,4
(из
исходных компонентов, взятых при Т=293К)
составляет 393559,4![]()
Согласно указанной
реакции 1 кмоль
![]() получен из 1 кмоля С, т.е. в результате
сжигания 12 кг топлива: углерода. Тогда
удельная теплота сгорания топлива
получен из 1 кмоля С, т.е. в результате
сжигания 12 кг топлива: углерода. Тогда
удельная теплота сгорания топлива![]()
Если топливом
является любой сложный углеводород
![]() ,
то удельная теплота сгорания этого
топлива находится как сумма теплот
образования водяных паров и углекислого
газа
,
то удельная теплота сгорания этого
топлива находится как сумма теплот
образования водяных паров и углекислого
газа![]() ,
делённая на молекулярную массу соединения
,
делённая на молекулярную массу соединения![]() .
Для решения задачи запишем в общем виде
реакцию окисления:
.
Для решения задачи запишем в общем виде
реакцию окисления:
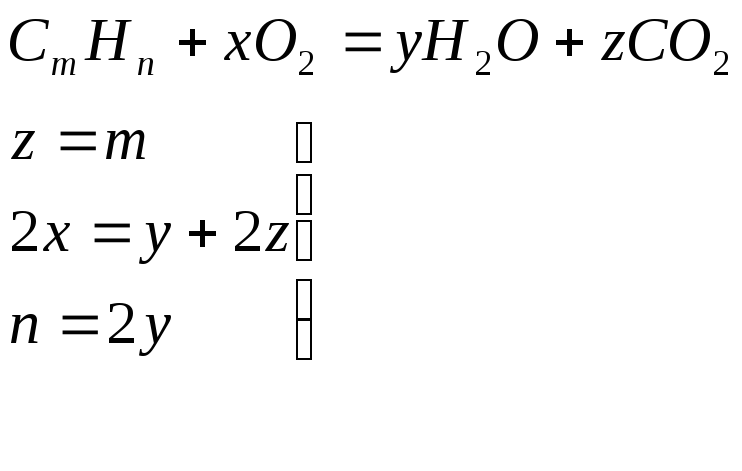
находим
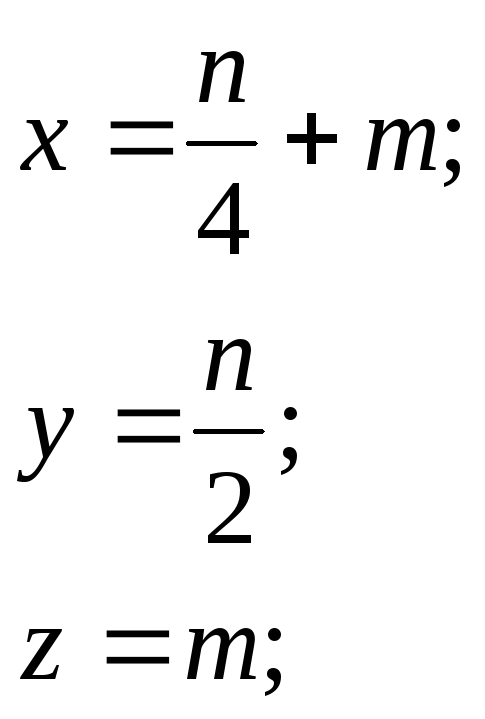
и тогда
![]()
Из справочных
данных теплота образования 1кмоля
водяных паров составляет
![]()
Теплота сгорания
1 кмоля
![]() составляет
составляет![]() .
.
Суммарная теплота,
полученная продуктами
![]() и
и![]() в результате сгорания 1 кмоля
в результате сгорания 1 кмоля![]() составляет:
составляет:![]()
Удельная теплота
Qсгорания топлива![]() :
:

Здесь
![]() -
«атомная масса».
-
«атомная масса».
Пересчёт Qна размерность кДж/нм3.
Масса 1 нм3
топлива по Авогадро составляет![]() .
.
Тогда 1 кг занимает
объём
![]() нм3.
нм3.
![]()
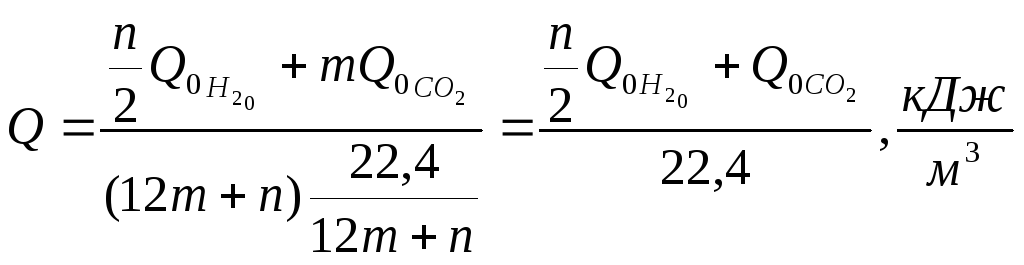
Здесь
![]() и
и![]() кДж/кг
взяты при нормальных условиях (Т=273К) и
несколько отличны от
кДж/кг
взяты при нормальных условиях (Т=273К) и
несколько отличны от![]() и
и![]() кДж/кг,
взятых ранее при Т=293К.
кДж/кг,
взятых ранее при Т=293К.
Мы рассмотрели экзотермические окислительные реакции в устройствах сгорания топлив, где удельная теплота сгорания топлива является тепловой энергией, полученной продуктами сгорания единицы массы топлива.
В химических технологиях осуществляются не только окислительные реакции. В зависимости от их вида (экзотермические либо эндотермические) тепловая энергия либо выделяется и продукты реакции имеют большую температуру, чем исходные компоненты; либо тепловая энергия поглощается и продукты реакции охлаждаются по сравнению с исходными компонентами.
При экзотермических реакциях задачи энергосбережения решаются путём утилизации теплоты продуктов реакции на выходе из реактора; при эндотермических реакциях в случае перегрева исходные компоненты следует охладить перед поступлением в реактор, чтобы обеспечить низкую температуру требуемой реакции. При этом осуществляется утилизация теплоты исходного компонента перед входом в реактор.
Согласно определению энергия – это способность совершать работу в условно принятых границах.
В рассмотренных примерах удельная теплота сгорания сгорания топлива либо, аналогично, удельная теплота в других реакциях, т.е. отнесённая к массе исходного компонента – это тепловая энергия реакции. Границами этой реакции являются состояния материи на входе и выходе из реактора. Для окислительных процессов эти верхняя и нижняя границы: смесь топлива с окислителем и продукты сгорания.
В отличие от энергии эксергиейв данных примерах будет также способность материиии совершать работу, но верхней границей является физико-химическое состояние окружающей среды. В таком случае можно сказать:
Эксергия – этомаксимальная способность материи совершать работу, с учётом взаимодействия с окружающей средой.
В приведённых примерах сгорания топлив максимальной способностью является возможность не только получать продукты реакции с высокой температурой, но и использовать их тепловую энергию в различных устройствах. Верхний предел утилизации этой теплоты соответствует температуре окружающей среды, т.е. отвечает тепловому равновесию с окружающей средой.
Очевидно, что вернуться к первичному состоянию окружающей среды в полной мере невозможно. Особенно существенна такая необратимость по химическому состоянию продукта, тем более если продукт реакции идёт как целевой к потребителю. Этим объясняется невозможность восстановить необратимые затраты топливно-энергетических ресурсов. Мерой приближения к идеальному равновесному состоянию (т.е. пределу преобразования) является анергия,а именно разница эксергии и энергии (т.е.используемой части эксергии).
Дадим окончательную формулировку понятия «Эксергия»
Эксергия материи является максимальной работой, которую эта материя может совершить в обратимом процессе с окружающей средой в качестве «даровых» тепла и веществ, если в конце этого процесса все участвующие в нём виды материи приходят в состояние термодинамического равновесия с окружающей средой.
Способы уменьшения анергии, т.е. не использованной части эксергии) – это соответственно способы повышения использованной части эксергии , а именно повышения энергетической эффективности устройств и систем химической технологии.
Указанные способы - это известные энерготехнологические решения, схемы которых даются в следующих разделах.
Схемы и принципы энерго- и ресурсосбережения в химических технологиях.
В данном разделе приведены энерготехнологические схемы производства целевых продуктов как из природных источников, так и из отходов различных производств.
Энерготехнологические схемы химических производств.
На рис. 1 и 2
представлены функциональная и
энерготехнологическая схемы синтеза
аммиака
![]() ,
который является целевым продуктом,
полученным из природных источников:
воздуха, воды и природного газа. На той
же схеме представлены энерго- и
ресурсосберегающие устройства.
,
который является целевым продуктом,
полученным из природных источников:
воздуха, воды и природного газа. На той
же схеме представлены энерго- и
ресурсосберегающие устройства.
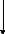
 H2OCH4N2воздух
H2OCH4N2воздух
 пар
O2
пар
O2
Абсорбер,
работающий с водным раствором
МОНОЭТАНОЛАМИНА
очистка смеси N2иH2
от CO2и др. примесей.p=2,6
МПа
Конвертор
оксида углерода
паровая конверсия
COt=450°С
Трубчатый
конвертор метана
паровая конверсия CH4t=800°С
Шахтный
конвертор
метана
паровоздушная
кон-
версия CH4t=1000°С
CO




 H2,N2
H2,N2
CH4+H2O↔CO+3H2+2,06
CH4+0,5O2↔CO+2H2-35,6
→N2![]()
![]()
CH4+H2O↔CO+3H2+206
кДж
CO+H2O↔CO2+H2.Q<0
Удалить CO2:
очистка азотоводородной смеси.
→N2
→H2
смесь
H2,
N2



Контактный
аппарат
(колонна
синтеза аммиака)
синтез
аммиака t=450-500°С
Компрессор
сжатие
газообраз-
ной смеси N2иH2
Теплообменник
охлаждение
NH3





Рис. 1. Функциональная схема синтеза аммиака: 3H2+N2=2NH3
Вода + моно-
этаноламин
Вода
Природный газ







H2O




26,5 атм
Вода














5 4 3
O2
и N2






















CO2
H2,N2
1000°C CO
H2,N2 450°C






























6 Q<0










Пар
2
800° C










1


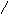
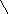




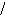
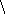











1
a


CO
и H2

Природ. газ


7







Остатки N2,
H2

10
а 11


В
атмосферу 10 9






12
8
NH3
(продукт)







NH3
и
остатки N2
и H2
H2
и N2







Реагент
Вода










400-500°C
Вода


Рис. 2. Энерготехнологическая схема синтеза аммиака.
Номера позиций на следующей странице.
Описание позиций к рис. 2:
1 – трубчатый конвертор метана;
1а – конвекционная камера трубчатого конвертора;
2 – шахтный конвертор метана;
3, 5, 11 – котлы-утилизаторы;
4 – конвертор оксида углерода;
6 – абсорбер;
7 – компрессор;
8 – паровая турбина;
9 – колонна синтеза аммиака;
10 – теплообменник охлаждения продукта;
10а – дополнительный холодильник.
Паровая конверсия
метана осуществляется в трубчатом
конверторе 1 метана при 800![]() С.
Для обеспечения этой температуры
требуется сообщить определённое
количество тепла в дополнение к
тепловыделению при экзотермической
реакции. Это дополнительное количество
тепла – от продуктов сгорания природного
газа. Отходящие дымовые газы с температурой
С.
Для обеспечения этой температуры
требуется сообщить определённое
количество тепла в дополнение к
тепловыделению при экзотермической
реакции. Это дополнительное количество
тепла – от продуктов сгорания природного
газа. Отходящие дымовые газы с температурой![]() нагревают потоки
нагревают потоки![]() ,
водяного пара и воздуха в теплообменниках,
размещённых в конвекционной камере 1а.
Там же размещён теплообменник для
подогрева природного газа. Поток
охлаждённых дымовых газов направлен в
котёл-утилизатор 11 с последующим выходом
в атмосферу. Из котла-утилизатора выходит
насыщенный или частично перегретый
водяной пар и направляется через паровую
магистраль в конвекционную камеру 1а,
где дополнительно перегревается и, имея
высокое давление, отдаёт свою энергию
паровой турбине 8, смонтированной на
одном валу с компрессором 7. Реагенты
(газы)
,
водяного пара и воздуха в теплообменниках,
размещённых в конвекционной камере 1а.
Там же размещён теплообменник для
подогрева природного газа. Поток
охлаждённых дымовых газов направлен в
котёл-утилизатор 11 с последующим выходом
в атмосферу. Из котла-утилизатора выходит
насыщенный или частично перегретый
водяной пар и направляется через паровую
магистраль в конвекционную камеру 1а,
где дополнительно перегревается и, имея
высокое давление, отдаёт свою энергию
паровой турбине 8, смонтированной на
одном валу с компрессором 7. Реагенты
(газы)![]() вместе с потоком
вместе с потоком![]() ,
выходящие из реактора 2 воздушной
конверсии метана, направляются в
котёл-утилизатор 3, где охлаждаются и
направляются в конвертор 4 оксида
углерода. А пар из котла 3 идёт в общую
паровую магистраль. В паровом конверторе
(4) COокисляется
до
,
выходящие из реактора 2 воздушной
конверсии метана, направляются в
котёл-утилизатор 3, где охлаждаются и
направляются в конвертор 4 оксида
углерода. А пар из котла 3 идёт в общую
паровую магистраль. В паровом конверторе
(4) COокисляется
до![]() :
:![]()
![]() .
После реактора 4 поток
.
После реактора 4 поток![]() и сопутствующего
и сопутствующего![]() направлен в котёл-утилизатор 5, пар из
которого собирается в общую паровую
магистраль. Охлаждённый в котле 5 поток
упомянутых
направлен в котёл-утилизатор 5, пар из
которого собирается в общую паровую
магистраль. Охлаждённый в котле 5 поток
упомянутых![]() ,
,![]() поступает в абсорбер 6 для удаления
поступает в абсорбер 6 для удаления![]() и очистки от примесей. Поглощение
и очистки от примесей. Поглощение![]() и примесей осуществляется потоком
водного раствора моноэтаноламина. Вода
с упомянутым растворенным реагентом
подаётся в абсорбер под давлением 2,6
МПа, создаваемым насосом, смонтированным
на одном валу с компрессором 7 и турбиной
8. Т.о. привод насоса, кроме электродвигателя,
обеспечивается дополнительно за счёт
энергии перегретого пара высокого
давления, подаваемого на турбину 8.
Очищенная азотоводородная смесь
поступает из абсорбера 6 в компрессор
7, а затем под высоким давлением в колонну
9 синтеза
и примесей осуществляется потоком
водного раствора моноэтаноламина. Вода
с упомянутым растворенным реагентом
подаётся в абсорбер под давлением 2,6
МПа, создаваемым насосом, смонтированным
на одном валу с компрессором 7 и турбиной
8. Т.о. привод насоса, кроме электродвигателя,
обеспечивается дополнительно за счёт
энергии перегретого пара высокого
давления, подаваемого на турбину 8.
Очищенная азотоводородная смесь
поступает из абсорбера 6 в компрессор
7, а затем под высоким давлением в колонну
9 синтеза![]() в
в![]() .
Остатки не прореагировавшей смеси
.
Остатки не прореагировавшей смеси![]() отделяются
в охлаждающих блоках 10 и 10а, от
отделяются
в охлаждающих блоках 10 и 10а, от![]() и эта азотоводородная смесь возвращается
в колонну 9 для обеспечения её полного
превращения вNH3.
Такая рециркуляция повышает интенсивность
реакции.
и эта азотоводородная смесь возвращается
в колонну 9 для обеспечения её полного
превращения вNH3.
Такая рециркуляция повышает интенсивность
реакции.
Другим примером энергосбережения является энерготехнологический агрегат, (рис. 3.), использующий теплоту каталитического или термического (без катализатора) дожигания отходящих газов химических производств. Эти газы содержат органические примеси.
отходящие газы












 1
1





 расплав
солей
расплав
солей


















 3
3




2





















 вода
вода
7
 4
4
очищ.
охлажд. газы















 6
6





 воздух
5
воздух
5

Рис. 3. Схема энерготехнологического агрегата в процессах газофазового окисления углеводородов.
1 – газодувка;
2 – реактор дожигания отходящих газов;
3 – парогенератор ;
4 – газовый теплообменник;
5 – турбина с паровым приводом;
6 – воздуходувка;
7 – подогреватель воздуха.
В трубах реактора
2 осуществляется каталитический процесс
газофазового окисления углеводородных
примесей. Схема рис. 3 используется в
производстве малеинового ангидрида
газофазным окислением алифатических
углеводородов (бутан-бутиленовая фракция
![]() ;
бутан
;
бутан![]() ).
В представленой схеме при дожигании
примесей образуется тепловая энергия,
которая частично используется для
производства пара высокого давления.
Энергия пара, в свою очередь, используется
на собственные нужды: механический
привод воздуходувки и подогрев воздуха,
который подаётся на окисление (дожигание)
примесей.
).
В представленой схеме при дожигании
примесей образуется тепловая энергия,
которая частично используется для
производства пара высокого давления.
Энергия пара, в свою очередь, используется
на собственные нужды: механический
привод воздуходувки и подогрев воздуха,
который подаётся на окисление (дожигание)
примесей.
Отходящие газы, содержащие примеси органических веществ, газодувкой 1 подаются в реактор 2 на каталитическое дожигание. Сюда же газодувкой 6 через подогреватель 7 подаётся необходимое количество воздуха. Теплота, образованная в результате дожигания, отводится циркулирующим расплавом солей, который нагревается в реакторе 2 и охлаждается в парогенераторе 3, в котором расплав отдаёт теплоту кипящей воде: с образованием насыщенного пара. Парогенератор 3 питается водой, подогреваемой в газовом теплообменнике 4 и кипящей в трубах 3 парогенератора, где образуется насыщенный пар. Последний подаётся в первую (более горячую) секцию теплообменника, где перегревается; полученный перегретый пар высокого давления поступает на лопасти турбины 5 и совершает работу. Указанная механическая энергия используется для привода воздуходувки 6. Отработанный (мятый) пар используется для подогрева воздуха в подогревателе 7 и после него может использоваться для передачи тепла другим потребителям.
Задачи энергосбережения следует решать методами оптимизации энерготехнологических систем. Эта оптимизация сводится к минимизации времени окупаемости системы.
В химической промышленности большой эффект достигается при комплексной утилизации энергии газов выжига кокса1 из катализатора крекинга.
На рис.4 показана схема использовании энергии газов регенерации катализатора установки крекинга
Кокс образуется на поверхности катализатора при его работе. Выжигание кокса – с целью регенерации (восстановления) катализатора.
пар продукты
газы
продукты
газы





 крекинга
выжига
воздух
крекинга
выжига
воздух














 1
2 3 4
1
2 3 4









8

 5
7
5
7



















катали-затор












дым.
газы
дым.
газы 





















 пыль
пыль







 сырьё
подогретый воздух
сырьё
подогретый воздух




Вода пар
Рис. 4. Схема использования энергии газов при регенерации катализатора в установке каталитического крекинга.
1 – реактор каталитического крекинга;
2 – реактор-регенератор катализатора реакции;
3 – система циклонов;
4 – каталитический
реактор дожигания СО:![]() ;2
;2
5 – газовая турбина;
6 – мотор – генератор;
7 – компрессор;
8 – пусковая паровая турбина;
9 – котёл-утилизатор.
Эта схема используется при деструктивной переработке нефти.
Применение этого
метода позволяет получить вещества,
являющиеся товарными продуктами. Мы
рассматриваем термические процессы
деструктивной переработки, одним из
которых является каталитический крекинг-
в присутствии катализатора. При этом
происходит коксование катализатора.
Особенностью указанных катализаторов
является их быстрая дезактивация. Поры
катализатора закоксовываются (через
10-15 минут работы) продуктами превращения
нефтяных фракций в кокс, смолы без
доступа воздуха. Поэтому необходимо
чередовать крекинг с регенерацией
катализатора, которая заключается в
выжигании кокса и смолистых отложений
с поверхности катализатора при помощи
подачи воздуха с температурой 540-580![]() .
Для предохранения катализатора от
местных перегревов воздух разбавляется
инертными газами, при этом обеспечивается
локальное подавление экзотермических
реакций окисления.
.
Для предохранения катализатора от
местных перегревов воздух разбавляется
инертными газами, при этом обеспечивается
локальное подавление экзотермических
реакций окисления.
Продолжим перечисление примеров энерго- и ресурсосберегающих устройств химической технологии.
