
Радиотерапевтическое оборудование
.pdf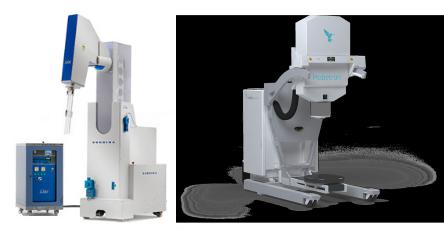
Медицинское оборудование в современной лучевой терапии |
81 |
|
|
дляаппаратовXoftиIntrabeam надвухперпендикулярных срезах.
ВконцеХХвеканедостаткитрадиционныхускорителей для проведения ИОЛТ были устранены с появлением ком- пактных мобильных электронных ускорителей, которые сталовозможнымрасположитьнепосредственновопераци- онной.Главнымипредставителямиздесьявляютсясистемы
Mobetron и Novac7 (рис.45).
Система Mobetron состоит из ускорителя на стоячей волне и «головки» смонтированных на С-дуге,модулятора электропитанияипанелиуправления.Вкорпусустройства вмонтированысистемырадиационнойзащитыускорителя. Максимальные размеры 250 см в высоту, 290 см в длину, в положении для транспортировки C-дуга складывается, иполнаявысотасоставляет190см.Полныйвес1140кг;при этомнетребуетсяперестройкастандартнойоперационной. Mobetronможетпоставлятьпучкиэлектроновчетырехраз- личныхэнергий:4,6,9и12МэВ,стерапевтическимпробегом до 4 см. Система обеспечивает высокую дозу (10–25 Гр) за одну фракцию с мощностью дозы 10 Гр/мин.
Рис.45.Внешний вид аппарата Mobetron (слева) и Novac7 (справа)
82 |
Библиотека медицинского физика |
|
|
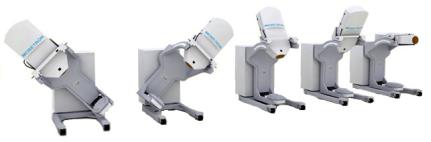
Расстояниеисточник-поверхность(расстояниеотфильтра вголовкеускорителядоконцааппликатора,расположенного на облучаемой поверхности) 50 см. Высота расположения оси вращения ГАНТРИ над полом 99 см. Доступные углы поворотаГАНТРИ±45°соскоростьюдо0.75°/сек.Амплиту- да смещения ГАНТРИ влатеральном направлении,атакже вправо-влево±5см,соскоростьюдо2мм/сек,уголнаклона головки±30°соскоростьюдо0.75°/сек.Различныевозможные положения гантри системы Mobetron показаны на рис.46.
Система Novac7 представляет собой миниатюрный ли- нейный ускоритель электронов, расположенный на робо- тизированнойрукесчетырьмявращающимисясуставами. Ускорительпозволяетполучатьпучкиэлектроновсэнергиями 3,5,7и9МэВсвысокойимпульснойдозой2–9сГр/импульс. Частотаследованияимпульсов5Гц,длительностьимпульса 4мкс.Операторуправляетвсемидвижениямироботизиро- ваннойрукиспомощьюпультадистанционногоуправления. Для предписанной дозы 20 Гр время облучения составляет 1–2 мин.Размеры и вес установки примернотакие же,как и у системы Mobetron.
Системаоснащенакомплектомцилиндрическихаппли- каторов из полиметилметакрилата с номинальными раз- мерами 4, 6, 8 и 10 см в диаметре,толщиной стенок 0.5 см и длиной 69, 67, 67 и 89 см, соответственно. Доступны две
Рис.46. Возможные положения гантри системы Mobetron
Медицинское оборудование в современной лучевой терапии |
83 |
|
|
формы аппликаторов—плоские искошенные (под углами
15°,22.5° и 45°).
Расстояние источник-поверхность (SSD)— 80 см, за ис- ключением случая использования аппликатора 10 см, для которого расстояние источник-поверхность 100 см.
Доступ к опухоли обеспечивается хирургическим пу- тем, и облучается либо сама опухоль, либо ложе после ее удаления. В операционную рану пациента в стерильных условиях устанавливают специальный пластиковый или металлический тубус, который соединяется с облучающей головкой. Тубус не только формирует поле облучения, но и экранирует от первичного излучения ткани и органы, находящиеся вокруг него.
Обаэтихустройствамогутиспользоватьсявлюбойопе- рационнойкомнатебезспециальнойзащиты,инепредус- матриваютособыхтребованийкоснащениюоперационной. Единственное,чтонеобходимоучитыватьвовремяоперации то, что они требуют пространства шириной порядка 15 см вокруг операционного стола, которое необходимо для ма- невров и перемещений роботизированной руки.
Глава 4.
Оборудование в адронной терапии
Р.Р.Уилсон,основательлабораторииФерми,написалвме- дицинскийжурнал«Радиология»в1946 г.,чтопучкипротонов итяжелыхионовбудутидеальноподходитьдлялеченияболь- ных раком, потому что инерционные характеристики этих частиц показывают, что выделение большей части энергии и, следовательно, биологическое повреждение происходят внепосредственнойблизостиотобластиокончанияпробега частиц.Остановкапучкавнутриопухолисущественноповы- силабыдоставленнуювопухольдозу,обеспечиваяприэтом минимальную дозу для здоровых тканей, расположенных вдоль входного пути пучка. Кроме того, поскольку частицы останавливаются в опухоли, нет по существу никакой дозы на выходе. Поскольку максимизация дозы в опухоли и ми- нимизация дозы в окружающих здоровых тканях является однойизключевыхзадачлучевойтерапии,пучкизаряженных частиц обладаютпреимуществом перед фотонами.
Для получения пучков протонов и ионов могут исполь- зоватьсялинейныеускорители,циклотроныисинхротроны сэнергиейдо 250 МэВ.Однаколинейные ускорители из-за их большой длины не нашли практического применения. Чащевсегоиспользуютсяциклотронывсилусвоихнеболь- ших габаритов,простоты управления,надежности эксплу- атирования, а главное, из-за возможности модулировать интенсивностьтокапучкасбольшойскоростьюиточностью.
Медицинское оборудование в современной лучевой терапии |
85 |
|
|
4.1.Ускорители протонов и легких ионов
Более века назад Вильям Брэгг, изучая взаимодействие заряженных частиц с веществом,обнаружил,что протоны теряютпочтивсюсвоюэнергиювсамомконцесвоейтраек- тории в веществе.В 1946 г.Р.Вильсон показал: пучки уско- ренных протонов пригодны для того, чтобы максимально облучитьочагзаболеванияидатьминимумвокружающие ткани. Они позволяют, в отличие от всех применяемых ранее типов излучения, вовсе не облучатьткани,лежащие за мишенью, причем все частицы можно остановить на ее задней границе. Тобиаш и Лоуренц первыми в 1952 г. использовали пучки протонов, дейтронов и альфа-частиц синхроциклотронавБеркли(США)длямедико-биологиче- ских исследований.В1954 г.вБеркли первый пациентбыл вылечен с применением протонной терапией. Подобные исследования на протонах с энергией 187 МэВ с 1956 г. начали проводиться в Швеции Ларсоном. Клинические исследования по применению протонов высоких энергий
влучевойтерапииначалисьс1959 г.вГарвардскомунивер- ситетеКильбергомнасинхроциклотронесэнергией160МэВ. В1992 г.былоткрытпервыйгоспитальпротоннойтерапии
вУниверситете Лома Линда в Калифорнии.Тяжелые ионы впервыебылипримененыврадиотерапиивнациональном Институте Радиологических Исследований (NIRS) в 1994 годувЧибе(Япония).ПервыйвСоветскомСоюзепротонный пучок с необходимымидлялучевойтерапии параметрами был создан в 1967 г. по предложению В. П. Джелепова на фазотроне680МэВвлабораторииядерныхпроблемОИЯИ (Дубна).
Насегодняшнийденьвмиренасчитываетсяоколо70цен- тровадроннойтерапии,вкоторыхиспользуетсясуммарно около 140 установок.Только в восьми центрах используют
86 |
Библиотека медицинского физика |
|
|
пучки тяжелее протонов.С 1990 годов сооружалисьтолько многокабинные клинические центры адронной терапии. Обычно в таком центре располагается один ускоритель протонов или ионов, который позволяет разделить пучок на несколько процедурных кабин с гантри (обычно 3–5 кабин,рис.47).В 2018 году частная компанияVarianначала производствокомпактногопротонногоускорителянаодну кабину для использования в клиниках.Типичные энергии протонов впучках,используемыхдлялечения,составляют
70–250 МэВ.
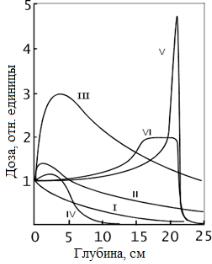
Особенность применения пучков протонов и ионов — наличие в распределении дозы в зависимости от глубины острого пика, называемого пиком Брэгга (рис. 48, кривая V).Наличие вглубинных распределенияхдозы максимума вконцепробегапозволяетконцентрироватьбольшуюдозу внутри объема мишени и уменьшать дозу в окружающих ее здоровыхтканях.Этотфактивысокая степеньточности
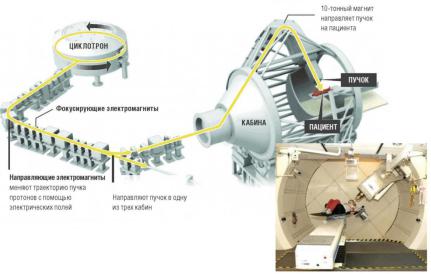
Рис.47. Схема ускорения и доставки пучков адронов
Медицинское оборудование в современной лучевой терапии |
87 |
|
|
попаданиявмишень(порядка 1мм)оказываетсяполезным при использовании протон-
ныхпучковвлучевойтерапии.
В системах протонной лучевойтерапииитерапии легкимиионами,основывающихся на использовании циклотрона, поток частиц регулируется и направляется в кабину при помощи коллиматоров пучка, квадрупольных электромагнитныхлинзиповоротных магнитов.
После разветвления на кабиныпучокадроновпопадаетвгантри,использование котороговадроннойтерапии даётвозможностьоблучения сразличныхугловипозволяетповыситьконформность дозы.Однако,из-заэнергий,
многократнопревышающихэнергиивлучевойтерапии фотонами иэлектронами, размеры ифизические характеристики гантри существенно превосходят аналоги, применяемые в медицинских линейных ускорителях (характерные размеры — 2.5–3 метра в высоту и масса
2–3 тонны).
Гантри,используемыйвлучевойтерапиипротонами или ионами, имеет следующее устройство. На мощном каркасе гантри последовательно располагаются два отклоняющихна45о магнита,элементыфокусировкипучка,
88 |
Библиотека медицинского физика |
|
|
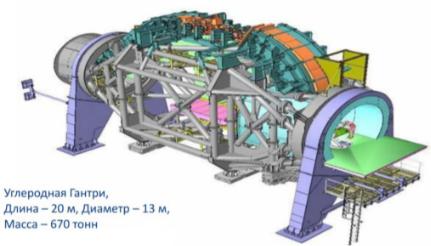
Рис.49. Схема гантри центра ионной терапии в Гайдельберге
дипольные магниты системы активного сканирования пучка,отклоняющийна90о магнитивыходнойколлиматор, в котором формируется окончательное поле пучка. Дляпротонногопучкаразмерыгантрисоставляютоколо 10–15мввысоту,весоколо100тонн,адляуглеродного пучкавнесколькоразбольше—примерно20миоколо 600 тонн. На рис.49 представлен гантри центра ионной терапии в Гайдельберге.
Варьировать энергию тяжелых заряженных частиц на выходе ускорителя на практике трудновыполнимо. Изме- нениеэнергиичастицдостигаетсяспомощьюспециальных фильтров,установленныхнапутипучка.Обычноиспользуют гребенчатые,вращающиеся,спиральныеидругиефильтры. Принципихдействиясводитсякпреобразованиюисходного моноэнергетического пучка в пучок с широким энергети- ческим спектром частиц.
Пучокадроновпроходитразныйслойвеществафильтра и в результате ионизационных потерь образуется спектр

Медицинское оборудование в современной лучевой терапии |
89 |
|
|
частиц с разными энергиями. |
|
Подбором соответствующих |
|
параметров фильтра можно |
|
добиться ширины и равно- |
|
мерности «плато» с заданной |
|
точностью (рис.48,кривая VI). |
|
Примером одного из таких |
|
фильтров является регулятор |
|
шириныпикаБрэгга.Онпред- |
|
ставляет собой диск из замед- |
Рис. 50. Регулятор ширины |
лителяс низким Z (алюминий, |
пика Брэгга |
пластик)переменнойтолщины,принимающийразличные положениявовремялечения.Такимобразом,пучокпроходит разныерасстояниявзамедлителеприповоротерегулятора, ивзлокачественномобразованииформируетсяоднородное распределение дозы (рис.50).
Дляформированиядозывадроннойтерапиисуществует несколько различных методик, которые можно разделить на пассивное рассеяние и сканирование.
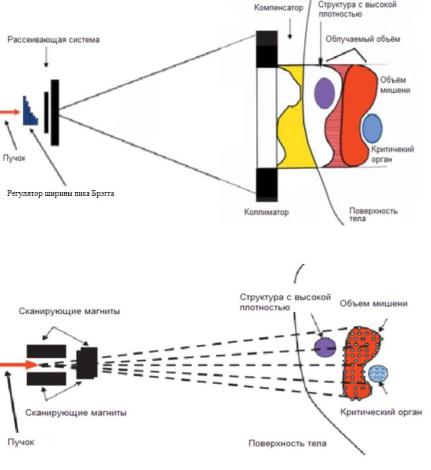
При использовании техники пассивного рассеяния формируется однородный пучок с резким спадом интен- сивности в конце мишени (рис. 51). Сначала один или два рассеивателя формируют однородный пучок диаметром около 2,5 см, после чего с помощью дипольных магнитов обеспечивается сканирование пучком сечения опухоли во взаимноортогональныхплоскостях.Конформностьраспре- делениядозыдостигаетсязасчетзаранееизготавливаемых индивидуальных коллиматоров.
Вторым способом, обеспечивающим импульсно-моду- лированнуюлучевую терапию, является методика «каран- дашного пучка». Метод сканирования состоит в использо- вании для облучения опухоли тонкого пучка с диаметром 3–5 мм (рис. 52). Объем опухоли при этом разбивается на
90 |
Библиотека медицинского физика |
|
|
Рис.51. Схема метода рассеяния
Рис. 52. Схема метода сканирования
срезы(обычнодо100),какприкомпьютернойтомографии. Для перехода на следующий срез происходит изменение энергии пучка.
На срезе сканирование может осуществляться в трех режимах:
Точечноесканирование—припереходеотвокселаквок- селу среза пучок выключается.
