
- •Коллоидная химия
- •План:
- •Межфазные взаимодействия между
- •Адгезия
- •Адгезия
- •Смачивание и капиллярные явления. Капиллярная конденсация. Адгезия и смачивание
- •Смачивание и капиллярные явления. Капиллярная конденсация. Адгезия и смачивание
- •Смачивание и капиллярные явления. Капиллярная конденсация. Адгезия и смачивание
- •Смачивание и капиллярные явления. Капиллярная конденсация. Адгезия и смачивание
- •Смачивание и капиллярные явления. Капиллярная конденсация. Адгезия и
- •Смачивание и капиллярные явления. Капиллярная конденсация. Адгезия и смачивание

Коллоидная химия
Лекция № 4.
Mежфазные взаимодействия между конденсированными фазами.
План:
1.Межфазные взаимодействия между конденсированными фазами. 2.Адгезия.
3.Смачивание и капиллярные явления. Капиллярная конденсация. Адгезия и смачивание.
4.Растекание.
2

Межфазные взаимодействия между
конденсированными фазами
Как правило, адгезия и смачивание |
К межфазным взаимодействиям |
сопровождают друг друга. Эти явления |
|
широко распространены в природе и в |
между конденсированными фазами |
различных отраслях промышленности |
относятся смачивание, растекание и |
(нанесение лакокрасочных покрытий, |
адгезия. |
получение материалов на основе связующих и |
|
наполнителей - бетон, резина и т.д.) |
|
Адгезия
Адгезия - межфазное взаимодействие, или взаимодействие между приведёнными в контакт поверхностями конденсированных тел разной природы (прилипание). Адгезия обеспечивает между двумя телами соединение определенной прочности, обусловленное межмолекулярными силами.
Адгезия возможна в системах -
Адгезия - результат стремления системы к уменьшению поверхностной энергии, следовательно, это самопроизвольный процесс. Работа адгезии Wa, характеризующая прочность адгезионной связи, определяется работой обратного разрыва адгезионной связи, отнесённой к
единице площади:
Ws = WаS, где Ws (1)
- полная работа адгезии Wa = [Дж/м2]
ж/ж, ж/т, т/т.

Адгезия
Соотношение между работой адгезии и поверхностным натяжением
3 фазы - 1-газ, 2 -жидкость, 3 - твердое |
При совмещении 2 и 3 возникает адгезия |
|||
( 2,3). В результате первоначальная энергия |
||||
тело, 2, 3 - конденсированные фазы. |
||||
|
Гиббса уменьшается на величину, равную |
|||
|
работе адгезии. |
|
||
|
G + Wa = 0 или Wa = - G, Gнач = 2,1 + 3,1, |
|||
|
|
|
Gкон = 2,3, |
|
|
G = Gнач – G кон = 2,3 - 2,1 - 3,1 или |
|||
|
(2)Wa = |
+ |
- - уравнение Дюпре |
|
|
2,1 |
3,1 |
2,3 |
|
2,3 - поверхностное
натяжение на границе раздела двух конденсированных фаз,
2,1 и 3,1 - поверхностное натяжение на границе с
воздухом
Уравнение Дюпре отражает закон сохранения энергии при адгезии: работа адгезии тем больше, чем больше поверхностные натяжения исходных компонентов и чем меньше конечное межфазное натяжение.
Уравнение (2) справедливо только для изобарно-изотермического процесса в отсутствии электрического и химического взаимодействия между контактирующими телами, его используют для определения равновесной работы адгезии жидкости.
Равновесную работу адгезии можно сопоставить с равновесной работой когезии. Когезия - определяет связь между молекулами внутри тела и в пределах одной фазы, характеризует прочность конденсированных тел и их способность противодействовать 4
внешнему усилию.
Адгезия
Стадии процесса адгезии
Первая стадия - транспортная, перемещение адгезива (клеящего вещества) к поверхности субстрата (тело, на которое наносят адгезив) и их определенное ориентирование в
межфазном слое.
Вторая стадия - взаимодействие адгезива и субстрата, обусловлено различными силами (от Ван-дер-Ваальсовых до химических).
Различают несколько механизмов в зависимости от природы взаимодействующих тел и условий, при которых происходит адгезия.
1. Механическая адгезия - осуществляется |
2. Молекулярная (адсорбционная) адгезия |
путем затекания в поры и трещины |
- возникает под действием |
поверхности твердого тела жидкого адгезива, |
межмолекулярных Ван-дер-Ваальсовых |
который потом затвердевает, обеспечивая |
сил и водородных связей. |
механическое зацепление. |
|
|
4. Диффузионный механизм |
3. Электрическая теория - связана с |
предусматривает взаимное проникновение |
образованием двойного электрического слоя |
молекул и атомов в поверхностные слои |
(ДЭС) на границе раздела между адгезивом и |
взаимодействующих фаз. |
субстратом. |
5 |
Смачивание и капиллярные явления. Капиллярная конденсация. Адгезия и смачивание
Смачивание – поверхностное явление, которое возникает в результате межмолекулярного взаимодействия при контакте одновременно трех фаз, из которых, по крайней мере, одна является жидкостью
То есть оно возникает в системах Т/Ж/Г или Т/Ж1/Ж2, где Ж1 и Ж2 – две несмешивающиеся жидкости. Взаимодействие в системах Т/Ж1/Ж2 называют избирательным смачиванием. Общая граница контакта трех фаз называется линией смачивания.
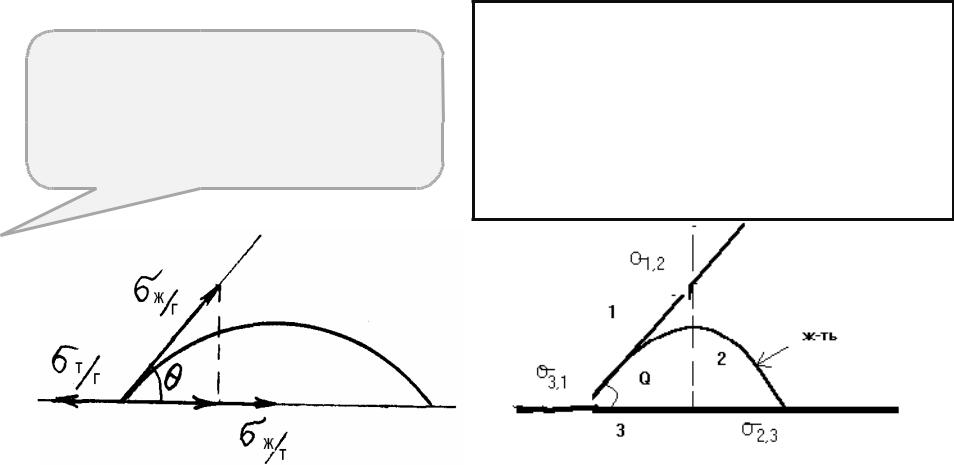
Количественной характеристикой смачивания является косинус краевого угла. Краевой угол (θ)
–угол между касательной к поверхности капли и смачиваемой поверхностью (рис. 2), причем
вершина угла лежит на линии смачивания. Краевой угол θ отсчитывается в сторону жидкости, а при избирательном смачивании – в сторону более полярной из двух жидкостей.
Рис. 2
Смачивание и капиллярные явления. Капиллярная конденсация. Адгезия и смачивание
Смачивание можно рассматривать как процесс, при котором в системе из трех соприкасающихся фаз происходит уменьшение свободной поверхностной энергии. Если удельная свободная поверхностная энергия на границе твердого тела и жидкости меньше, чем на границе твердого и газа (σТЖ < σТГ), то энергетически выгодно
растекание жидкости (смачивание), при котором поверхность с высокой энергией частично заменяется на поверхность с меньшим запасом свободной энергии. И наоборот, если σТЖ > σТГ , то энергетически выгодно
несмачивание.
Величина смачивания определяется результатом конкуренции сил межмолекулярного притяжения внутри жидкости (сил когезии) и сил молекулярного взаимодействия между жидкостью и твердым телом (сил адгезии). Если молекулы жидкости взаимодействуют с молекулами твердого тела сильнее, чем между собою, то капля растекается по поверхности, образуя мениск с острым краевым углом (0° < θ < 90°) (или тонкую пленку с краевым углом θ = 0°. Последний случай (θ = 0°) называется полным смачиванием (вода на обезжиренной поверхности стекла или кварца). Если же молекулы Ж взаимодействуют друг с другом сильнее, чем с молекулами твердого тела, то капля стягивается, образуя тупой краевой угол θ > 90°, как в случае воды на парафине или фторопласте. Случай θ = 180° (полное несмачивание) является гипотетическим, т.к. он означал бы полное отсутствие молекулярного взаимодействия между фазами, что нереально.

Смачивание и капиллярные явления. Капиллярная конденсация. Адгезия и смачивание
Поверхностная энергия твердого тела, стремясь уменьшиться, вызывает растяжение капли по поверхности. Эта энергия равна поверхностному натяжению твердого тела на границе с воздухом 3,1. Межфазная энергия на границе твердого тела с жидкостью 2,3 стремится сжать каплю. Растеканию препятствуют когезионные силы, действующие внутри капли. Действие когезионных сил направлено от границы между твердой, жидкой и газообразной фазами по касательной к сферической поверхности капли и равно 2,1.Угол - краевой угол или угол смачивания.
3,1(ТГ) = 2,3(ТЖ) + 2,1(ЖГ)cos( )
закон Юнга |
(3) |
|
cos( ) = ( 3,1- 2,3)/ 2,1 (4)
Чем меньше краевой угол , тем лучше смачивание поверхности.
Если cos( )>0 , то поверхность хорошо смачиваемая, cos( )<0 - плохо смачиваемая.
8
Смачивание и капиллярные явления. Капиллярная конденсация. Адгезия и смачивание
Следствия из уравнения Юнга
1. Различные жидкости тем лучше смачивают данную твердую поверхность, чем ниже поверхностное натяжение жидкости.
2. Смачиваемость твердых тел тем больше, чем выше их свободная поверхностная энергия. Смачиваемость повышается в ряду: тела с молекулярной кристаллической решеткой < с полярными связями < с ионной кристаллической решеткой.
3. При избирательном смачивании из двух жидкостей смачивать данную твердую поверхность будет та, полярность которой ближе к полярности твердого тела. Другими словами, смачивающей будет та жидкость, у которой меньше разность полярностей с данным твердым телом, т.е. она более близка к нему по молекулярной природе, проявляет более сильное межмолекулярное взаимодействие с ним и обеспечивает, следовательно, более низкое значение величины σТЖ.
Тела, для которых в условиях избирательного смачивания краевой угол θ < 90° (В > 0),
называются гидрофильными, а в обратном случае (θ > 90°, В < 0) –
гидрофобными (или олеофильными).
9
Смачивание и капиллярные явления. Капиллярная конденсация. Адгезия и
Правило Антонова: смачивание
Если жидкости ограниченно растворимы друг в друге, то поверхностное натяжение на границе Ж1/Ж2 равно разности между поверхностными натяжениями взаимно насыщенных жидкостей на границе их с воздухом или с их собственным паром.
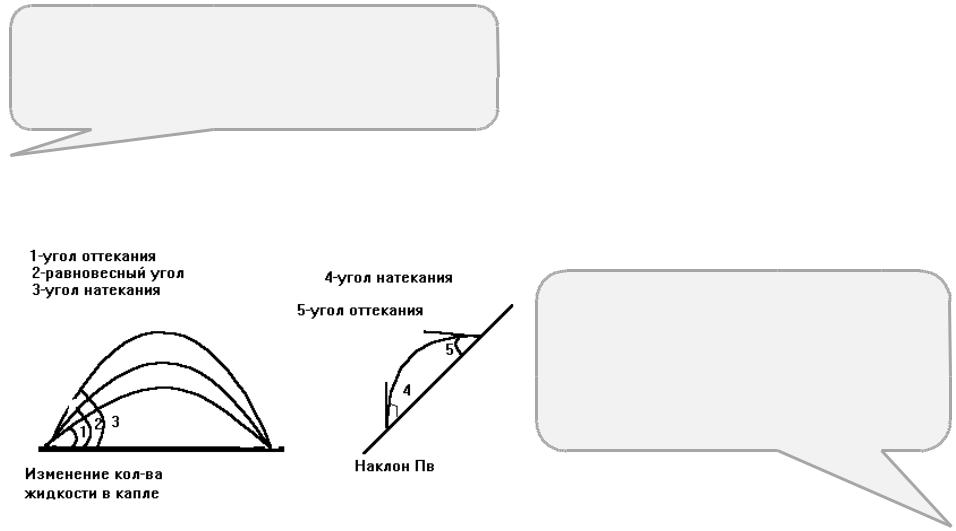
Кинетический катерезис, который замедляет достижение равновесной формы капли. Краевые углы зависят от времени нахождения капли на поверхности:
Если разность 3,1 - 2,3 в уравнении Дюпре заменить её выражением из закона Юнга, то
Wa = 2,1(ЖГ) + 2,1(ЖГ)cos( )
(5) Wa/ 2,1(ЖГ) = 1+ cos( ) - уравнение Дюпре-Юнга
При увеличении капли формируется краевой угол натекания, а при уменьшении капли – угол отекания. За образованием углов отекания и натекания удобно наблюдать, если наклонить пластинку.
Рис.3 Статические углы натекания и оттекания.
