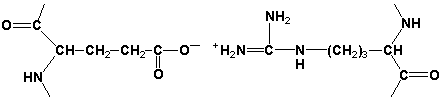1 (1). Первичная структура белка. Зависимость свойств и конформации белков от первичной структуры. Примеры полиморфизма белков, гемоглобин А и F, структурные и функциональные отличия. Наследственные изменения первичной структуры — молекулярные болезни (серповидно-клеточная анемия).
1. Первичной структурой белка называют последовательность чередования аминокислот в полипептидной цепи. Эту структуру формируют пептидные связи между α-амино- и α-карбоксильными группами аминокислот (см. раздел 1.2 настоящего курса). Первичная структура каждого белка уникальна и запрограммирована генетически. Выяснение аминокислотной последовательности белков представляет интерес по ряду причин.
Во-первых, даже небольшие изменения первичной структуры белка в результате генных мутаций могут значительно изменять его свойства. Это приводит к нарушению нормальной функции белка, а следовательно, к развитию заболевания. Примеры заболеваний, развивающихся в результате изменения первичной структуры ферментного белка, будут рассмотрены в 5-й теме настоящего курса.
Во-вторых, знание аминокислотной последовательности важно для выяснения молекулярной основы биологической активности белка.
В-третьих, сравнительное изучение последовательностей аминокислот в белках позволяет проследить эволюцию форм жизни на молекулярном уровне.
В-четвёртых, это необходимо для выяснения тех принципов, на основе которых из полипептидных цепей формируются высокоспецифичные пространственные структуры. Установлено, что последовательность аминокислотных остатков полипептидной цепи белка несёт в себе информацию, необходимую для формирования пространственной структуры белковой молекулы. Процесс сворачивания полипептидной цепи в правильную трёхмерную структуру получил название фолдинг.
До последнего времени считалось, что формирование пространственной структуры белка происходит самопроизвольно, в отсутствие каких-либо компонентов. Однако сравнительно недавно выяснилось, что это справедливо только для относительно небольших белков (порядка 100 аминокислотных остатков). Для фолдинга крупных белков необходимы специальные протеины — шапероны, которые создают возможность быстрого формирования правильной пространственной структуры белка.
В полипептидной цепи многократно повторяется группа: -NH-CH-CO-. Эта группа формирует пептидный остов. Следовательно, полипептидная цепь состоит из остова (скелета), имеющего регулярную, повторяющуюся структуру, и отдельных боковых цепей R-групп. Первичная структура характеризуется порядком (последовательностью) чередования аминокислот в полипептидной цепи. Даже одинаковые по длине и аминокислотному составу пептиды могут быть разными веществами потому, что последовательность аминокислот в цепи у них разная. Последовательность аминокислот в белке уникальна и детерминируется генами. Даже небольшие изменения первичной структуры могут серьезно изменять свойства белка. Было бы неправильно заключить, что каждый аминокислотный остаток в белке необходим для сохранения нормальной структуры и функции белка.
Функциональные свойства белков определяются их конформацией, т.е. расположением полипептидной цепи в пространстве. Уникальность конформации для каждого белка определяется его первичной структурой. В белках различают два уровня конформации пептидной цепи - вторичную и третичную структуру. Вторичная структура белков обусловлена способностью групп пептидной связи к водородным взаимодействиям: C=O....HN. Пептид стремится принять конформацию с максимумом водородных связей. Однако возможность их образования ограничивается тем, что пептидная связь имеет частично двойной характер, поэтому вращение вокруг нее затруднено. Пептидная цепь приобретает не произвольную, а строго определенную конформацию, фиксируемую водородными связями. Известны несколько способов укладки полипептидной цепи: a -спираль - образуется внутрицепочечными водородными связями между NH-группой одного остатка аминокислоты и CO-группой четвертого от нее остатка; b -структура (складчатый лист) - образуется межцепочечными водородными связями или связями между участками одной полипептидной цепи изогнутой в обратном направлении; беспорядочный клубок - это участки, не имеющие правильной, периодической пространственной организации. Но конформация этих участков также строго обусловлена аминокислотной последовательностью. Содержание a -спиралей и b -структур в разных белках различно: у фибриллярных белков - только a -спираль или только b -складчатый лист; а у глобулярных белков - отдельные фрагменты полипептидной цепи: либо a -спираль, либо b -складчатый лист, либо беспорядочный клубок. Третичная структура глобулярных белков представляет ориентацию в пространстве полипептидной цепи, содержащей a -спирали, b -структуры и участки без периодической структуры (беспорядочный клубок). Дополнительное складывание скрученной полипептидной цепи образует компактную структуру. Это происходит, прежде всего, в результате взаимодействия между боковыми цепями аминокислотных остатков.
В. Полиморфизм белков
Поскольку большинство нормальных клеток человека диплоидны, то они содержат две копии каждой хромосомы, одна из которых получена от отца, а вторая от матери. Эти две копии одной и той же хромосомы называют гомологичными (рис. 4-59). В ДНК каждой хромосомы содержится более тысячи генов. Соответствующие друг другу гены в гомологичных хромосомах называют аллелями. Аллели могут быть идентичными и содержат одинаковую последовательность нуклеотидов. В этом случае индивидуум, имеющий такие аллели, будет гомозиготен по данному признаку. Если аллели различаются по последовательности нуклеотидов в ДНК, то говорят о гетерозиготном наследовании гена. В этом случае индивидуум будет иметь 2 белковых продукта гена, различающихся по аминокислотной последовательности.
У каждого человека существует только 2 разных аллеля одного гена, тогда как в популяции людей вариантов аллелей может быть огромное множество. Как уже говорилось ранее, изменчивость структуры ДНК, а следовательно разнообразие аллелей, обусловлено мутационным процессом и рекомбинациями в гомологичных хромосомах половых клеток. Если в ходе мейоза рекомбинации сопровождаются обменом участками ДНК, меньшими по размеру, чем ген, то такой процесс может приводить к появлению новых, прежде не существовавших аллелей. А поскольку рекомбинации - более частые события, чем мутации в кодирующих участках гена, то разнообразие вариантов аллелей обусловлено главным образом ими.
Существование в популяции 2 и большего числа аллелей одного гена называют"аллеломорфизм", или "полиморфизм", а белковые продукты, образующиеся в ходе экспрессии этих вариантов гена - "полиморфы". Разные аллели встречаются в популяции с разной частотой. К полиморфам относят только те варианты, распространённость которьж в популяции не меньше 1%.
В процессе эволюции отдельные гены амплифицируют с образованием копий, а их структура и положение могут изменяться в результате мутаций и перемещений не только внутри хромосомы, но и между хромосомами. Со временем это приводит к появлению новых генов, кодирующих белки, родственные исходному, но отличающиеся от него определёнными свойствами и занимающие в хромосомах разные генные локусы (или места).
К родственным белкам относят изобелки, представляющие собой варианты белков, выполняющие одну и ту же функцию и обнаруживаемые в пределах одного вида организмов. Так, в группе из 2000 генов человека, кодирующих факторы транскрипции и транскрипционные активаторы, идентифицировано 900, относящихся к семейству белков, имеющих "цинковые пальцы". Существует 46 генов фермента глицеральдегид-3-фосфатдегидрогеназы, осуществляющего единственную окислительную реакцию в метаболическом пути катаболизма глюкозы до пирувата.
Выявлены семейства родственных белков, возникшие в ходе эволюции из одного "предкового" гена, или гена-предшественника. Такие семейства составляют:
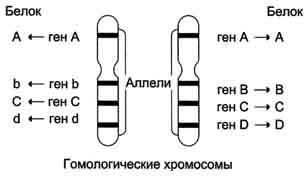
Рис. 4-59. Гомологичные хромосомы и соответствующие аллелям белковые продукты. На рисунке показано расположение 4 аллелей (АА, Bb, CC, dD) на гомологичных хромосомах. Аллели могут быть идентичны, как в случае генов АА и СС, или различаться (Bb, Dd). Белковые продукты будут идентичны для аллелей АА и СС, но будут различаться по аминокислотной последовательности в случае аллелей Bb и Dd.
207
гены миоглобина и протомеров гемоглобинов;
группа протеолитических ферментов: трипсин, химотрипсин, эластаза, гшазмин, тромбин и некоторые другие белки и ферменты.
Атом железа расположен в центре гема-пигмента, придающего крови
характерный красный цвет. Каждая из 4 молекул гема «обернута» одной
полипептидной цепью. В молекуле гемоглобина взрослого человека HbА. (от англ. adult – взрослый) содержатся четыре полипептидные цепи, которые
вместе составляют белковую часть молекулы – глобин. Две из них, на-
зываемые α-цепями, имеют одинаковую первичную структуру и по 141
аминокислотному остатку. Две другие, обозначаемые β-цепями, также
идентично построены и содержат по 146 аминокислотных остатков. Таким
образом, вся молекула белковой части гемоглобина состоит из 574 амино-
кислот. Во многих положениях α- и β-цепи содержат разные аминокислот-
ные последовательности, хотя и имеют почти одинаковые пространствен-
ные структуры. Получены доказательства, что в структуре гемоглобинов
более 20 видов животных 9 аминокислот в последовательности оказались
одинаковыми, консервативными (инвариантными), определяющими функ-
ции гемоглобинов; некоторые из них находятся вблизи гема, в составе
участка связывания с кислородом, другие – в составе неполярной внутрен-
ней структуры глобулы.
В дополнение к основному гемоглобину HbA1
в крови взрослого
человека доказано существование мигрирующего с меньшей скоростью при
электрофорезе гемоглобина НbА2
, также состоящего из 4 субъединиц: двух
α-цепей и двух δ-цепей. На долю НbА2
приходится около 2,5% от всего
гемоглобина. Известен, кроме того, фетальный гемоглобин (гемоглобин
новорожденных), обозначаемый HbF и состоящий из двух α-цепей и двух
γ-цепей. Фетальный гемоглобин отличается от HbA1
не только составом
аминокислот, но и физико-химическими свойствами: спектральным пока-
зателем, электрофоретической подвижностью, устойчивостью к щелочной
денатурации и др. Кровь новорожденного содержит до 80% HbF, но
к концу 1-го года жизни он почти целиком заменяется на НbА (все же
в крови взрослого человека открывается до 1,5% HbF от общего количества
гемоглобина). Последовательность аминокислот в γ- и δ-цепях гемогло-
бинов окончательно не расшифрована.
Болезни гемоглобинов (их насчитывают более 200) называют гемогло-
бинозами. Принято делить их на гемоглобинопатии, в основе развития
которых лежит наследственное изменение структуры какой-либо цепи
82. Нормальные и серповидные эритроциты.
нормального гемоглобина (часто их относят также к «молекулярным
болезням»), и талассемии, обусловленные наследственным нарушением
синтеза какой-либо нормальной цепи гемоглобина. Различают также же-
лезодефицитные анемии.
Классическим примером наследственной гемоглобинопатии является
серповидно-клеточная анемия, широко распространенная в странах
Южной Америки, Африки и Юго-Восточной Азии. При этой патологии
эритроциты в условиях низкого парциального давления кислорода прини-
мают форму серпа .Гемоглобин S, как показали Л. Полинг и др.,
отличается рядом свойств от нормального гемоглобина: в частности, после
отдачи кислорода в тканях он превращается в плохо растворимую дез-
окси-форму и начинает выпадать в осадок в виде веретенообразных
кристаллоидов, названных тактоидами. Последние деформируют клетку
и приводят к массивному гемолизу. Болезнь протекает остро, и дети,
гомозиготные по мутантному гену, часто умирают в раннем возрасте.
Химический дефект при серповидно-клеточной анемии был раскрыт
В. Ингремом и сводится к замене единственной аминокислоты, а именно
глутаминовой, в 6-м положении с N-конца на валин в β-цепях молекулы
гемоглобина HbS .Это результат мутации в молекуле
ДНК, кодирующей синтез β-цепи гемоглобина. Все остальные аминокис-
лоты располагаются в той же последовательности и в таком же количестве,
как и в нормальном гемоглобине НЬА:
Одной этой замены оказалось достаточно не только для нарушения
формы эритроцита, но и для развития тяжелой наследственной болез-
ни – серповидно-клеточной анемии
2 (1). Конформация белковой молекулы (вторичная и третичная структуры). Типы внутримолекулярных связей в белках. Фибриллярные и глобулярные белки (примеры). Четвертичная структура белка. Примеры строения и функционирования олигомерных белков.
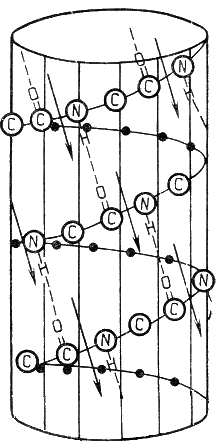
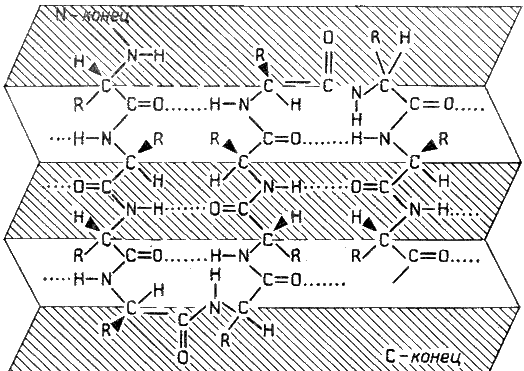
Вторичная структура белка представляет собой способ свёртывания полипептидной цепи в спиральную или иную конформацию. При этом образуются водородные связи между СО- и NH-группами пептидного остова одной цепи или смежных полипептидных цепей. Известно несколько типов вторичной структуры пептидных цепей, среди которых главными являются α--спираль и β-складчатый слой.
α-Спираль - жёсткая структура, имеет вид стержня . Внутреннюю часть этого стержня создаёт туго закрученный пептидный остов, радикалы аминокислот направлены наружу. При этом CO-группа каждого аминокислотного остатка взаимодействует с NH-группой четвёртого от него остатка. На один виток спирали приходится 3,6 аминокислотных остатка, а шаг спирали составляет 0,54 нм. Некоторые аминокислоты препятствуют свёртыванию цепи в α-спираль, и в месте их расположения непрерывность спирали нарушается. К этим аминокислотам относятся пролин (в нём атом азота входит в состав жёсткой кольцевой структуры и вращение вокруг связи N - Са становится невозможным) , а также аминокислоты с заряженными или объёмными радикалами, которые электростатически или механически препятствуют формированию α-спирали.
Β-Складчатый слой отличается от α-спирали тем, что имеет плоскую, а не стержневидную форму. Образуется при помощи водородных связей в пределах одной или нескольких полипептидных цепей. Пептидные цепи могут быть расположены в одном направлении (параллельно) или в противоположных направлениях (антипараллельно) , напоминая меха аккордеона. Боковые радикалы находятся выше и ниже плоскости слоя.
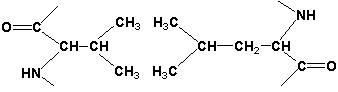
Третичная структура белка - это распределение в пространстве всех атомов белковой молекулы, или иначе говоря, пространственная упаковка спирализованной полипептидной цепи. Основную роль в образовании третичной структуры белка играют водородные, ионные, гидрофобные и дисульфидные связи, которые образуются в результате взаимодействия между радикалами аминокислот.
Водородные связи образуются между двумя полярными радикалами, один из которых может иметь заряд.
Ионные связи могут возникать между противоположно заряженными радикалами.
Гидрофобные взаимодействия характерны для неполярных радикалов.
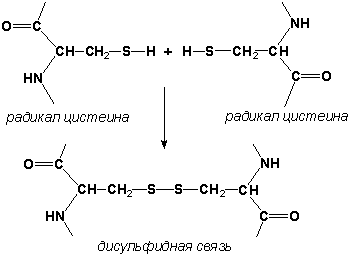
Дисульфидные связи образуются между SH-группами двух радикалов цистеина, находящихся в разных участках полипептидной цепи.
По форме молекулы и особенностям формирования третичной структуры белки делят на фибриллярные и глобулярные.
Фибриллярные белки - имеют нитевидную форму (фибриллы), образуют волокна и пучки волокон. Между соседними полипептидными цепями имеется много поперечных ковалентных сшивок. Нерастворимы в воде. Переходу в раствор препятствуют неполярные радикалы аминокислот и сшивки между пептидными цепями. В организме выполняют главным образом структурную функцию, обеспечивают механическую прочность тканей.
Примеры фибриллярных белков:
Коллаген - белок соединительной ткани. В его составе преобладают аминокислоты глицин, пролин, гидроксипролин.
Эластин - более эластичен, чем коллаген, входит в состав стенок артерий, лёгочной ткани, в его составе преобладают аминокислоты глицин, аланин, валин.
Кератин - белок эпидермиса и производных кожи, в его структуре преобладает аминокислота цистеин.
Глобулярные белки - имеют сферическую или эллипсовидную форму молекулы (глобула). В процессе образования глобулы гидрофобные радикалы аминокислот погружаются во внутренние области, гидрофильные радикалы располагаются на поверхности молекулы. При взаимодействии с водной фазой полярные радикалы образуют многочисленные водородные связи. Белки удерживаются в растворённом состояния за счёт заряда и гидратной оболочки. В организме глобулярные белки выполняют динамические функции (транспортную, ферментативную, регуляторную, защитную).
Примеры глобулярных белков:
Альбумин - белок плазмы крови; содержит много остатков глутамата и аспартата; осаждается при 100%-ном насыщении раствора сульфатом аммония.
Глобулины - белки плазмы крови; по сравнению с альбумином обладают большей молекулярной массой и содержат меньше остатков глутамата и аспартата, осаждаются при 50%-ном насыщении раствора сульфатом аммония.
Гистоны - входят в состав ядер клеток, где образуют комплекс с ДНК. Содержат много остатков аргинина и лизина.
Молекулярные глобулы ряда белков, таких как иммуноглобулины, состоят из нескольких независимых, компактно свёрнутых фрагментов полипептидной цепи, которые называют доменами. Доменные белки являются как бы переходной формой к следующему уровню структурной организации белка.
|
Принято выделять четыре уровня структурной организации белковой молекулы: первичная, вторичная, третичная и четвертичная структура. Рассмотрим особенности каждого из этих уровней. 1. Первичной структурой белка называют последовательность чередования аминокислот в полипептидной цепи. Эту структуру формируют пептидные связи между α-амино- и α-карбоксильными группами аминокислот (см. раздел 1.2 настоящего курса). Первичная структура каждого белка уникальна и запрограммирована генетически. Выяснение аминокислотной последовательности белков представляет интерес по ряду причин. Во-первых, даже небольшие изменения первичной структуры белка в результате генных мутаций могут значительно изменять его свойства. Это приводит к нарушению нормальной функции белка, а следовательно, к развитию заболевания. Примеры заболеваний, развивающихся в результате изменения первичной структуры ферментного белка, будут рассмотрены в 5-й теме настоящего курса. Во-вторых, знание аминокислотной последовательности важно для выяснения молекулярной основы биологической активности белка. В-третьих, сравнительное изучение последовательностей аминокислот в белках позволяет проследить эволюцию форм жизни на молекулярном уровне. В-четвёртых, это необходимо для выяснения тех принципов, на основе которых из полипептидных цепей формируются высокоспецифичные пространственные структуры. Установлено, что последовательность аминокислотных остатков полипептидной цепи белка несёт в себе информацию, необходимую для формирования пространственной структуры белковой молекулы. Процесс сворачивания полипептидной цепи в правильную трёхмерную структуру получил название фолдинг. До последнего времени считалось, что формирование пространственной структуры белка происходит самопроизвольно, в отсутствие каких-либо компонентов. Однако сравнительно недавно выяснилось, что это справедливо только для относительно небольших белков (порядка 100 аминокислотных остатков). Для фолдинга крупных белков необходимы специальные протеины — шапероны, которые создают возможность быстрого формирования правильной пространственной структуры белка. 2. Вторичная структура белка представляет собой способ свёртывания полипептидной цепи в спиральную или иную конформацию. При этом образуются водородные связи между СО- и NН-группами пептидного остова одной цепи или смежных полипептидных цепей. Известны три основных типа вторичной структуры пептидных цепей: α-спираль, β-складчатый слой и неупорядоченный клубок (см. таблицу 1.2). Таблица 1.2 Основные типы вторичной структуры белка и их характеристика
Обратите внимание на то, что тип вторичной структуры белка определяется его первичной структурой. Например, в месте расположения остатка пролина (атомы пирролидинового кольца в пролине лежат в одной плоскости) пептидная цепь делает изгиб, и водородные связи между аминокислотами не образуются. Поэтому белки с высоким содержанием пролина (например, коллаген) не способны образовывать a-спираль. Радикалы аминокислот, несущие электрический заряд, также препятствуют спирализации. Если в пределах одного витка (примерно 4 аминокислотных остатка) находятся два таких радикала (или более), они взаимодействуют и деформируют спираль. 3. Третичная структура белка – это пространственная ориентация полипептидной спирали. Основную роль в образовании третичной структуры белка играют водородные, ионные, гидрофобные и дисульфидные связи, которые образуются в результате взаимодействия между радикалами аминокислот. Водородные связи образуются между двумя полярными незаряженными радикалами, например, радикалами серина и глутамина:
Ионные связи могут возникать между противоположно заряженными радикалами, например, радикалами глутамата и аргинина:
Гидрофобные взаимодействия характерны для неполярных радикалов, например, валина и лейцина:
Дисульфидные связи образуются между SН-группами двух радикалов цистеина, находящихся в разных участках полипептидной цепи:
По форме молекулы и особенностям формирования третичной структуры белки делят на глобулярные и фибриллярные. Познакомьтесь с особенностями этих групп белков, научитесь давать их характеристику, запомните примеры (таблица 1.3). Таблица 1.3 Характеристика глобулярных и фибриллярных белков
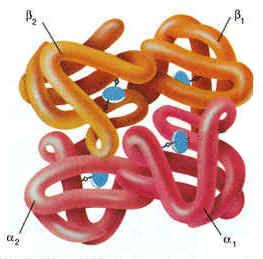
4. Четвертичная структура белка – размещение в пространстве взаимодействующих между собой нескольких полипептидных цепей белка. Четвертичная структура - высший уровень организации белковой молекулы — более половины известных белков её не имеют. Белки, обладающие четвертичной структурой, называют также олигомерными белками, а полипептидные цепи, входящие в их состав, — субъединицами или протомерами. В некоторых белках такие субъединицы одинаковы или имеют сходное строение, а другие белки состоят из субъединиц с цепями разных типов. Каждый из протомеров синтезируется в виде отдельной полипептидной цепи, которая сворачивается в глобулу и затем соединяется с другими протомерами. Объединение идёт путём самосборки. Каждый из протомеров содержит участки, комплементарные другим протомерам. Взаимодействие между контактными участками протомеров происходит при помощи гидрофобных, ионных и водородных связей. Олигомерные белки имеют несколько устойчивых конформаций и обладают аллостерическими свойствами, то есть способны обратимо переходить из одной конформации в другую с изменением своей функциональной активности. Примером таких белков может служить эритроцитарный белок гемоглобин. Многие ферменты также характеризуются аллостерическими свойствами. Более подробно функционирование аллостерических белков будет рассмотрено в 3-й теме настоящего курса.
Рисунок 1.4. Пространственное строение гемоглобина. В состав его молекулы входят четыре попарно одинаковые субъединицы, обозначаемые буквами α и β. Небелковая часть гемоглобина — гем — показана синим цветом. Известны некоторые белки, молекула которых состоит из двух или более полипептидных цепей, соединённых дисульфидными связями (например, тромбин — фермент, участвующий в свёртывании крови). Подобные белки нельзя отнести к олигомерным. Такие белки образуются из единой полипептидной цепи в результате частичного протеолиза — локального расщепления пептидных связей. Аллостерическими свойствами, характерными для олигомерных белков, такие белки не обладают. |
ОСОБЕННОСТИ СТРОЕНИЯ И ФУНКЦИОНИРОВАНИЯ ОЛИГОМЕРНЫХ БЕЛКОВ
1.Олигомерные белки могут содержать разное количество протомеров (например, димеры, тетра-меры, гексамеры и т. д.).
2. В состав олигомерных белков могут входить одинаковые или разные протомеры, например го-модимеры - белки содержащие 2 одинаковых протомера, гетеродимеры - белки, содержащие 2 разных протомера.
3. Различные по структуре протомеры могут связывать разные лиганды.
4. Взаимодействие одного протомера со специфическим лигандом вызывает конформационные изменения всего олигомерного белка и изменяет сродство других протомеров к лигандам. Это явление носит название кооперативных изменений конформации протомеров.
5. У олигомерных белков появляется новое по сравнению с одноцепочечными белками свойство — способность к аллостерической регуляции их функций.
Гемоглобин — олигомерный белок, функция которого регулируется различными лигандами.
1.Гемоглобин (НЬ) — сложный олигомерный белок, содержащийся в эритроцитах. Он состоит из 4 протомеров, соединенных нековалентными связями.
2. НЬ — белок, родственный миоглобину. Вторичная и третичная структуры миоглобина и протомеров НЬ очень сходны, несмотря на то что в первичной структуре полипептидных цепей идентичны только 24 аминокислотных остатка (каждый протомер содержит 8 ос-спиралей, обозначаемых буквами от А до Н).
Следовательно, белки, значительно различающиеся по аминокислотной последовательности, могут приобретать сходные пространственные структуры.
3. Каждый протомер НЬ в белке связан с небелковой частью — гемом и 3 другими протомерами.
4. Соединение белковой части НЬ с гемом аналогично таковому у миоглобина: гидрофобные части гема окружены гидрофобными радикалами аминокислот, за исключением Гис F8 и Гис Е7, которые расположены по обе стороны от плоскости гема и играют важную роль в связывании гемоглобина с 02.
Гемоглобины человека
Гемоглобин А — тетрамер: (2а2р). Составляет около 98% гемоглобина эритроцитов взрослого человека.
Гемоглобин А2 — тетрамер (2а28). Его содержание в эритроцитах взрослого человека равно 2%.
Гемоглобин эмбриональный — тетрамер (2а2е). Обнаруживается на ранних этапах развития плода.
Гемоглобин F— тетрамер (2ос2у). Приходит на смену раннему гемоглобину плода на 6-м месяце развития.
3 (1). Биологические функции белков. Роль пространственной организации полипептидной цепи в образовании активных центров. Взаимодействие белков с лигандами. Денатурация белков.
|
Функции белков |
Характеристика функций белков |
Примеры белков, осуществляющих данную функцию |
|
Ферментативная, или каталитичеcкая |
Одна из наиболее распространенных функций белков, которая состоит в ускорении химических превращений (синтез и распад веществ; перенос отдельных групп атомов, электронов от одного вещества к другому) |
Фумаратгидратаза - катализирует обратимое превращение фумарат + Н2О -> малат Цитохромоксидаза - участвует в транспорте электронов на кислород |
|
Гормональная, или регуляторная |
Регуляция обмена веществ внутри клеток и интеграция обмена в разных клетках целого организма |
Инсулин - участвует в регуляции углеводного, белкового, жирового и других обменов Лютропин - участвует в регуляции синтеза прогестерона в желтом теле яичников |
|
Рецепторная |
Избирательное связывание различных регуляторов (гормонов, медиаторов, циклических нуклеотидов) на поверхности клеточных мембран или внутри клетки (цитозольные рецепторы) |
Цитозольный рецептор эстрадиола - связывает эстрадиол внутри клеток, например слизистой матки Глюкагоновый рецептор - связывает гормон глюкагон на поверхности клеточной мембраны, например печени Регуляторная субъединица протеинкиназы - связывает цАМФ внутри клеток |
|
Транспортная |
Связывание и транспорт веществ между тканями и через мембраны клетки |
Липопротеиды - участвуют в переносе липидов между тканями организма Транскортин - переносит кортикостероиды (гормоны коры надпочечников в крови) Миоглобин - переносит кислород в мышечной ткани |
|
Структурная |
Участвуют в построении различных мембран |
Структурные белки митохондрий, плазматической мембраны и т. д. |
|
Опорная, или механическая |
Близкая по назначению к структурной. Обеспечивает прочность опорных тканей, участвуя в построении внеклеточных структур |
Коллаген - структурный элемент опорного каркаса костной ткани, сухожилий Фиброин - участвует в построении оболочки кокона шелкопряда β-Кератин - структурная основа шерсти, ногтей, копыт |
|
Резервная, или трофическая |
Использование белков как запасного материала для питания развивающихся клеток |
Проламины и глютелины - запасной материал семян пшеницы Овальбумин - запасной белок куриного яйца (используется при развитии зародыша) |
|
Субстратно-энергетическая |
Близка к резервной. Белок используется как субстрат (при распаде) для образования энергии. При распаде 1 г белка выделяется 17,1 кДж энергии |
Все белки (поступающие или с пищей, или внутриклеточные), которые распадаются до конечных продуктов (СО2, Н2О, мочевина) |
|
Механохимическая, или сократительная |
Сокращение (механический процесс) с использованием химической энергии |
Миозин - закрепленные нити в миофибриллах Актин - движущиеся нити в миофибриллах |
|
Электроосмотическая |
Участие в образовании разницы электрических зарядов и градиента концентрации ионов на мембране |
Na+, К+ АТФаза - фермент, участвующий в создании разницы концентраций ионов Na+ и К+ и электрического заряда на клеточной мембране |
|
Энерготрансформирующая |
Трансформация электрической и осмотической энергии в химическую энергию (АТФ) |
АТФ-синтетаза - осуществляет синтез АТФ за счет разности электрических потенциалов или градиента осмотической концентрации ионов на сопрягающей мембране |
|
Когенетическая |
Вспомогательная генетическая функция белков (приставка "ко" в переводе с латинского означает совместность действия). Сами белки не являются генетическим (наследственным) материалом, но помогают нуклеиновым кислотам реализовывать способность к самовоспроизведению и переносу информации |
ДНК-полимераза - фермент, участвующий в репликации ДНК ДНК-зависимая РНК-полимераза - фермент, участвующий в переносе информации от ДНК к РНК |
|
Генно-регуляторная |
Способность некоторых белков участвовать в регуляции матричных функций нуклеиновых кислот и переноса генетической информации |
Гистоны - белки, участвующие в регуляции репликации и частично транскрипции участков ДНК Кислые белки - участвуют в регуляции процесса транскрипции отдельных участков ДНК |
|
Иммунологичеcкая, или антитоксическая |
Антитела участвуют в обезвреживании чужеродных антигенов микроорганизмов (токсинов, выделяемых ими) путем образования комплекса антиген - антитело |
Иммуноглобулины А, М, G и др. - выполняют защитную функцию Комплемент - белок, способствующий образованию комплекса - антиген-антитело |
|
Токсигенная |
Некоторые белки и пептиды, выделяемые организмами (в основном микроорганизмами), являются ядовитыми для других живых организмов |
Ботулинический токсин - пептид, выделяемый палочкой ботулизма |
|
Обезвреживающая |
Благодаря функциональным группам белки связывают токсические соединения (тяжелые металлы, алкалоиды), обезвреживая их |
Альбумины - связывают тяжелые металлы, алкалоиды |
|
Гемостатическая |
Участвуют в образовании тромба и остановке кровотечения |
Фибриноген - белок сыворотки крови, полимеризуется в виде сетки, составляющей структурную основу тромба |
Активный центр– участок молекулы фермента, который связывает субстраты и от которого зависит специфичность каталитического действия ферментов; активный центр содержит функциональные группы остатков аминокислот и коферментов, пространственно сближенных и определённым образом ориентированных.
Несмотря на огромное разнообразие структуры ферментов, их специфичности и механизма действия, существует ряд общих закономерностей формирования активных центров.
Во-первых,на активный центр приходится относительно малая часть объёма фермента. Роль остальных аминокислотных остатков, составляющих основную массу фермента, состоит в том, чтобы обеспечить молекуле фермента правильную глобулярную форму.
Во-вторых,активный центр – это сложная трёхмерная структура, и в её образовании принимают участие группы, принадлежащие разным частям линейной последовательности аминокислот. Радикалы аминокислот, образующих активный центр, оказываются вблизи друг от друга в результате формирования третичной структуры белка (рисунок 3.3). Поэтому при воздействии факторов, вызывающих денатурацию (нагревание, концентрированные кислоты и щёлочи) утрачивается конформация активного центра и фермент теряет свою активность.
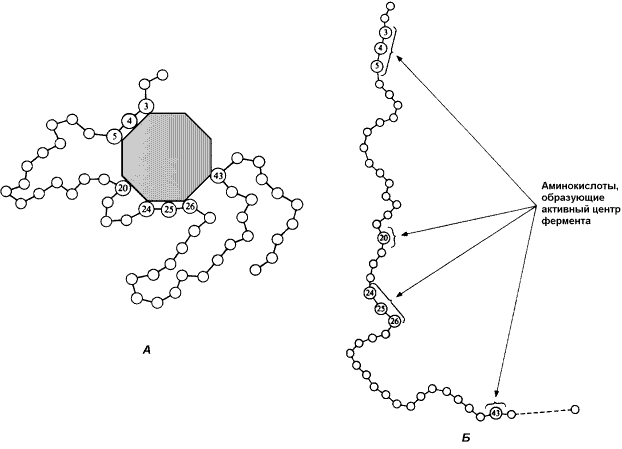
Рисунок 3.3. А. Участие аминокислотных остатков, образующих активный центр фермента, во взаимодействии с субстратом. Б. Положение этих аминокислотных остатков в первичной структуре фермента.
В-третьих,активный центр имеет форму узкого углубления или щели, в которую ограничен доступ воде, за исключением тех случаев, когда вода является одним из реагирующих веществ. В этом углублении присутствует несколько полярных аминокислотных остатков, необходимых для связывания субстрата и катализа.
В-четвёртых,в составе активного центра можно условно выделить две части: а) контактный или якорный участок, где происходит связывание субстрата в нужной ориентации; б) каталитический участок, обеспечивающий протекание реакции.
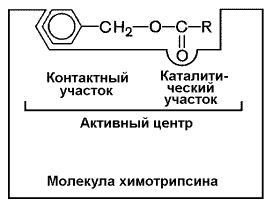
Рисунок 3.4. Состав активного центра фермента (на примере химотрипсина).
В-пятых,субстраты относительно слабо связываются с ферментами. В связывании и превращении субстрата принимают участие следующие группировки аминокислотных радикалов:
полярные заряженные: карбоксильные группы глутамата и аспартата, аминогруппы лизина; гуанидиновые группы аргинина; имидазольные группы гистидина;
полярные незаряженные: гидроксильные группы серина и треонина; сульфгидрильные группы цистеина; фенольные группы тирозина;
неполярные группы: углеводородные цепи алифатических аминокислот; ароматические кольца фенилаланина и триптофана.
У сложных ферментов в формировании активных центров принимают участие также функциональные группы коферментов.
В образовании фермент-субстратных комплексов принимают участие те же молекулярные взаимодействия, что и обеспечивают формирование пространственной структуры макромолекул, межклеточные контакты и другие процессы в биологических системах:
водородные связи между полярными незаряженными группировками субстрата и фермента;
ионные связи между противоположно заряженными группировками субстрата и фермента;
гидрофобные взаимодействия между неполярными группировками субстрата и фермента.
Эти три основных типа нековалентных связей различаются по своей геометрии, энергии, специфичности.
Взаимодействие белков с лигандами
Основным свойством белка, обеспечивающим его функцию, является избирательное взаимодействие с определенным веществом - лигандом.
Лигандами могут быть вещества разной природы, как низкомолекулярные соединения, так и макромолекулы, в том числе и белки. На белковых молекулах есть участки, к которым присоединяется лиганд - центры связывания или активные центры. Центры связывания формируются из аминокислотных остатков, сближенных в результате формирования вторичной и третичной структуры.
Связи между белком и лигандом могут быть нековалентными и ковалентными. Высокая специфичность взаимодействия («узнавания») белка и лиганда обеспечивается комплементарностью структуры центра связывания пространственной структуре лиганда.
Под комплементарностью понимают химическое и пространственное соответствие активного центра белка и лиганда. Взаимодействие между белком Р и лигандом L описывается уравнением:
белок + лиганд↔ белково-лигандный комплекс.
|
1. Главными физико-химическими свойствами белков являются молекулярная масса, электрический заряд и растворимость в воде. Молекулярная масса белков может значительно варьировать. Например, гормон инсулин имеет молекулярную массу около 6 тыс. Да, а иммуноглобулин М - около 1 млн. Да. Молекулярная масса белка зависит от количества аминокислотных остатков, входящих в его состав, а также массы неаминокислотных компонентов. Масса одного остатка аминокислоты в среднем составляет 110 Да. Таким образом, зная количество остатков аминокислот в белке, можно оценить его молекулярную массу и наоборот (Н.Н.Мушкамбаров, 1995). Электрический заряд белка определяется соотношением положительно и отрицательно заряженных групп на поверхности его молекулы. Заряд белковой частицы зависит от рН среды. Для характеристики белка используют понятие «изоэлектрическая точка». Изоэлектрическая точка (pI) — значение pH среды, при котором суммарный заряд белковой частицы равен нулю. В изоэлектрической точке белки наименее устойчивы в растворе и легко выпадают в осадок. Величина pI зависит от соотношения кислых и основных аминокислот в белке. Для белков и пептидов с преобладанием кислых аминокислот (отрицательно заряженных при pH 7,0) значение pI находится в кислой среде; для белков и пептидов с преобладанием основных аминокислот (положительно заряженных при pH 7,0) значение pI находится в кислой среде. Изоэлектрическая точка — характерная константа белков, её значение для большинства белков животных тканей лежит в пределах от 5,5 до 7,0, что свидетельствует о преобладании в их составе кислых аминокислот. Однако в природе имеются белки, у которых значение изоэлектрической точки лежит при крайних значениях pH среды. В частности, величина pI пепсина (фермента желудочного сока) равна 1, в лизоцима (фермента, расщепляющего клеточную стенку микроорганизмов) — около 11. Значения молекулярной массы и изоэлектрической точки некоторых белков приведены в таблице 1.4. Таблица 1.4 Некоторые константы белков плазмы крови и тканей
Растворимость белков в воде. Из курса биофизической химии известно, что белки как высокомолекулярные соединения образуют коллоидные растворы. Стабильность растворов белков в воде определяется следующими факторами:
Имейте в виду, что под действием различных физических и химических факторов может происходить осаждение белков из коллоидных растворов. Различают:
Заметьте, что в основе реакций осаждения белков могут лежать следующие механизмы:
Чаще всего для действия факторов, вызывающих осаждение белков, характерно сочетание двух или всех трёх перечисленных механизмов. Биологическая активность. В основе функционирования любого белка лежит его способность к избирательному взаимодействию со строго определёнными молекулами или ионами — лигандами. Например, для ферментов, катализирующих химические реакции, лигандами будут вещества, участвующие в этих реакциях (субстраты), а также кофакторы, активаторы и ингибиторы. Для транспортных белков лигандами являются транспортируемые вещества и т.д. Лиганд способен взаимодействовать с определённым участком белковой молекулы — центром связывания или активным центром. Этот центр формируется пространственно сближенными радикалами аминокислот на уровне третичной структуры белка. Способность лиганда взаимодействовать с центром связывания обусловлена их комплементарностью, то есть взаимным дополнением их пространственной структуры (подобно взаимодействию «ключ — замок»). Между функциональными группами лиганда и центра связывания образуются нековалентные (водородные, ионные, гидрофобные) связи. Комплементарностью лиганда и центра связывания можно объяснить высокую специфичность (избирательность) взаимодействия белок — лиганд. Итак, различные белки отличаются друг от друга по своим физико-химическим свойствам и биологической активности. На этих различиях основаны методы разделения белковых смесей на фракции и выделения отдельных ферментных белков. Данные методы широко используются в медицинской биохимии и биотехнологии. 2. Денатурация белков – это изменение нативных (природных) физико-химических и, главное, биологических свойств белка вследствие нарушения его четвертичной, третичной и даже вторичной структуры. Денатурацию белка могут вызвать:
Для денатурированных белков характерно:
Обратите внимание, что при определённых условиях возможно восстановление исходной (нативной) конформации белка после удаления фактора, вызвавшего денатурацию. Этот процесс получил название ренативации. Запомните некоторые примеры использования процесса денатурации белков в медицине:
|
4 (1). Гемоглобин - аллостерический белок. Конформационные изменения молекулы гемоглобина. Кооперативный эффект. Регуляторы сродства гемоглобина к кислороду. Структурные и функциональные различия миоглобина и гемоглобина.
Гемоглобин: аллостерический белок Переход в процессе эволюции от мономерного миоглобина к тетрамерному гемоглобину сопровождался появлением новых свойств. Молекула гемоглобина значительно сложнее, чем молекула миоглобина. Прежде всего гемоглобин помимо 02 транспортирует Н+ и С02. Во-вторых, связывание кислорода гемоглобином регулируется специфическими компонентами внутренней среды, а именно Н + , С02 и органическими фосфорными соединениями. Эти регуляторы оказывают сильнейшее влияние на способность гемоглобина связывать кислород, несмотря на то что они присоединяются к белку в участках, отстоящих далеко от гема. Вообще так называемое аллостериче-ское взаимодействие, т.е. взаимодействие между пространственно разделенными участками, имеет место во многих белках. Аллостерические эффекты играют важнейшую роль в регуляции и интеграции молекулярных процессов в биологических системах. Гемоглобин является наиболее изученным аллостерическим белком, и потому имеет смысл более подробно рассмотреть его структуру и функцию.
КОНФОРМАЦИОННЫМИ ИЗМЕНЕНИЯМИ В ГЕМОГЛОБИНЕ
Связывание кислорода сопровождается разрывом солевых
связей, образованных концевыми карбоксильными группами
субъединиц (рис.7) Это облегчает связывание следующих молекул
кислорода, поскольку при этом требуется разрыв меньшего числа
солевых связей. Указанные изменения заметно влияют на
вторичную, третичную и особенно четвертичную структуру
гемоглобина. При этом одна А/В-пара субъединиц поворачивается
относительно другой А/В-пары, что приводит к компактизации
тетрамера и повышению сродства гемов к кислороду (рис. 8 и 9).
КОНФОРМАЦИОННЫЕ ИЗМЕНЕНИЯ В ОКРУЖЕНИЕ ГЕМОГРУППЫ
Оксигенирование гемоглобина сопровождается структурными
изменениями в окружении гемогруппы. При оксигенировании атом
железа, который в дезоксигемоглобине выступал на 0,06 нм из
плоскости гемового кольца, втягивает в эту плоскость (рис.
10). Вслед за атомом железа ближе к гему перемещается
проксимальный гистидин (F8), а также связанные с ним соседние
остатки.
Молекула гемоглобина может находиться в двух формах — напряженной и расслабленной. Расслабленная форма гемоглобина имеет свойство насыщаться кислородом в 70 раз быстрее, чем напряженная. Изменение фракций напряженной и расслабленной формы в общем количестве гемоглобина в крови обусловливает S-образный вид кривой диссоциации оксигемоглобина, а следовательно, так называемое сродство гемоглобина к кислороду. Если вероятность перехода от напряженной формы гемоглобина к расслабленной больше, то возрастает сродство гемоглобина к кислороду, и наоборот. Вероятность образования указанных фракций гемоглобина изменяется в большую или меньшую сторону под влиянием нескольких факторов. Основной фактор — это связывание кислорода с геминовой фуппой молекулы гемоглобина. При этом чем больше геминовых фупп гемоглобина связывают кислород в эритроцитах, тем более легким становится переход молекулы гемоглобина к расслабленной форме и тем выше их сродство к кислороду. Поэтому при низком Р02, что имеет место в метаболически активных тканях, сродство гемоглобина к кислороду ниже, а при высоком Р02 — выше. Как только гемоглобин захватывает кислород, повышается его сродство к кислороду и молекула гемоглобина становится насыщенной при связывании с четырьмя молекулами кислорода. Когда эритроциты, содержащие гемоглобин, достигают тканей, то кислород из эритроцитов диффундирует в клетки. В мышцах он поступает в своеобразного депо кислорода — в молекулы миоглобина, из которого кислород используется в биологическом окислении мышц. Диффузия кислорода из гемоглобина эритроцитов в ткани обусловлена низким Р02 в тканях — 35 мм рт. ст. Внутри клеток тканей напряжение кислорода, необходимое для поддержания нормального метаболизма, составляет еще меньшую величину — не более 1 кПа. Поэтому кислород путем диффузии из капилляров достигает метаболически активных клеток. Некоторые ткани приспособлены к низкому содержанию Р02 в капиллярах крови, что компенсируется высокой плотностью капилляров на единицу объема тканей. Например, в скелетной и сердечной мышцах Р02 в капиллярах может снизиться чрезвычайно быстро во время сокращения. В мышечных клетках содержится белок миоглобин, который имеет более высокое сродство к кислороду, чем гемоглобин. Миоглобин интенсивно насыщается кислородом и способствует его диффузии из крови в скелетную и сердечную мышцы, где он обусловливает процессы биологического окисления. Эти ткани способны экстрагировать до 70 % кислорода из крови, проходящей через них, что обусловлено снижением сродства гемоглобина к кислороду под влиянием температуры тканей и рН. Эффект рН и температуры на сродство гемоглобина к кислороду. Молекулы гемоглобина способны реагировать с ионами водорода, в результате этой реакции происходит снижение сродства гемоглобина к кислороду. При насыщении гемоглобина менее 100 % низкое рН понижает связывание кислорода с гемоглобином — кривая диссоциации оксигемоглобина смещается вправо по оси х. Это изменение свойства гемоглобина под влиянием ионов водорода называется эффектом Бора. Метаболически активные ткани продуцируют кислоты, такую как молочная, и С02. Если рН плазмы крови снижается от 7,4 в норме до 7,2, что имеет место при сокращении мыщц, то концентрация кислорода в ней будет возрастать вследствие эффекта Бора. Например, при постоянном рН 7,4 кровь отдавала бы порядка 45 % кислорода, т. е. насыщение гемоглобина кислородом снижалось до 55 %. Однако когда рН снижается до 7,2, кривая диссоциации смещается по оси х вправо. В результате насыщение гемоглобина кислородом падает до 40 %, т. е. кровь может отдавать в тканях до 60 % кислорода, что на 1/з больше, чем при постоянном рН. Метаболически активные ткани повышают продукцию тепла. Повышение температуры тканей при физической работе изменяет соотношение фракций гемоглобина в эритроцитах и вызывает смещение кривой диссоциации оксигемоглобина вправо вдоль оси х. В результате большее количество кислорода будет освобождаться из гемоглобина эритроцитов и поступать в ткани. Эффект 2,3-дифосфоглицерата (2,3-ДФГ) на сродство гемоглобина к кислороду. При некоторых физиологических состояниях, например при понижении Р02 в крови ниже нормы (гипоксия) в результате пребывания человека на большой высоте над уровнем моря, снабжение тканей кислородом становится недостаточным. При гипоксии может понижаться сродство гемоглобина к кислороду вследствие увеличения содержания в эритроцитах 2,3-ДФГ. В отличие от эффекта Бора, уменьшение сродства гемоглобина к кислороду под влиянием 2,3-ДФГ не является обратимым в капиллярах легких. Однако при движении крови через капилляры легких эффект 2,3-ДФГ на снижение образования оксигемоглобина в эритроцитах (плоская часть кривой диссоциации оксигемоглобина) выражен в меньшей степени, чем отдача кислорода под влиянием 2,3-ДФГ в тканях (наклонная часть кривой), что обусловливает нормальное кислородное снабжение тканей
.
Нативная
трехмерная структура устанавливается
в результате действия целого ряда
энергетических и энтропийных факторов.
Изменение конформационного состояния
молекулы белка за счет различных внешних
воздействий (рН, температура, ионный
состав) отражается и на его функциональной
активности. Конформационные перестройки
происходят весьма быстро. На первых
стадиях они носят локальный
микроконформационный характер, вызывая
смещения лишь отдельных атомных групп.
Распространение таких локальных смещений
на остальные области макромолекулярной
структуры приведет уже к общему
конформационному изменению молекулы
биополимера.
Миоглобин —
состоит из одной полипептидной цепи,
включающей 153 аминокислотных остатка,
и одной железопорфириновой группы (гем)
на молекулу. Миоглобин относится к
гемопротеинам, могущим обратимо связывать
кислород; в клетках скелетной мышцы он
ответствен за резервирование кислорода,
а также за увеличение скорости его
диффузии через клетки. Филогенетически
миоглобин — предшественник гемоглобина.
Молекула не содержит дисульфидиых
связей и характеризуется -спиральностью
на 77%. Гем, ответственный за связывание
кислорода, находится в «гидрофобном
кармане», образованном особыми, для
этого предназначенными аминокислотами.
Гем представляет собой макроцикл
протопорфирина с координационно
связанным ионом двухвалентного железа,
находящимся в центре молекулы. Такая
пространственная фиксация гема делает
возможным связывание молекулы кислорода
в качестве шестого лиганда.
Гемоглобин —
«дыхательный» белок крови. Он осуществляет
транспорт кислорода по кровеносной
системе легких к другим органам и центрам
потребления. Молекула гемоглобина
состоит из четырех попарно идентичных
полипептидных цепей, каждая из которых
несет гем. Полипептидные цепи гемоглобина
называют
и , а
симметричное строение молекулы записывают
как 22. Образование
четвертичной структуры осуществляется
путем гидрофобных взаимодействий между
отдельными полипептидными цепями. При
присоединении кислорода к гему образуется
оксигемоглобин, четвертичная структура
которого лишь незначительно отличается
от неоксигенированной формы.
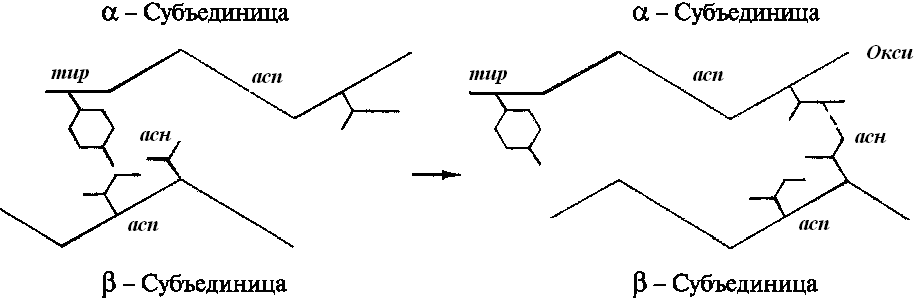 Присоединение
кислорода индуцирует ряд конформационных
изменений в молекуле НЬ. Связывание
кислорода с переводом иона Fe2+ в
низкоспиновое состояние сопровождается
одновременным смещением железа в
плоскость гемовой группы. Происходит
поэтапный разрыв солевых мостиков между
-субъединицами.
Расстояние между гемами --субъединиц
увеличивается, а между гемами -субъединиц
сокращается. В целом оксигенация
переводит каждую из субъединиц из
дезокси- и оксиконформацию. Разрыв
четырех солевых мостиков из шести при
оксигенации первых двух -субъединиц
способствует разрыву двух остальных
мостиков и, следовательно, облегчает
присоединение следующих молекул
кислорода к остальным субъединицам,
увеличивая сродство их к кислороду в
несколько сотен раз. В этом и состоит
кооперативный характере присоединения.
Присоединение
кислорода индуцирует ряд конформационных
изменений в молекуле НЬ. Связывание
кислорода с переводом иона Fe2+ в
низкоспиновое состояние сопровождается
одновременным смещением железа в
плоскость гемовой группы. Происходит
поэтапный разрыв солевых мостиков между
-субъединицами.
Расстояние между гемами --субъединиц
увеличивается, а между гемами -субъединиц
сокращается. В целом оксигенация
переводит каждую из субъединиц из
дезокси- и оксиконформацию. Разрыв
четырех солевых мостиков из шести при
оксигенации первых двух -субъединиц
способствует разрыву двух остальных
мостиков и, следовательно, облегчает
присоединение следующих молекул
кислорода к остальным субъединицам,
увеличивая сродство их к кислороду в
несколько сотен раз. В этом и состоит
кооперативный характере присоединения.
5 (1). Первичная и вторичная структуры ДНК. Правила Чаргаффа. Принцип комплементарности. Типы связей в молекуле ДНК. Биологическая роль ДНК. Молекулярные болезни - следствие генных мутаций.
Первичная структура ДНК - порядок чередования дезоксирибонуклеозидмонофосфатов (дНМФ) в полинукпеотидной цепи.
Каждая фосфатная группа в полинукпеотидной цепи, за исключением фосфорного остатка на 5'-конце молекулы, участвует в образовании двух эфирных связей с участием 3'- и 5'-углеродных атомов двух соседних дезоксирибоз, поэтому связь между мономерами обозначают 3', 5'-фосфодиэфирной.
Концевые нуклеотиды ДНК различают по структуре: на 5'-конце находится фосфатная группа, а на 3'-конце цепи - свободная ОН-группа. Эти концы называют 5'- и 3'-концами. Линейная последовательность дезоксирибонуклеотидов в полимерной цепи ДНК обычно сокращённо записывают с помощью однобуквенного кода, например -A-G-C-T-T-A-C-A- от 5'- к 3'-концу.
В каждом мономере нуклеиновой кислоты присутствует остаток фосфорной кислоты. При рН 7 фосфатная группа полностью ионизирована, поэтому in vivo нуклеиновые кислоты существуют в виде полианионов (имеют множественный отрицательный заряд). Остатки пентоз тоже проявляют гидрофильные свойства. Азотистые основания почти нерастворимы в воде, но некоторые атомы пуринового и пиримидинового циклов способны образовывать водородные связи.
Вторичная структура ДНК. В 1953 г. Дж. Уотсоном и Ф. Криком была предложена модель пространственной структуры ДНК. Согласно этой модели, молекула ДНК имеет форму спирали, образованную двумя полинуклеотидными цепями, закрученными относительно друг друга и вокруг общей оси. Двойная спираль правозакрученная, полинуклеотидньхе цепи в ней антипараллельны(рис. 4-6), т.е. если одна из них ориентирована в направлении 3'→5', то вторая - в направлении 5'→3'. Поэтому на каждом из концов

Рис. 4-6. Двойная спираль ДНК. Молекулы ДНК состоят из двух антипараллельных цепей с комплементарной последовательностью нукпеотидов. Цепи закручены относительно друг друга в правозакрученную спираль так, что на один виток приходится примерно 10 пар нуклеотидов.
молекулы ДНК расположены 5'-конец одной цепи и 3'-конец другой цепи.
Все основания цепей ДНК расположены внутри двойной спирали, а пентозофосфатный остов - снаружи. Полинуклеотидные цепи удерживаются относительно друг друга за счёт водородных связей между комплементарными пуриновыми и пиримидиновыми азотистыми основаниями А и Т (две связи) и между G и С (три связи) (рис. 4-7). При таком сочетании каждая
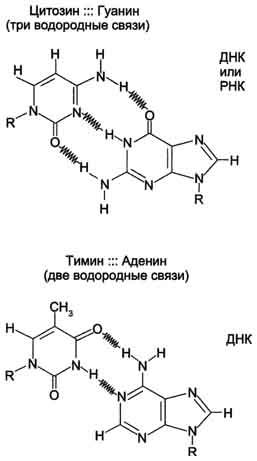
Рис. 4-7. Пурин-пиримидиновые пары оснований в ДНК.
пара содержит по три кольца, поэтому общий размер этих пар оснований одинаков по всей длине молекулы. Водородные связи при других сочетаниях оснований в паре возможны, но они значительно слабее. Последовательность нуклеотидов одной цепи полностью комплементарна последовательности нуклеотидов второй цепи. Поэтому, согласно правилу Чаргаффа (Эрвин Чаргафф в 1951 г. установил закономерности в соотношении пуриновых и пиримидиновых оснований в молекуле ДНК), число пуриновых оснований (А + G) равно числу пиримидиновых оснований (Т + С).
Комплементарые основания уложены в стопку в сердцевине спирали. Между основаниями двухцепочечной молекулы в стопке возникают гидрофобные взаимодействия, стабилизирующие двойную спираль.
Такая структура исключает контакт азотистых остатков с водой, но стопка оснований не может быть абсолютно вертикальной. Пары оснований слегка смещены относительно друг друга. В образованной структуре различают две бороздки - большую, шириной 2,2 нм, и малую, шириной 1,2 нм. Азотистые основания в области большой и малой бороздок взаимодействуют со специфическими белками, участвующими в организации структуры хроматина.
Пра́вила Ча́ргаффа — система эмпирически выявленных правил, описывающих количественные соотношения между различными типами азотистых оснований в ДНК. Были сформулированы в результате работы группы биохимика Эрвина Чаргаффа в 1949—1951 гг.
До работ группы Чаргаффа господствовала так называемая «тетрануклеотидная» теория, согласно которой ДНК состоит из повторяющихся блоков по четыре разных азотистых основания (аденин, тимин, гуанин и цитозин). Чаргаффу и сотрудникам удалось разделить нуклеотиды ДНК при помощи бумажной хроматографии и определить точные количественные соотношения нуклеотидов разных типов. Они значительно отличались от эквимолярных, которых можно было бы ожидать, если бы все четыре основания были представлены в равных пропорциях. Соотношения, выявленные Чаргаффом для аденина (А), тимина (Т), гуанина (Г) и цитозина (Ц), оказались следующими:
Количество аденина равно количеству тимина, а гуанина — цитозину: А=Т, Г=Ц.
Количество пуринов равно количеству пиримидинов: А+Г=Т+Ц.
Количество оснований с аминогруппами в положении 6 равно количеству оснований с кетогруппами в положении 6: А+Ц=Г+Т.
Вместе с тем, соотношение (A+Т):(Г+Ц) может быть различным у ДНК разных видов. У одних преобладают пары АТ, в других — ГЦ.
Правила Чаргаффа, наряду с данными рентгеноструктурного анализа, сыграли решающую роль в расшифровке структуры ДНК Дж. Уотсоном и Фрэнсисом Криком.
Комплемента́рность (в химии, молекулярной биологии и генетике) — взаимное соответствие молекул биополимеров или их фрагментов, обеспечивающее образование связей между пространственно взаимодополняющими (комплементарными) фрагментами молекул или их структурных фрагментов вследствие супрамолекулярных взаимодействий (образование водородных связей, гидрофобных взаимодействий, электростатических взаимодействий заряженных функциональных групп и т. п.).
Взаимодействие комплементарных фрагментов или биополимеров не сопровождается образованием ковалентной химической связи между комплементарными фрагментами, однако из-за пространственного взаимного соответствия комплементарных фрагментов приводит к образованию множества относительно слабых связей (водородных и ван-дер-ваальса) с достаточно большой суммарной энергией, что приводит к образованию устойчивых молекулярных комплексов.
Вместе с тем следует отметить, что механизм каталитичекой активности ферментов определяется комплементарностью фермента и переходного состояния либо промежуточного продукта катализируемой реакции — и в этом случае может происходить обратимое образование химической связи.
Комплементарность нуклеиновых кислот
В случае нуклеиновых кислот — как олиго- так и полинуклеотидов азотистые основания нуклеотидов способны вследствие образования водородных связей формировать парные комплексы аденин—тимин (или урацил в РНК) и гуанин—цитозин при взаимодействии цепей нуклеиновых кислот. Такое взаимодействие играет ключевую роль в ряде фундаментальных процессов хранения и передачи генетической информации: репликации ДНК, обеспечивающей передачу генетической информации при делении клетки, транскрипцииДНК в РНК при синтезе белков, кодируемых ДНК гена, хранении генетической информации в двухцепочечной ДНК и процессах репарации ДНК при её повреждении.
ДНК
Принцип комплементарности используется в синтезе ДНК. Это строгое соответствие соединения азотистых оснований, соединёнными водородными связями, в котором: А-Т (Аденинсоединяется с Тимином) Г-Ц (Гуанин соединяется с Цитозином)
Ферментативный катализ
Комплементарное связывание фермент-субстрат является ключевым фактором в механизме ферментативной активности и, в отличие описанных выше ситуаций с образованием химически несвязанных комплексов может приводить к инициированию химической реакции — в случае связи фермента с субстратом комплементарность относительно невысока, однако при высокой комплементарности к переходному реакционному состоянию субстрата происходит стабилизация этого состояния, что приводит к эффекту каталитической активности ферментов: такая стабилизация переходного состояния эквивалентна снижению энергии активации и, соответственно, резкому увеличению скорости реакции.
Двойная спираль
В зависимости от концентрации ионов и нуклеотидного состава молекулы, двойная спираль ДНК в живых организмах существует в разных формах. На рисунке представлены формы A, B и Z(слева направо)
Полимер ДНК обладает довольно сложной структурой. Нуклеотиды соединены между собой ковалентно в длинныеполинуклеотидные цепи. Эти цепи в подавляющем большинстве случаев (кроме некоторых вирусов, обладающих одноцепочечными ДНК-геномами) попарно объединяются при помощи водородных связей во вторичную структуру, получившую название двойной спирали[3][10]. Остов каждой из цепей состоит из чередующихся фосфатов и сахаров[14]. Внутри одной цепи ДНК соседние нуклеотиды соединены фосфодиэфирными связями, которые формируются в результате взаимодействия между 3'-гидроксильной (3'—ОН) группой молекулы дезоксирибозы одного нукдеотида и 5'-фосфатной группой (5'—РО3) другого. Асимметричные концы цепи ДНК называются 3' (три прим) и 5' (пять прим). Полярность цепи играет важную роль при синтезе ДНК (удлинение цепи возможно только путём присоединения новых нуклеотидов к свободному 3'-концу).
Как уже было сказано выше, у подавляющего большинства живых организмов ДНК состоит не из одной, а из двух полинуклеотидных цепей. Эти две длинные цепи закручены одна вокруг другой в виде двойной спирали, стабилизированнойводородными связями, образующимися между обращёнными друг к другу азотистыми основаниями входящих в неё цепей. В природе эта спираль, чаще всего, правозакрученная. Направления от 3'-конца к 5'-концу в двух цепях, из которых состоит молекула ДНК, противоположны (цепи «антипараллельны» друг другу).
Ширина двойной спирали составляет от 22 до 24 Å, или 2,2 — 2,4 нм, длина каждого нуклеотида 3,3 Å (0,33 нм)[15]. Подобно тому, как в винтовой лестнице сбоку можно увидеть ступеньки, на двойной спирали ДНК в промежутках между фосфатным остовом молекулы можно видеть рёбра оснований, кольца которых расположены в плоскости, перпендикулярной по отношению к продольной оси макромолекулы.
В двойной спирали различают малую (12 Å) и большую (22 Å) бороздки[16]. Белки, например, факторы транскрипции, которые присоединяются к определённым последовательностям в двухцепочечной ДНК, обычно взаимодействуют с краями оснований в большой бороздке, где те более доступны.
Биологическая роль ДНК Функция ДНК в клетке – хранение наследственной информации. Функциональной единицей является ген. Ген – определенная последовательность нуклеотидов (500 – 2000 нуклеотидных единиц) с помощью которых закодирован определенный признак (морфогенез, старение, устойчивость к антибиотикам, половая дифференциация, цвет кожи, глаз). Структурный ген – закодированный признак. Для его функционирования необходимо 2 регуляторных гена: ген – регулятор и ген – оператор (они могут быть рядом, могут быть удалены). Ген – оператор, ген – регулятор и структурный ген вместе составляют оперон. Оперон – функциональная надструктура генетического аппарата. Сколько признаков, сколько оперонов, например, к структурным генам относится гены, ответственные за синтез белка и если белков- 5 миллионов, то оперонов – 5 миллионов.
Молекулярные болезни - это большая группа заболеваний, в основе которых лежат нарушения в структуре молекул ДНК, т.е. генные мутации. Учитывая последнее, эти заболевания называют также генными болезнями. Молекулярные болезни чрезвычайно разнообразны по характеру клинических симптомов, тяжести течения и прогнозу. Точное количество таких заболеваний не известно, однако, исходя из того, что в организме имеется около 30 тыс. генов и, теоретически, каждый из них может мутировать один или несколько раз, можно допустить, что количество возможных генных болезней будет, если не превышать число генов, то, по крайней мере, соответствовать их сумме. По одной из последних сводок известного генетика Мак-Кьюсика (1988, США) в настоящее время описано 2106 аутосомно-доминантных, 1321 аутосомно-рецессивных и 276 X - сцепленных молекулярных заболеваний. В эту сводку вошли только моногенно наследуемые заболевания, подчиняющиеся менделевским закономерностям. Однако, помимо моногенных заболеваний, имеет место большое число молекулярных болезней с полигенным типом наследования (например, гипертоническая болезнь, атеросклероз, диабет, эпилепсия, шизофрения и многие другие). Для этих заболеваний характерна высокая зависимость не только от особенностей генотипа, но и средовых факторов (стрессы, неправильное питание, инфекции, неизвестные агенты). Эти заболевания получили название мультифакториальных. Для этих заболеваний имеются значительные трудности в определении риска рождения больного ребенка, поскольку наследуемость не подчиняется менделевским правилам. При молекулярных болезнях мутации происходят не только в структурных, но и регуляторных генах. Однако, в любом случае, это сопровождается нарушением синтеза каких-либо белков: ферментных, транспортных или структурных. Если блокируются ферментные белки, развиваются различные патологические состояния, получившие название энзимопатии (греч. "энзим" - фермент, "патос" - страдание, болезнь). Следствием энзимопатии являются болезни обмена. Причем, нарушаться может любой вид обмена: аминокислотный, белковый, углеводный, липидный, минеральный и другие. При болезнях обмена, обусловленных отсутствием какого-либо фермента, снижением его активности или уровня содержания в организме, накапливаются вещества, подлежащие расщеплению (например, продукты промежуточного обмена), или же какие-то аномальные продукты. Накапливаясь в организме, они оказывают на него токсическое действие, что приводит к развитию различных патологических признаков. Клинически выраженные симптомы молекулярных болезней могут проявляться в разные периоды онтогенеза. Некоторые из них диагностируются сразу после рождения, поскольку сопровождаются выраженными внутриутробными пороками развития. Другие - проявляют себя в раннем детстве, третьи - на более поздних периодах индивидуального развития, чаще до наступления репродуктивного (детородного) возраста. Многие генные болезни характеризуются нарушениями не только физического, но и психического развития, и, как правило, в большинстве случаев укорачивают жизнь больного, приводят к частичной или полной инвалидности. Характерный для молекулярных болезней полиморфизм (многообразие) патологических симптомов является следствием не только мутаций, происходящих в разных генах, но и особенностями действия на них генов-модификаторов и различных средовых факторов. В итоге при сходном генотипе патологические признаки имеют различную экспрессивность и пенетрантность даже среди ближайших родственников. В то же время сходные симптомокомплексы могут наблюдаться при мутациях различных генов (генокопии). Это объясняется тем, что разные мутации могут нарушать процесс функционирования одного и того же звена. А мутации в пределах одного и того же гена (множественные аллели) могут приводить к формированию различных фенотипов. Например, метгемоглобинемия - это, в отличие от серповидноклеточной анемии, совершенно другое заболевание, хотя мутация в обоих случаях приходится на один и тот же локус. Общая частота молекулярных болезней в человеческих популяциях составляет 1 -2%. Однако доказано то, что среди детей этот показатель в три раза выше, чем среди взрослых. Условно считают частоту генных болезней высокой, если встречается 1 больной на 10 тыс. новорожденных; средней - в случае, если больной приходится на 10-40 тыс. новорожденных, а далее - низкой. Многие молекулярные болезни могут лечиться при условии, что лечение начато своевременно. В связи с этим разработаны просеивающие программы (скрининг-программы) по раннему выявлению наиболее часто встречающихся генных болезней. Для этого используются простые биохимические методы диагностики, с помощью которых в крови, моче, околоплодных водах при массовых обследованиях определяются аномальные продукты обмена. Скрининговые методы качественные и должны быть специфичными. Важно правильно выбрать время скрининга: в доклинический период развития заболевания, т.е. в досимптомный период, когда возможно эффективное лечение. Кроме чисто биохимических методов, в состав просеивающих программ включают такие специальные методы, как микробиологические тесты, электрофорез, хроматография, радио-иммунологический метод. В практике мирового здравоохранения используются 2 типа просеивающих программ. 1.Среди новорожденных на нарушение аминокислотного обмена - аминоацидопатии, галактоземию, гипотиреоз, муковисцидоз и недостаточность α1 – антитрипсина. 2.Среда определенных расовых и национальных групп на гетерозиготное носительство болезни Тея-Сакса, серповидно-клеточной анемии и талассемии. Кроме того, показанием к скринингу у новорожденных в любом случае служат такие нарушения, как судороги, летаргия, кома, трудности кормления, рвота, двигательные беспокойства, необычный запах, катаракта и др.
6 (1). Роль ферментов в метаболизме. Многообразие ферментов. Специфичность действия ферментов. Классификация ферментов. Изоферменты, мультиферменты.
Все химические реакции в клетке протекают при участии ферментов. Поэтому, чтобы воздействовать на скорость протекания метаболического пути, достаточно регулировать количество или активность ферментов. Обычно в метаболических путях есть ключевые ферменты, благодаря которым происходит регуляция скорости всего пути. Эти ферменты (один или несколько в метаболическом пути) называются регуляторными ферментами; они катализируют, как правило, начальные реакции метаболического пути, необратимые реакции, скорость-ли-митирующие реакции (самые медленные) или реакции в месте переключения метаболического пути (точки ветвления).
Регуляция скорости ферментативных реакций осуществляется на 3 независимых уровнях:
изменением количества молекул фермента;
доступностью молекул субстрата и кофер-мента;
изменением каталитической активности молекулы фермента.
110

Роль аллостерических ферментов в метаболизме клетки. Аллостерические ферменты играют важную роль в метаболизме, так как они чрезвычайно быстро реагируют на малейшие изменения внутреннего состояния клетки. Аллостерическая регуляция имеет большое значение в следующих ситуациях:
при анаболических процессах. Ингибирование конечным продуктом метаболического пути и активация начальными метаболитами позволяют осуществлять регуляцию синтеза этих соединений;
при катаболических процессах. В случае накопления АТФ в клетке происходит ингибирование метаболических путей, обеспечивающих синтез энергии. Субстраты при этом расходуются на реакции запасания резервных питательных веществ;
для координации анаболических и катаболических путей. АТФ и АДФ - аллостерические эффекторы, действующие как антагонисты;
для координации параллельно протекающих и взаимосвязанных метаболических путей (например, синтез пуриновых и пиримидиновых нуклеотидов, используемых для синтеза нуклеиновых кислот). Таким образом, конечные продукты одного метаболического пути могут быть аллостерическими эффекторами другого метаболического пути.
Аллостерические эффекторы. Эффектор, вызывающий снижение (ингибирование) активности фермента, называют отрицательным эффектором, или ингибитором. Эффектор, вызьгоаюший повышение (активацию) активности ферментов, называют положительным эффектором, или активатором.
Аллостерическими эффекторами часто служат различные метаболиты. Конечные продукты метаболического пути - часто ингибиторы аллостерических ферментов, а исходные вещества - активаторы. Это так называемая гетеротропная регуляция. Такой вид аллостерической регуляции очень распространён в биологических системах.
Более редкий случай аллостерической регуляции, когда сам субстрат может выступать в качестве положительного эффектора. Такая регуляция называется гомотропной (эффектор и субстрат - одно и то же вещество). Эти ферменты имеют несколько центров связывания для субстрата, которые могут выполнять двойную функцию: каталитическую и регуляторную. Аллостерические ферменты такого типа используются в ситуации, когда субстрат накапливается в избытке и должен быстро преобразоваться в продукт.
Выявить ферменты с аллостерической регуляцией можно, изучая кинетику этих ферментов. Эти ферменты не подчиняются законам Михаэлиса-Ментен, они имеют характерную S-образную кривую зависимости скорости реакции от концентрации субстрата.
Особенности строения и функционирования аллостерических ферментов:
обычно это олигомерные белки, состоящие из нескольких протомеров или имеющие доменное строение;
они имеют аллостерический центр, пространственно удалённый от каталитического активного центра;
эффекторы присоединяются к ферменту нековалентно в аллостерических (регуляторных) центрах;
аллостерические центры, так же, как и каталитические, могут проявлять различную
112
специфичность по отношению к лигандам: она может быть абсолютной и групповой. Некоторые ферменты имеют несколько аллостерических центров, одни из которых специфичны к активаторам, другие - к ингибиторам.
протомер, на котором находится аллостерический центр, - регуляторный протомер, в отличие от каталитического протомера, содержащего активный центр, в котором проходит химическая реакция;
аллостерические ферменты обладают свойством кооперативности: взаимодействие аллостерического эффектора с аллостерическим центром вызывает последовательное кооперативное изменение конформации всех субъединиц, приводящее к изменению конформации активного центра и изменению сродства фермента к субстрату, что снижает или увеличивает каталитическую активность фермента (рис. 2-30);
регуляция аллостерических ферментов обратима: отсоединение эффектора от регуляторной субъединицы восстанавливает исходную каталитическую активность фермента;
аллостерические ферменты катализируют ключевые реакции данного метаболического пути.
Локализация аллостерических ферментов в метаболическом пути. Скорость метаболических процессов зависит от концентрации веществ, использующихся и образующихся в данной цепи реакций. Такая регуляция представляется
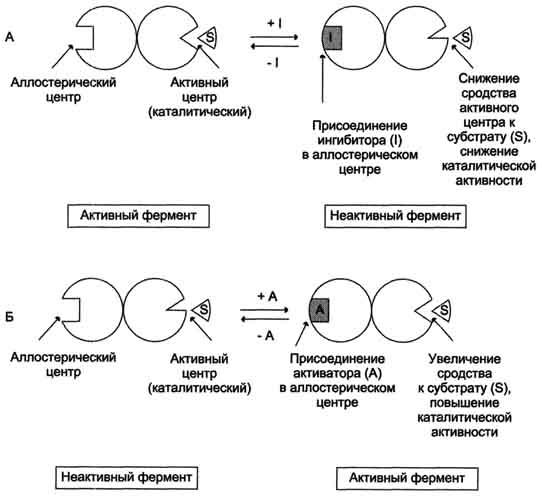
Рис. 2-30. Схема, поясняющая работу аллостерического фермента. А - действие отрицательного эффектора (ингибитора); Б - действие положительного эффектора (активатора).
113
логичной, так как при накоплении конечного продукта он (конечный продукт) может действовать как аллостерический ингибитор фермента, катализирующего чаще всего начальный этап данного метаболического пути:

Фермент, катализирующий превращение субстрата А в продукт В, имеет аллостерический центр для отрицательного эффектора, которым служит конечный продукт метаболического пути F. Если концентрация F увеличивается (т.е. вещество F синтезируется быстрее, чем расходуется), ингибируется активность одного из начальных ферментов. Такую регуляцию называют отрицательной обратной связью, или ретроингибировани-ем. Отрицательная обратная связь - часто встречающийся механизм регуляции метаболизма в клетке.
В центральных метаболических путях исходные вещества могут быть активаторами ключевых ферментов метаболического пути. Как правило, при этом аллостерической активации подвергаются ферменты, катализирующие ключевые реакции заключительных этапов метаболического пути:
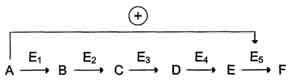
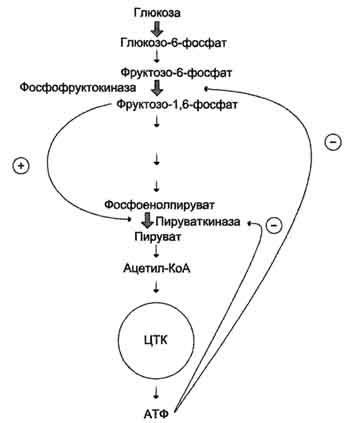
В качестве примера можно рассмотреть принципы регуляции гликолиза - специфического (начального) пути распада глюкозы (рис. 2-31). Один из конечных продуктов распада глюкозы - молекула АТФ. При избытке в клетке АТФ происходит ретро-ингибирование аллостерических ферментов фосфофруктокиназы и пируваткиназы. При образовании большого количества фруктозо-1,6-бисфосфата наблюдают аллостерическую активацию фермента пируваткиназы.
Многообразие ферментов, их классификация
Названия ферментов производят от названий субстратов, на которые они действуют, по схеме: тип катализируемой данным ферментом реакции + название одного из продуктов реакции (или одного из ее участников) с прибавлением окончания -аза. Окончание -аза служит для обозначения ферментной природы. Например: фермент молочная оксидаза (другое название – дегидрогеназа) катализирует превращение молочной кислоты в уксусную.
По названию фермента можно понять сущность реакции.
Почти каждая химическая реакция в клетке катализируется особым ферментом. Число реакций в клетке достигает нескольких тысяч. Соответственно, в клетке обнаружено несколько тысяч ферментов. И чтобы не запутаться в их многообразии, их классифицируют.
Давайте поработаем с опорным конспектом и учебником: назовите группу ферментов и укажите их функцию (фронтальная работа – по цепочке)
|
Группа |
Катализируемая реакция |
|
Оксидо-редуктазы |
480 ферментов. Катализируют ОВ-реакции в живой клетке - дыхание, брожение, гликолиз. |
|
Трансферазы |
Перенос определенных групп атомов от одного вещества к другому |
|
Гидролазы. |
460 ферментов, к ним относятся пищеварительные ферменты, входящие в состав лизосом и других органоидов, где они способствуют распаду более крупных биомолекул на простые. Катализируют реакции гидролиза, при которых из субстрата образуются два продукта. |
|
Лиазы. |
230 ферментов. Катализируют реакции негидролитического расщепления. Различают С-С-лиазы С-О-лиазы C-N-лиазы |
|
Изомеразы. |
80 ферментов Ферменты, катализирующие превращения в пределах одной молекулы (реакции изомеризации), они вызывают внутримолекулярные перестройки. |
|
Лигазы (синтетазы) |
Около 80 ферментов. Катализируют реакции синтеза.
|
Специфичность действия ферментов
Наиболее характерная черта, отличающая ферменты от других катализаторов — высокая специфичность их действия. Активный центр ферментов, как и других белков, образован боковыми группами аминокислотных остатков пептидной цепи. Строение активных центров ферментов, катализирующих разные реакции, различно.
Действие ферментов.
Структура активного центра фермента комплементарна структуре его субстрата, вследствие чего данный фермент из множества веществ, имеющихся в живой клетке, присоединяет только свой субстрат. Эту особенность называют субстратной специфичностью фермента. Например, структура активного центра фермента гистидазы комплементарна структуре аминокислоты гистидина, поэтому возможно образование фермент-субстратного комплекса гистидаза—гистидин; другие вещества, в том числе аминокислоты, не связываются гистидазой. Кроме того, часть функциональных групп активного центра ферментов имеет такое строение и реакционную способность, что обеспечивается химическое превращение субстрата в новые вещества — продукты ферментативной реакции. Каждый фермент катализирует не любое из всех возможных химических превращений субстрата, а какое-либо одно. Назовем это свойство специфичностью пути превращения.Жиры — это группа соединений, отдельные представители которых различаются природой жирно-кислотных остатков (радикалов R). Липаза расщепляет жиры, включающие разные жирно-кислотные остатки. Другой пример групповой специфичности — действие ферментов, гидролизующих пептиды и белки: многие из этих ферментов расщепляют пептидные связи, образованные разными аминокислотами. Пространственная структура стереоизомеров вещества различна, поэтому активный центр фермента, комплементарный одному стереоизомеру, не обязательно будет комплементарен и другим стереоизомерам. В связи с этим многие ферменты катализируют превращение лишь одного из стереоизомеров — стереоспецифич-ность. Например, малеиновая кислота, являющаяся г^оизомером фумаровой кислоты (рис. 2.3), не может быть субстратом фумаразы.
|
В основу классификации положен важнейший признак, по которому один фермент отличается от другого — это катализируемая им реакция. Число типов химических реакций сравнительно невелико, что позволило разделить все известные в настоящее время ферменты на 6 важнейших классов, в зависимости от типа катализируемой реакции. Такими классами являются:
Ферменты каждого класса делят на подклассы, руководствуясь строением субстратов. В подклассы объединяют ферменты, действующие на сходно построенные субстраты. Подклассы разбивают на подподклассы, в которых ещё строже уточняют структуру химических групп, отличающих субстраты друг от друга. Внутри подподклассов перечисляют индивидуальные ферменты. Все подразделения классификации имеют свои номера. Таким образом, любой фермент получает свой уникальный кодовый номер, состоящий из четырёх чисел, разделённых точками. Первое число обозначает класс, второе - подкласс, третье - подподкласс, четвёртое - номер фермента в пределах подподкласса. Например, фермент α-амилаза, расщепляющая крахмал, обозначается как 3.2.1.1, где: 3 — тип реакции (гидролиз); 2 — тип связи в субстрате (гликозидная); 1 — разновидность связи (О-гликозидная); 1 — номер фермента в подподклассе (рисунок 3.2). Вышеописанный десятичный способ нумерации имеет одно важное преимущество: он позволяет обойти главное неудобство сквозной нумерации ферментов, а именно: необходимость при включении в список вновь открытого фермента изменять номера всех последующих. Новый фермент может быть помещён в конце соответствующего подподкласса без нарушения всей остальной нумерации. Точно так же при выделении новых классов, подклассов и подподклассов их можно добавлять без нарушения порядка нумерации ранее установленных подразделений. Если после получения новой информации возникает необходимость изменить номера некоторым ферментам, прежние номера не присваивают новым ферментам, чтобы избежать недоразумений. Говоря о классификации ферментов, следует также отметить, что ферменты классифицируются не как индивидуальные вещества, а как катализаторы определённых химических превращений. Ферменты, выделенные из разных биологических источников и катализирующие идентичные реакции, могут существенно отличаться по своей первичной структуре. Тем не менее в классификационном списке все они фигурируют под одним и тем же кодовым номером. Знание кодового номера фермента позволяет:
|
|
Изоферменты (изозимы) Изоферментами или изозимами называют множественные формы ферментов, которые существуют у одного и того же вида, в одной и той же ткани, и даже в одной и той же клетке. Все эти формы фермента катализируют одну и ту же реакцию, но различаются по своим кинетическим свойствам, а также по первичной структуре. Изоферменты играют регуляторную роль в обмене веществ и позволяют метаболизму в разных тканях лучше приспосабливаться к действию внутренних и внешних факторов. Примером фермента, у которого были обнаружены такие формы, может служить лактатдегидрогеназа (L-лактат:НАД+-оксидоредуктаза, КФ 1.1.1.27), катализирующая обратимую окислительно-восстановительную реакцию:
Лактатдегидрогеназа (ЛДГ) присутствует в тканях животных в виде пяти разных изоферментов, которые различаются на уровне четвертичной структуры. Молекула ЛДГ состоит из четырех протомеров двух типов, Н (от англ. heart - сердце) и М (от англ. muscle - мышца), которые различаются по аминокислотному составу и последовательности аминокислот. Каталитической активностью обладает только тетрамерная молекула. Протомеры могут быть скомпонованы следующими способами:
Изоферменты сывороточной лактатдегидрогеназы могут быть обнаружены с помощью электрофореза при рН 8,6. При данном значении рН изозимы несут разный заряд и распределяются на электрофореграмме в пяти разных местах. Наибольшим отрицательным зарядом обладает изозим ЛДГ1. Распределение изоферментов ЛДГ (изоферментный спектр) в тканях также отличается. Так, изоформа ЛДГ, содержащая четыре М-субъединицы, преобладает в печени и скелетной мышце, а изоформа, состоящая из четырех Н-субъединиц, преобладает в миокарде (рисунок 4.3).
Рисунок 4.3. Относительное содержание изоферментов ЛДГ (в процентах от суммарной активности) в некоторых тканях человека (Мосс, Баттерворт, 1978). Мультиферменты Мультиферменты (мультэнзимы) - надмолекулярные комплексы, в состав которых входят ферменты, катализирующие последовательные стадии превращения субстрата. Например, для в реакциях превращения метаболита A в метаболит D :
комплекс ферментов Е1, Е2, Е3 является мультиферментом. Объединение нескольких ферментов в один комплекс имеет важное преимущество: резко сокращаются расстояния, на которые молекулы промежуточных продуктов должны перемещаться от фермента к ферменту. Поэтому суммарная скорость таких метаболических путей довольно высока. Примером мультэнзима может служить пируватдегидрогеназный комплекс, находящийся в митохондриях и катализирует последовательные реакции окислительного декарбоксилирования пирувата:
Пируватдегидрогеназный комплекс состоит из трёх ферментов: пируватдекарбоксилазы, трансацилазы и дигидролипоилдегидрогеназы.
В промежуточных реакциях участвует пять коферментов:
Регуляторным ферментом комплекса является пируватдекарбоксилаза, активность которой (и всего комплекса в целом) снижается при высокой концентрации АТФ в клетке. |
7 (1). Механизм действия ферментов. Каталитический (активный) центр. Коферменты и кофакторы. Конкурентное и неконкурентное ингибирование. Использование конкурентных ингибиторов как лекарственных препаратов
Механизм действия ферментов
Различают три стадии в механизме ферментативного катализа:
образование фермент-субстратного комплекса;
образование комплекса «фермент-продукт реакции»;
отщепление продуктов реакции от фермента.
Первая стадия фермент отличается от белка наличием АЦ — участка, с помощью которого фермент соединяется с субстратом и ускоряет реакцию. Долгое время считали, что между ферментом и субстратом имеется точное соответствие («ключ к замку»). Однако сейчас принято считать, что АЦ фермента приспосабливается к субстрату в ходе реакции (теория вынужденного соответствия). В АЦ имеются якорные участки, за счет которых субстрат закрепляется. Каталитический участок АЦ ответственен за тип ускоряемой реакции
Вторая стадия – функционально-активные группы АЦ фермента действуют на субстрат, дестабилизируя связи в нем, вызывая изменение конфигурации субстрата, поляризацию его молекулы, растяжение связей и т.д. Это приводит к химическому преобразованию субстрата (т.е. к протеканию реакции) и образованию продуктов реакции, которые некоторое время находятся в связи с ферментом
Третья стадия – от нее зависит скорость реакции. Происходит отделение фермента от продуктов реакции