
Лекции / Лекция по эх №1
.docxЭлектрохимические методы в аналитической химии
Лекция №1 (для группы ХИМ-Б18)
Введение
Измерение электрических величин для определения состава вещества является одним из важнейших приемов аналитической химии. Все электрохимические измерения проводятся с использованием электрохимической ячейки – специального устройства, состоящего из двух или более электродов и анализируемого раствора или расплава. На электродах происходят различные физические и химические процессы, о степени протекания которых можно судить путем измерения напряжения, силы тока, электрического сопротивления, электрического заряда или подвижности заряженных частиц в электрическом поле. Определяемое вещество при этом находится в электролите, в фазе электрода или на его поверхности. Растворы и расплавы электролитов являются проводниками второго рода, поэтому процессы, происходящие в них, можно охарактеризовать с помощью всех вышеперечисленных электрических показателей, величины которых будут непосредственно связаны с концентрацией электролитов. Электрод, непосредственно реагирующий на изменение концентрации анализируемого вещества (аналита) в растворе, называется индикаторным, если в процессе измерения не происходит существенного изменения концентрации аналита (равновесные методы), или рабочим, если концентрация аналита за время измерения изменяется (неравновесные методы). Другой электрод в измерительной ячейке – электрод сравнения, потенциал которого не изменяется в процессе выполнения анализа, поэтому по измеренной разности потенциалов между обоими электродами можно судить о потенциале индикаторного электрода.
Электрохимическая ячейка с точки зрения общей теории измерений является первичным преобразователем информации о химическом составе фаз, участвующих в электродном процессе, или датчиком. Электрохимическая ячейка непосредственно подключается к измерительному прибору (вторичному преобразователю), регистрирующему электрический параметр процесса, который и является аналитическим сигналом в конкретном аналитическом методе. Электрохимические ячейки подразделяются на гальванические и электролитические. В гальванических (термодинамически обратимых) ячейках в условиях электрохимического равновесия происходит полное превращение свободной химической энергии окислительно-восстановительной реакции в электрическую. В электролитических ячейках протекание электрохимической реакции обусловлено внешними факторами – наложением внешней разности потенциалов или пропусканием тока от внешнего источника. Процессы, протекание которых связано с переносом электрического заряда через границу электрод-раствор, называют фарадеевскими, а ток, возникающий в результате этих процессов, фарадеевским. Процессы, приводящие к протеканию электрического тока в результате перераспределения заряда в двойном электрическом слое (ДЭС), возникающем на границе раздела электрод-раствор, не связанные с переносом заряда через границу раздела, называют нефарадеевскими.
Перенос заряда в растворах происходит в результате направленного движения носителей заряда – ионов. Существуют различные механизмы такого переноса. Среди них можно выделить конвекцию, миграцию и диффузию. Конвекцией называется перенос вещества макроскопическими потоками. В электрохимическом анализе часто применяют перемешивание раствора для ускорения переноса ионов вследствие конвекции. Миграция – это движение заряженных частиц под действием электрического поля. Зависимость скорости движения ионов от напряженности электростатического поля может исказить результаты анализа, поэтому миграцию ионов определяемого вещества стараются исключить. Для этого в анализируемый раствор добавляют инертный (электрохимически неактивный) электролит в достаточно высокой концентрации. Находясь в избытке, ионы электролита являются в этом случае основными переносчиками тока, и доля заряда, переносимая определяемыми ионами, оказывается невелика. Диффузия – это процесс переноса вещества под действием разности химических потенциалов.
Классификация электрохимических методов анализа
В зависимости от того, какими электрохимическими процессами инициируется проявление характеристических свойств аналитов и какие параметры этих процессов используются в качестве аналитических сигналов, электрохимические методы подразделяют на равновесные (потенциометрию) и неравновесные (кондуктометрию, вольтамперометрию, электрогравиметрию и кулонометрию).
В случае равновесных методов аналитическим сигналом является электродный потенциал индикаторного электрода, измеряемый в равновесных условиях, когда сила тока в электрохимической цепи практически равна нулю. Индикаторным в этом случае выбирают электрод, потенциал которого обратимо изменяется при изменении активности (концентрации) определяемого вещества в контактирующем с электродом растворе.
Если же через ячейку протекает электрический ток (происходит электролиз и реализуются неравновесные условия), то для химического анализа можно использовать зависимость силы тока от напряжения. Соответствующие методы называются вольтамперометрическими. Методы, основанные на измерении напряжения при постоянной силе тока, называют вольтамперометрическими, а на измерении силы тока при постоянном напряжении – амперометрическими. В любом варианте вольтамперометрический анализ проводят в условиях, когда степень электрохимического превращения определяемого вещества вследствие электролиза пренебрежимо мала. Однако электролиз можно проводить и до полного превращения определяемого вещества. На этом основаны неравновесные методы электрогравиметрии и кулонометрии. К неравновесным методам относится и кондуктометрия, в которой аналитическим сигналом служит электропроводность раствора электролита, являющаяся функцией его концентрации.
С методической точки зрения все электрохимические методы можно разделить на прямые и косвенные. Последние представляют собой методы титрования, в которых конечную точку определяют электрохимическим способом.
1. Потенциометрия
1.1. Теоретические основы метода
Электродный потенциал
Потенциометрические методы основаны на измерении электродвижущих сил (ЭДС) – напряжения на электродах ячейки в отсутствии тока:
Е = Е1 – Е2,
где Е – электродвижущая сила; Е1 и Е2 – потенциалы электродов исследуемой цепи.
В этом случае один из электродов является неполяризуемым индикаторным электродом, а другой – электродом сравнения. Потенциал индикаторного электрода связан с активностью и концентрацией веществ, участвующих в электродном процессе, уравнением Нернста:
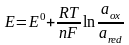 =
=
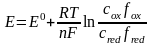 ,
(1.1)
,
(1.1)
где E0 – cтандартный потенциал редокс-системы; R – универсальная газовая постоянная; Т – абсолютная температура; F – постоянная Фарадея; n – число электронов, принимающих участие в электродной реакции; aox,, ared – активности окисленной и восстановленной форм редокс-системы; сox,, сred – их молярные концентрации; fox,, f red – коэффициенты активности.
Однако потенциал отдельного электрода экспериментально определить невозможно. Относительные значения электродного потенциала находят, комбинируя данный электрод со стандартным водородным электродом, который является общепринятым международным стандартом. Его потенциал принят равным нулю при всех температурах, поэтому потенциал данного электрода – это, в сущности, ЭДС элемента, состоящего из данного и стандартного водородного электродов.
Для проведения потенциометрического анализа обычно собирают гальванический элемент, на одном из электродов которого протекает электрохимическая реакция с участием определяемого иона или иона, реагирующего с определяемым. Гальванический элемент состоит из индикаторного электрода, потенциал которого зависит от концентрации (активности) определяемого иона, и электрода сравнения, потенциал которого должен оставаться постоянным независимо от протекания каких-либо реакций в анализируемом растворе. ЭДС исследуемого элемента выражается как разность между потенциалом электрода сравнения (Еср) и потенциалом индикаторного электрода (Еинд):
Е = Еср – Еинд+ Ед,, (1.2)
где Ед, – диффузионный потенциал, возникающий на границе между растворами двух разных электролитов или растворов разной концентрации одного электролита. На практике диффузионный потенциал стремятся элиминировать (свести к нулю) с помощью солевого мостика.
Индикаторные электроды
Индикаторный электрод должен удовлетворять ряду требований. Необходимо, чтобы его потенциал был воспроизводим и устанавливался достаточно быстро. При исследовании потенциала металлического электрода в растворе его соли индикаторный электрод должен быть обратим. Электрод должен обладать также определенной химической устойчивостью, чтобы не реагировать с другими компонентами анализируемого раствора. В потенциометрии в качестве индикаторных применяют металлические и мембранные (ионселективные) электроды.
Металлические электроды первого рода представляют собой металлическую пластинку или проволоку, погруженную в раствор хорошо растворимой соли этого металла.
Редокс-электроды служат для измерения окислительно-восстановительного потенциала системы. В качестве редокс-электродов используют платину, золото, иридий и графит. Потенциал этих электродов зависит от отношения активностей окисленной и восстановленной форм определяемого вещества (редокс-пары) и не зависит от материала электрода.
Электроды второго рода состоят из металла, покрытого слоем малорастворимого соединения этого металла и погруженного в раствор хорошо растворимого соединения с тем же анионом. К
ним относятся хлорсеребряный, каломельный и некоторые другие электроды. Обычно их применяют в качестве электродов сравнения, хотя применение в качестве индикаторных электродов также не исключено.
Ионселективные электроды (ИСЭ) основаны на использовании не электрохимической реакции с переносом электрона, а разности потенциалов, возникающей на границе раздела фаз, и равновесия обмена ионов между мембраной и раствором.

Рис. 1. Ионселективные электроды.


Рис.2 Редоксэлектрод (платиновый)
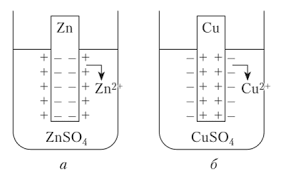
Рис. 3. Электроды 1-го рода.
Хлорсеребряный электрод – электрод сравнения
Электроды сравнения должны обладать устойчивым во времени воспроизводимым потенциалом, не меняющимся при прохождении небольшого тока. Чаще всего в качестве электродов сравнения применяют электроды второго рода: хлорсеребряный и каломельный.
Хлорсеребряный электрод представляет собой серебряную проволоку, покрытую слоем AgCl и помещенную в раствор KCl (3М). Активность ионов серебра в таком растворе равна:
aAg+ = ПРAgCl / aCl- (1.3)
Подставляя эту величину в уравнение Нернста для серебряного электрода получают выражение для потенциала хлорсеребряного электрода:
EAg+/AgCl = E0Ag+/AgCl – (RT/F)lnaCl- (1.4)
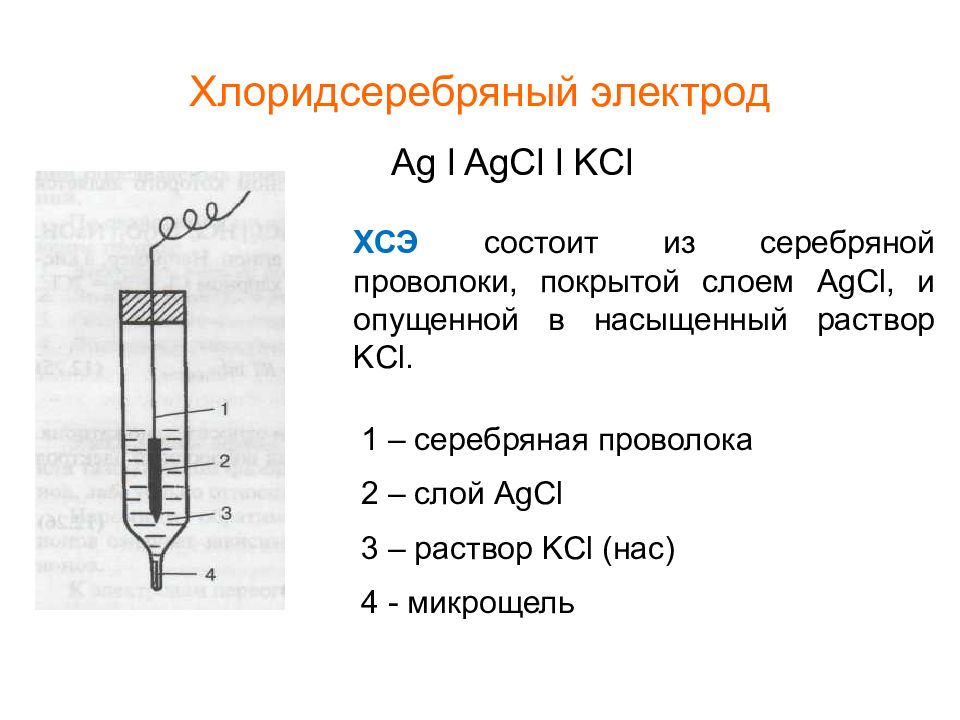
Рис.4. Хлоридсеребряный электрод ( Е 0= +0.222В).
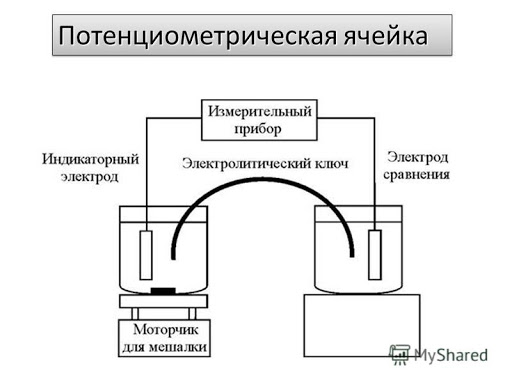
Рис.5. классический вид потенциометрической (гальванической) ячейки.

Рис. 6. Современный вариант потенциометрической ячейки.
