
Механика (1 семестр) / ЛР9_механика
.pdfΔp3 |
18 |
16 |
17 |
20 |
16 |
18 |
16 |
18 |
19 |
18 |
|
|
|
|
|
|
|
|
|
|
|
Очевидных промахов и известных систематических погрешностей не обнаружено.
Упорядочим выборку по возрастанию:
Δp3 |
16 |
16 |
16 |
17 |
18 |
18 |
18 |
18 |
19 |
20 |
|
|
|
|
|
|
|
|
|
|
|
Проверим на наличие грубых погрешностей:
U p, N R=0.41 (20−16)=0.41 4=1.64
p2− p1=16−16=0<U p,N R p3− p2=16−16=0<U p, N R p4 − p3=17−16=1<U p, N R p5− p4=18−17=1<U p, N R p6− p5=18−18=0<U p,N R p7− p6=18−18=0<U p, N R p8− p7=18−18=0<U p, N R p9− p8=19−18=1<U p, N R p10− p9=20−19=1<U p, N R
Грубых погрешностей не обнаружено
Среднее значение:
¯p = |
ΣΔ pi |
=16+16+16+17+18+18+18+18+19+20 |
=17.6 [дел] |
|
|||
3 |
n |
10 |
|
|
|

Найдем среднеквадратичное отклонение:
|
|
√ |
|
Σ( |
¯pi − |
pi)2 |
|
√ |
|
|
|
|
|
|
|
|
|
|
16.4 |
|
|
|
|||
S ¯p3 |
= |
|
|
= |
|
=√0.182≈0.43 [дел ] |
||||||
|
|
N (N−1) |
|
90 |
||||||||
|
|
|
|
|
|
|
|
|
||||
Для числа измерений N=10 и точности измерений P=0.95 коэффициент стьюдента равен 2.3
Δ(Δ p3)=tp, N S ¯p1=2.3 0.43=0.989 [дел ]
Определим случайную погрешность по размаху выборки:
Δ(Δ p3)β =β p, N R=0.23 (20−16)=0.92 [дел ]
Δ(Δ p3)β ≈Δ(Δ p3 )
Полная погрешность результата измерения:
¯ |
2 2 |
|
|
2 |
|
2 |
|
|
|
|
|
+2 |
=√4.978121≈2.23[дел] |
||||||
Δ(Δ p3)=√Δ(Δ p3) +θ p=√0.989 |
|
|
|||||||
p3=18±2[дел]
Рассчитаем показатель политропы n=n¯±Δ n¯ с P=0.95 на участке 1-2 nVT цикла.
По формуле n= |
p1 |
найдем значения и запишем их в таблицу: |
p1− p3 |
n |
1.39 |
1.36 |
1.36 |
1.42 |
1.34 |
1.38 |
1.32 |
1.375 |
1.41 |
1.42 |
|
|
|
|
|
|
|
|
|
|
|

Очевидных промахов и известных систематических погрешностей не обнаружено.
Упорядочим выборку по возрастанию:
n |
|
1.32 |
1.34 |
1.36 |
1.36 |
1.375 |
1.38 |
1.39 |
|
1.41 |
|
1.42 |
1.42 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Проверим на наличие грубых погрешностей: |
|
|
|
|
|
|
|
||||||||
U p, N R=0.41 (1.42−1.32)=0.01 0.41=0.041 |
|
|
|
|
|
|
|
|
|||||||
n2−n1=1.34−1.32=0.02<U p, N R |
|
|
|
|
|
|
|
|
|
|
|||||
n3−n2=1.36−1.34=0.02<U p,N R |
|
|
|
|
|
|
|
|
|
|
|||||
n4 −n3=1.36−1.36=0<U p, N R |
|
|
|
|
|
|
|
|
|
|
|||||
n5−n4=1.375−1.36=0.015<U p, N R |
|
|
|
|
|
|
|
|
|
||||||
n6−n5=1.38−1.375=0.005<U p , N R |
|
|
|
|
|
|
|
|
|
||||||
n7−n6=1.39−1.39=0.01<U p, N R |
|
|
|
|
|
|
|
|
|
|
|||||
n8−n7=1.41−1.39=0.02<U p, N R |
|
|
|
|
|
|
|
|
|
|
|||||
n9−n8=1.42−1.41=0.01<U p, N R |
|
|
|
|
|
|
|
|
|
|
|||||
n10−n9=1.42−1.42=0 <U p, N R |
|
|
|
|
|
|
|
|
|
|
|||||
Грубых погрешностей не обнаружено |
|
|
|
|
|
|
|
|
|||||||
Среднее значение: |
|
|
|
|
|
|
|
|
|
|
|
||||
¯n= |
Σni |
= |
1.32+1.34 +1.36+1.36+1.375+1.38+1.39+1.41+1.42+1.42 |
= |
13.775 |
=1.38 |
|
||||||||
10 |
|
|
|
10 |
|
|
|
10 |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Среднекваратичное отклонение:
Sn=√0.010225 ≈0.011 90

Для числа измерений N=10 и точности измерений P=0.95 коэффициент стьюдента равен 2.3
n=Sn tp, N =0.011 2.3=0.0253
Определим случайную погрешность по размаху выборки:
nβ =β p, N R=0.23 (1.42−1.32)=0.023
nβ ≈Δ n
θn=0.01
Полная погрешность результата:
n¯=√0.02532+0.012=√0.00074009≈0.027
n=1.38±0.03
Выразим избыточное давление p1 и p3 в Па, считая, что одно деление шкалы равно 40 Па.
p1=64±3 [дел ] |
=> |
p1=2560±120[ Па] |
p3=18±2[дел] |
=> |
p3=720±80[ Па] |
Рассчитаем параметры состояния (p, V, T) в точках 1, 2 и 3 nVT и 1*, 2*, 3* SVT циклов:
p2=102391[ Па]
T1 =297[ K ]
V 1=22.4 [ л]

Точка 1 совпадает с точкой 1*.
p1= p2 +Δ p1=102391+2560=104951[Па]
T1 =297[ K ]
V 1=22.4 [ л]
При переходе из состояния 1 в состояние 2 протекает политропный процесс. Значит, параметры процесса определяются так:
|
|
|
|
|
p1 V 1n |
|
|
|
|
|
|
|
|
|
|
|
n p1 |
|
|
|
|||
n |
n |
|
n |
|
1.38 104951 |
|
|||||
p1 V 1 |
=p2 V 2 |
=> |
V 2=√ |
|
|
=V 1 √ |
|
=22.4 √102391 |
≈22.81 [ л] |
||
|
p2 |
|
p2 |
||||||||
Из уравнения состояния найдем температуру в точке 2
p1 V 1 = p2 V 2 => |
|
T 1 |
T 2 |
|
(n−1) |
=> |
T 1 =( V 2 ) |
||
T 2 |
V 1 |
|
T2 = |
p2 V 2 T 1 |
= |
102391 22.8 297 |
=294.92 K |
|
p1 V 1 |
104951 22.4 |
||||
|
|
|
T |
= |
V 1n−1 T1 |
= |
22.40.38 297 |
=294.95 К |
|
V 2n−1 |
22.810.38 |
|||||
2 |
|
|
|
При переходе из состояния 2 в состояние 3 протекает изохорный процесс. Значит, параметры процесса определяются так:
V 3=V 2=22.81 [ л]
T3 =T1=297 [ К ]
p3= p2 +Δ p3=102391+720=103111[Па]
Найдем значения параметров состояния в точках 2* и 3*. При переходе из состояния 1 в состояние 2* процесс протекает адиобатически. Значит, параметры процесса определяются так:
p1 V γ1 = p2 V γ2

p2 ٭ = p2=102391
Принимая воздух за двухатомный газ ɣ=1.4 Тогда:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p1 V |
γ1 |
|
|
γ p1 |
|
|
|
|
|
||
|
|
γ |
|
|
1.4 |
104951 |
|
|
|
||||||
V 2 ٭ =√ |
|
|
=V 1 |
√ |
|
=22.4 √102391 |
≈22.79[ л] |
|
|||||||
p2 |
|
p2 |
|
||||||||||||
Из уровнения состояния найдем значение Т2: |
|
||||||||||||||
|
p1 V 1 |
= |
p2 ٭ V 2 ٭ |
|
=> |
T2 ٭ = |
p2 ٭ V 2 ٭ T1 |
=102391 22.8 297 |
=294.92 K |
||||||
|
|
|
|
||||||||||||
|
T 1 |
T2 ٭ |
|
|
|
|
p1 V 1 |
|
104951 22.4 |
|
|||||
T 1x |
=( |
V 2x |
(γ −1) |
=> |
x |
= |
Vγ1 |
−1 T 1x |
= |
22.4 |
0.4 297 |
=294.96 К |
T 2x |
V 1x |
) |
T |
V 2x(γ −1 ) |
22.790.4 |
|||||||
|
|
|
2 |
|
|
|
||||||
При переходе из состоянии 2* в состояние 3* процесс протекает изохорически:
V 3 ٭ =V 2 ٭ =22.79[ л]
T3 ٭ =T3 =T1=297 [ К ]
p3 V 3 ٭ =p1 V 1 => |
p3 |
٭ = |
p1 V 1 |
= |
104951 22.4 |
=103154 [ Па] |
||
V 3 |
٭ |
22.79 |
||||||
|
|
|
|
|
||||
Сгруппируем данные в таблицу и построим nVT и SVT-циклы в координатах p,V:
|
1 |
2 |
3 |
1* |
2* |
3* |
|
|
|
|
|
|
|
T |
297 |
294.95 |
297 |
297 |
294.96 |
297 |
|
|
|
|
|
|
|
V |
22.4 |
22.8 |
22.8 |
22.4 |
22.79 |
22.79 |
|
|
|
|
|
|
|
p |
104951 |
102391 |
103111 |
104951 |
102391 |
103154 |
|
|
|
|
|
|
|
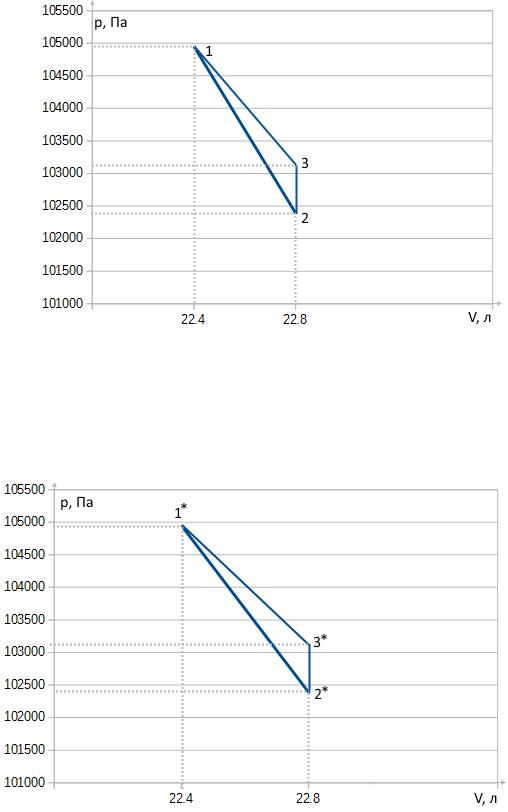
nVT-цикл:
SVT-цикл:
Рассчитаем холодильный коэффициент ε для nVT и SVT циклов: цикл nVT (1-2-3-1):

ϵ (nVT )= 2 p2 = 2 102391 =284.4 p3 720
цикл SVT (1*-2*-3*-1*)
ϵ (SVT )= 2 p2 px3
Где p3x=px3− p2x=103154−102391=763 Па
ϵ (SVT )= 2 102391 =268.4 763
Т.к. p3x>Δ p3 , ϵϵ ((nVTSVT ))>1 и равно 284268..44 =1.059
Рассчитаем холодильный коэффициент работающий по циклу Карно:
Для Т1, Т2: |
ϵ |
= |
|
T 2 |
= |
|
|
294.95 |
=143.88 |
|
T 1−T 2 |
|
297−294.92 |
||||||||
|
k |
|
|
|
|
|
||||
Для Т1*, Т2* |
|
ϵk |
= |
T 2 |
|
= |
294.96 |
|
=144.58 |
|
|
T 1−T 2 |
297−294.96 |
||||||||
|
|
|
|
|
|
|
||||
Найдем число молей воздуха в сосуде v по величинам p2, V1, T1, считая, что число молей газа при его сжатии и расширении постоянно.
p2 V 1=v R T 1 => v= |
p2 V 1 |
= |
102391 22.4 10−3 |
=0.93[ моль] |
|
RT1 |
8.31 297 |
||||
|
|
|
Рассчитаем мольную теплоемкость воздуха c при политропном процессе:
n= |
C−CP |
=> С= |
Cp−nCv |
, где |
|||
C−Cv |
1−n |
||||||
|
|
|
|
|
|||
Cv=iR |
Cp = |
i+2 |
R |
|
|
||
|
|
|
|||||
|
2 |
2 |
|
|
|
||
Сv=5 8.31 =20.775 2
Cp =7 8.31 =29.085 2
С=Cp−nCv
1−n
Рассчитаем изменение энтропии всех процессов в nVT и SVT - циклах
nVT:
На участке 1-2 (политропа):
S12=−ν C( |
n−1 |
) |
p1 |
=−0.93 1.09( |
1.38−1 |
) |
2560 |
=−0.00697 [ |
Дж |
] |
|
n |
p2 |
1.38 |
102391 |
К |
|||||||
|
|
|
|
|
|
На участке 2-3 (изохора):
S23=2.5ν R ( n−1 ) |
p 1 |
2=2..5 0.93 8.31 ( |
1.38−1 ) |
2560 |
=0.133[ |
Дж |
] |
|
102391 |
||||||||
n |
p |
|
1.38 |
|
К |
|
На участке 3-1 (изотерма):
S31= |
−1 |
ν R |
p1 |
=− |
1 |
0.93 8.31 |
2560 |
=−0.14[ |
Дж |
] |
|
n |
p2 |
1.38 |
102391 |
К |
|||||||
|
|
|
|
|
|
SVT:
Для SVT-цикла изменение энтропии в адиабатном процессе (на участке 1*-2*) равно нулю. С учетом, что изменение энтропии в цикле также рано нулю, заключаем, что изменения энтропии в изохорном и изотермическом про-цессах равны по величине, но различаются знаком
|Δ S |
x |
|=ν R |
1 |
p1 |
=0.93 8.31 |
1 2560 |
=0.138[ |
Дж |
] |
||
|
γ |
|
|
|
|
|
|||||
|
|
|
|
|
|
||||||
|
31 |
p2 |
|
1.4 102391 |
|
К |
|
||||
|
|
|
|
|
|
||||||
Вывод: в ходе выполнения данной лабораторной работы мы исследовали политрнопно-изохорно-изотермический и адиабатно-изохорно-изотермический
циклы. Рассчитали избыточное давление p1 и |
p3 в шкалах монометра и |
||
паскалях |
p1=64±3 [дел ] => |
p1=2560±120[ Па] |
; p3=18±2[дел] => |
p3=720±80[ Па] ; нашли показатель политропы n=1.38±0.03; рассчитали параметры состояния для исследуемых процессов, построили циклы на осях
координат (p, V); рассчитали холодильные коэффициенты и изменению энтропии в процессах.
Вопросы на защиту:
1) Все начала термодинамики:
Нулевое начало термодинамики:
Вне зависимости от начального состояния изолированной системы в конце концов в ней установится термодинамическое равновесие, а также все части системы при достижении термодинамического равновесия будут иметь одинаковую температуру. Тем самым нулевое начало фактически вводит и определяет понятие температуры
Первое начало термодинамики.
Имеет формулу вида Q=U2−U 1+ А , которое выражает закон сохранения энергии. Словами первое начало термодинами выражается так: Количество тепла, сообщенное системе, идет на приращение внутренней энергии системы и на совершение системой работы над внешними телами.
Второе начало термодинамики.
Формулируется следующим образом: невозможны такие процессы, единственным конечным результатом которых был бы переход тепла от тела, менее нагретого, к телу, более нагретому.
Третье начало термодинамики.
Формулируется теоремой Нернста и вытекающими из него следствиями:
