
Лекция 15 физика
.pdf
Лекция 8.
Тема 13. Физика атома. Водородоподобные атомы.
Резерфорд в 1911 году исследовал рассеяние альфа-частиц при прохождении их через тонкие слои металлической фольги. Альфачастицы образуются при естественном радиоактивном распаде неко-
торых тяжелых элементов |
и представляют собой |
ядра |
атомов гелия |
|||
и |
имеют |
положительный |
электрический заряд, |
так |
как |
состоят |
из |
двух |
протонов и двух |
нейтронов. Резерфорд, |
пропуская |
альфа- |
|
частицы с большой кинетической энергией через металлические пластинки, установил, что большая часть частиц отклоняются от первоначального направления на небольшие углы.
Рис.13.1.
Наряду с рассеиванием на малые углы, было обнаружено откло-
нение |
отдельных частиц и на большие углы, доходящие |
до 1500. |
||
Схема |
экспериментальной установки |
представлена на |
рис. |
13.1.а). |
Здесь К - свинцовый контейнер с радиоактивным веществом, |
Э – |
|||
экран, покрытый сернистым цинком, при столкновении |
- час- |
|||
тиц с |
которым возникают вспышки, |
М - микроскоп |
для |
наблю- |
дения вспышек, Ф - золотая фольга, φ – угол отклонения |
на- |
|
правления движения |
–частиц от первоначального направления. |
|
На рис 13.1 б) показано |
отклонение частиц на углы порядка |
1500 |
.
Такое рассеяние было обнаружено и при прохождении альфа-частиц через одноатомные газы.
Установлено, что отклонения происходят вследствие кулоновского отталкивания от положительного заряда, сосредоточенного в очень
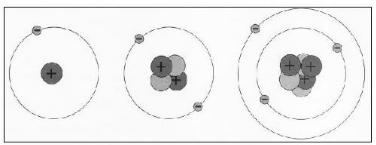
малом объеме внутри атома. Для объяснения результатов рассеяния Резерфорд в 1911г. предложил планетарную модель атома. Схема модели представлена на рис.13.2. Согласно этой модели атом построен по типу Солнечной системы - в центре атома в очень малой области (10-13 м) находится положительно заряженное ядро, в кото-
ром сосредоточена почти вся масса |
атома, а вокруг ядра под действи- |
|||||
ем сил |
кулоновского |
притяжения |
двигаются |
по замкнутым ор- |
||
битам |
электроны |
(примерный |
радиус орбит -10-10м). При этом |
|||
суммарный |
заряд |
электронов равен |
по величине |
заряду ядра, поэто- |
||
му в целом |
атом |
нейтрален. |
|
|
||
Рис.13.2.
Согласно классической электродинамике электрон, двигающийся по орбите вокруг ядра с ускорением, должен испускать электромагнитные волны непрерывного спектра частот. При этом он теряет
свою энергию и через малый интервал порядка |
времени |
жизни |
|
атома |
в возбужденном состоянии 10-8 с должен |
упасть |
на ядро, |
чего не |
происходит в реальности. |
|
|
Ясно, что планетарная модель строения атома должна была интерпретировать получаемые экспериментальные данные. Но в конце 19 века Бальмером было обнаружено, что спектр излучения атомарного водорода в видимой области состоит из отдельных линий, расположенных в определенном порядке, то есть является линейча-
тым, а |
не непрерывным. В дальнейшем было установлено, что |
спектр |
водорода в оптической области состоит из нескольких серий |
частот излучения, наиболее известные из которых описываются соотношениями:
серия Лаймана для ультрафиолетового излучения:
ν R |
|
|
1 |
|
|
|
2, 3, 4 ... серия Бальмера для видимого |
||||||
1 |
|
|
, |
n |
|||||||||
n |
2 |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ν |
|
1 |
|
|
1 |
|
n 3, 4, 5 ... |
||||
излучения: |
R |
|
|
|
|
|
, |
||||||
2 |
2 |
|
n |
2 |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||
Обобщенная формула Бальмера – Ритца, которая описывает все линии, записывается так:
ν R |
|
1 |
|
1 |
|
n 4, 5, 6 ... здесь R-постоянная Рид- |
||
|
|
|
|
|
, |
|||
|
2 |
n |
2 |
|||||
|
m |
|
|
|
|
|
||
берга, m – номер серии 1, 2, 3, …., n – номер линии в серии, причем n= (m+1), (m+2), (m+3),….., и т.д. Отметим, что если m=3 – серия Пашена в инфракрасной области, если m=4 – серия Брекета, если m=5 – Пфунда.
Для каждой серии |
значение |
частоты √кр = |
|
|
|
|
- |
|
|
|
|||||
называется красной |
границей |
серии (минимальная частота |
серии). |
||||
Изучение спектра поглощения для атомарного водорода показало, что он тоже имеет дискретный характер, описываемый соотношениями, записанными выше. Подобная дискретность спектров была обнаружена у всех одноатомных газов. Таким образом, планетарная модель атома требовала серьезных доработок.
Для объяснения спектров |
излучения и поглощения атомарного |
|
водорода в 1913г. Нильс |
Бор |
представил три постулата, которые не |
соответствовали законам |
классической механики. |
|
1. Атом может находиться в стационарных состояниях, в этих состояниях электрон движется по определенным стационарным орбитам без излучения и без потери энергии. Эти орбиты называют боровскими орбитами.

2. При движении по боровским орбитам электроны имеет строго определенные (дискретные) значения
момента импульса L: Ln = mvr = n , n = 1, 2, 3,……,
,h = 6,62·10-34 Дж·с
Квантовое число n является номером состояния атома и номером боровской орбиты электрона. В этих состояниях радиусы орбит электрона и его скорости различны, атом также имеет различные значения энергии. Обычно атом водорода находится в основном или невозбужденном состоянии n=1 с наименьшим значением энергии, состояния с n = 2, 3, 4 имеют большие энергии и называются возбужденными.
3. При передаче атому энергии он переходит в какое-либо возбужденное состояние с n = 2, 3, 4, . При всех переходах, в соответствии с законом сохранения, энергия кванта излучения или поглощения электромагнитной волны точно равна разности энергий
начального и конечного |
состояний атома: |
|
= hν = En – |
||
Em, , при этом величины |
( |
|
, |
|
назвали энергети- |
|
|
||||
ческими термами. |
|
|
|
|
|
Теория Бора не отвергает полностью законы классической физики при описании поведения атомных систем. В ней сохранены представ-
ления |
об орбитальном движении |
электронов |
в кулоновском поле яд- |
|||
ра. Поэтому теорию Бора иногда |
называют |
полуклассической. |
|
|||
|
|
|
На рис.13.3 представлена схема по- |
|||
|
|
глощения |
|
и испускания |
квантов |
|
|
|
энергии. |
|
|
|
|
|
|
|
Создание Бором теории, позволило |
|||
|
|
ему рассчитать на основании 2 по- |
||||
Рис. |
13.3 |
стулата, |
а |
также закона |
Кулона, |
|
и формул |
кинетической и |
|
||||
|
|
|
||||
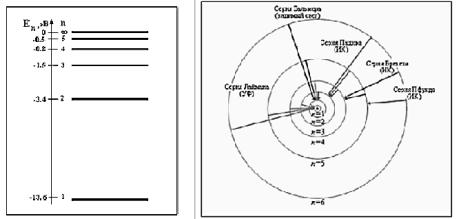
потенциальной энергий электрона, взаимодействующего с ядром, значения энергии электрона с заданным значением квантового числа n. Схема энергетических уровней, а также переходы между уровнями, соответствующие сериям спектра водорода, представлены на рис. 13.4.
Рис. 13.. 4
Опыт Франка и Герца.
Теория Бора нашли свое экспериментальное подтверждение в опытах Франка и Герца (1913г.). В опытах исследовались столкновения электронов с атомами газов. Принципиальная схема установки представлена на рис. 13.5. Вакуумная трубка наполнена парами ртути при давлении порядка 16 Па, в нее вставлены катод (К), две
сетки (С1 и С2) и анод |
(А). Между сеткой С1 |
и катодом |
приложе- |
на ускоряющая разность |
потенциалов. Между |
сеткой С2 |
и анодом |
приложена задерживающая разность потенциалов порядка 0,5В. Электроны, ускоренные в области 1, попадают в область 2, где испытывают соударения с атомами паров ртути. Электроны, которые после соударений, имеют достаточную энергию для преодоления задерживающего потенциала в области 3, достигают анода.

Рис. 13.5.
При неупругих соударениях электронов с атомами ртути, атомы ртути могут переходить в возбужденные состояния (рис.13.5). Согласно теории Бора, каждый атом может взять лишь определенное значение энергии, и перейти в одно из возбужденных состояний. Поэтому, если в атомах действительно существуют стационарные состояния, то электроны при столкновениях будут терять энергию дискретно, порциями, равными разности энергий соответствующих состояний атома.
Пока разность потенциалов между катодом и сеткой меньше энергии возбуждения, электроны при столкновении с атомами ртути испытывают только упругие столкновения, не отдают энергию, совершают работу против сил со стороны задерживающего поля и долетают до анода. Идет ток. Если энергия электронов становится достаточной, чтобы вызвать неупругие столкновения, то есть атом может взять эту энергию, электрон теряет свою на-
бранную кинетическую энергию и не может |
совершить |
работу. Он |
|||
не долетает до анода и ток в цепи падает. |
Этим |
и |
объясняется |
||
то нарастание, то падение электрического тока в цепи. |
|
||||
|
На рис. 13.6 |
показано |
схематическое |
||
изображение зависимости |
силы анодного |
||||
тока от приложенного напряжения. |
|||||
|
Решение задачи |
о |
движении |
электрона |
|
в кулоновском поле ядра. |
|
|
|||
|
Энергетические |
|
уровни. |
Квантовые |
|
числа и их физический смысл

При рассмотрении атома водорода, движение его единственного электрона можно рассматривать как движение электрона в кулоновском поле ядра. Такие системы ядро-электрон называются водо-
родоподобными, их |
примером являются |
атом водорода |
Н, ион |
гелия |
Не+, ион лития |
Li++. При этом заряд |
электрона по |
величине, |
так- |
же как и заряд протона в ядре, обозначим как е. Тогда потенци-
альная энергия электрона |
в поле ядра будет записываться так: |
||
|
|
; здесь z |
– число протонов в ядре атома. |
|
|
||
И, соответственно, стационарное уравнение Шредингера можно зпаисать так:
(13.1)
При решении уравнения Шредингера о движении электрона в
центральном поле |
ядра, используют сферические координаты, |
центр |
||
которых совпадает с центром ядра атома. |
|
|
||
x=r |
sinΘ cosφ |
, y=r sinΘ sinφ, |
z=r cosΘ, |
(13.2) |
где |
φ – угол |
между проекцией радиус |
– вектора r на |
плос- |
кость x,y и осью ох, Θ – угол между осью oz и радиус-вектором r.
Оказалось, что решение уравнения для момента импульса су-
ществует |
не при |
всех М , |
а |
лишь |
когда |
, |
||
(13.3) |
|
|
|
|
|
|
|
|
|
где |
l целое положительное число, получившее название орби- |
||||||
тального |
квантового |
числа |
l = |
0, 1, |
2,……., |
(n-1). |
|
|
Так как электрон имеет электрический заряд, то его движение вокруг ядра приводит к появлению магнитного момента, аналогичного магнитному моменту кругового витка с током. Орбитальное квантовое число l квантует величину момента импульса и магнитного момента . Орбитальное число также определяет величину радиуса орбит электрона, то есть величину атома.
При этом для каждого l существует (2l+ 1) решений. Такое условие называется вырождением, когда определенное значение физи-

ческой величины М |
может быть реализовано в (2l + 1) со- |
стояниях. |
|
Магнитное квантовое число m характеризует ориентацию мо-
мента импульса |
и магнитного момента (который |
связан с |
движением электрона |
по орбите) во внешнем силовом поле (напри- |
|
мер, магнитном), и |
может принимать целочисленные |
значения |
от – l до + l . Согласно классической теории магнитный момент всегда стремится встать вдоль направления магнитного поля. В квантовой механике движение электрона таково, что магнитный момент может быть направлен в нескольких, строго определенных направлениях в зависимости от состояния атома, то есть он квантуется не только по величине, но и по направлению (рис.13.7).
Собственными значениями проекции
момента импульса на выбранное направ-
ление |
Mz |
будут |
значения: |
||||
Mz |
|
= |
|
m , |
где |
m = 0, |
|
|
|
, |
число |
m называют маг- |
|||
нитным |
квантовым числом. |
|
|||||
Рис. 13.7.
Отсюда следует, что волновые функции при заданном пол-
ном моменте М (заданное l) с разными m, суть состояния с различными проекциями момента импульса на ось OZ.
Вернемся к уравнению Шредингера. Конечные решения уравнения в сферических координатах при собственных значениях оператора энергии Е >0 существуют при любых значения Е (движение свободно движущегося электрона вне атома), а при Е < 0 существуют лишь при следующих значениях энергии электрона:
Еn= , (13.4)
Число n определяет энергию электрона и называется главным квантовым числом.
Значения энергии Еn, которые может иметь атом, называют раз-
решенными значениями энергии атома, а их |
совокупность Е1, Е2, … |
Е представляет собой энергетический спектр |
атома. Разрешенные |
значения энергии обычно изображаются в виде горизонтальных линий, называемых энергетическими уровнями.
Таким образом, важной особенностью полученного решения является его зависимость от трех чисел n, l, m, называемых квантовыми числами. Каждому решению соответствует определенное состояние атома со своим распределением плотности вероятности нахождения электрона вокруг ядра, которое задается соответствующей волновой функцией, зависящей от трех квантовых чисел: n, l, m.
Подсчитаем, сколько различных волновых функций принадлежит уровню Еn:
(13.5)
Вернемся к рассмотрению спектра атома водорода.
Если энергия, переданная электрону, будет достаточно велика, то электрон может преодолеть силу притяжения к ядру и оторваться от атома. Такой процесс называют ионизацией атома. Для атома водорода квантовая механика дает такие же значения энергетических уровней, что и теория Бора, то есть:
En |
|
13,6 эВ |
, |
где n=1, |
2, |
(это |
суть термы |
в теории |
Бо- |
||
|
|
|
|||||||||
|
n |
2 |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
ра). |
(13.6) |
|
|
|
|
|
|
|
|
|
|
Состояние |
атома |
с |
наименьшей |
энергией |
называется |
основным |
(n |
||||
= 1), |
все остальные |
состояния |
– |
возбужденными. |
|
|
|||||
Схему энергетических уровней атома водорода мы уже видели при рассмотрении теории Бора на рис.13.2.

В возбужденном состоянии атом долго находиться не может. Как и любая физическая система, атом стремится занять состояние с наименьшей энергией. Поэтому через время порядка 10-8с возбужденный атом самопроизвольно переходит в состояние с меньшей энергией, испуская при переходе квант энергии излучения. Такой процесс продолжается до тех пор, пока атом не окажется в основном состоянии. Совокупность всех возможных частот или длин волн излучений атома называют спектром испускания (при анализе излучений спектроскопом им соответствует набор спектральных линий). Если структура энергетических уровней атома определена, то можно рассчитать и спектры возможных излучений данного атома. Например, с учетом постулата Бора для атома водорода и формулу Планка:
можно получить общую формулу, описывающую все экспериментальные серии излучения водорода.
Рис.13.8.
На рис.13.8 показаны возможные переходы для атомарного водорода.
