
Лабораторная работа 2
.docxЦели и задачи расчёта
Цель работы:
Познакомиться с программным комплексом HyperChem, обеспечивающим проведение расчетов методами молекулярной механики, а также полуэмпирическими и неэмпирическими методами квантовой химии.
Задачи расчёта:
Провести расчет молекулы бензойной кислоты полуэмпирическим квантово-химическим методом AM1, а также интерпретацию полученных результатов: оценку стабильности соединения, его реакционной способности, анализ диаграммы МО.
Геометрическое строение молекулы бензойной кислоты
-
Общий вид молекулы

Общий вид молекулы с нумерацией атомов
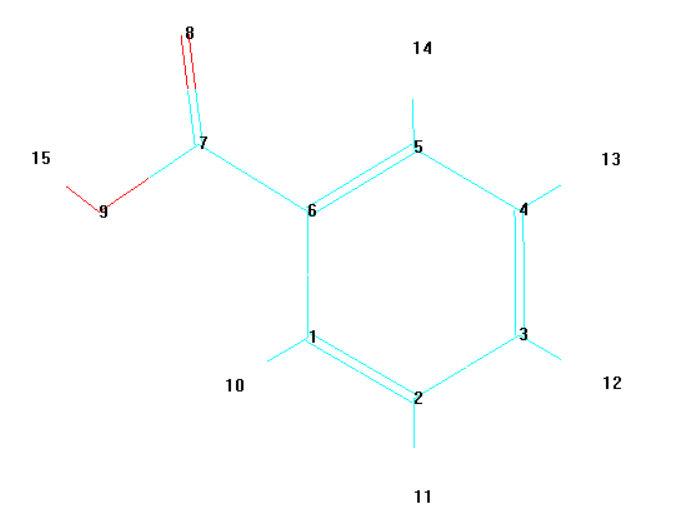
Расчет молекулы бензойной кислоты осуществлен по программному комплексу HyperChem. Оптимизация геометрии проводилась методом AM1 в минимальном базисном наборе. Полная энергия молекулы составила E = -1696.0930 Ккал/моль. Сравнение полученных методом AM1 равновесных геометрических параметров с экспериментальными данными приведены в таблице.
Табл.1 Сравнение полученных параметров с экспериментальными данными
Длина связи или валентный угол |
Данные AM1 расчета |
Данные рентгеноструктурного анализа |
С1 – C2 |
1.394Å |
1.384Å |
C2 – C3 |
1.3955Å |
1.385Å |
C3 – C4 |
1.3955Å |
1.384Å |
C4 – C5 |
1.3933Å |
1.388Å |
С5 – С6 |
1.402Å |
1.390Å |
C6 – С1 |
1.4001Å |
1.391Å |
C6 – С7 |
1.4666Å |
1.483Å |
C7 – О8 |
1.2368Å |
1.252Å |
C7 – О9 |
1.3666Å |
1.281Å |
С1 – Н10 |
1.1018Å |
0.950Å |
С2 – Н11 |
1.1001Å |
0.951Å |
С3 – Н12 |
1.1005Å |
0.950Å |
С4 – Н13 |
1.1001Å |
0.950Å |
С5 – Н14 |
1.1022Å |
0.951Å |
О9 – Н15 |
0.97178Å |
1.08Å |
С1 – С2 – С3 |
120.139° |
120.2° |
С2 – С3 – С4 |
120.159° |
120.1° |
С3 – С4 – С5 |
120.106° |
120.1° |
С4 – С5 – С6 |
119.722° |
119.7° |
С5 – С6 – С1 |
120.171° |
120.0° |
С5 – С6 – С7 |
118.54° |
120.0° |
С1 – С6 – С7 |
121.289° |
119.91° |
С6 – С1 – С2 |
119.705 |
119.8° |
С6 – С7 – О8 |
128.571° |
119.5° |
С6 – С7 – О9 |
115.423° |
116.85° |
О8 – С7 – О9 |
116.006° |
123.6° |
Н10 – С1 – С2 |
120.629° |
120.1° |
С1 – С2 – Н11 |
119.804° |
119.9° |
С3 – С2 – Н11 |
120.058° |
119.9° |
С2 – С3 – Н12 |
119.942° |
119.9° |
С4 – С3 – Н12 |
119.899° |
119.9° |
С3 – С4 – Н13 |
120.114° |
120.0° |
С5 – С4 – Н13 |
119.781° |
119.9° |
С4 – С5 – Н14 |
120.87° |
120.2° |
С6 – С5 – Н14 |
119.409° |
120.1° |
С6 – С1 – Н10 |
119.667° |
120.1° |
С7 – О9 – Н15 |
109.091° |
115.7° |
Построение диаграммы энергетических уровней (МО). Графическое изображение ВЗМО и НВМО
Номер ВЗМО определяется по общему числу электронов, с учетом того, что полуэмпирические методы используют валентное приближение.
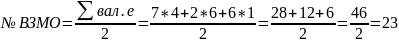

-
Энергетическая диаграмма
Вид ВЗМО
Вид НВМО


№23
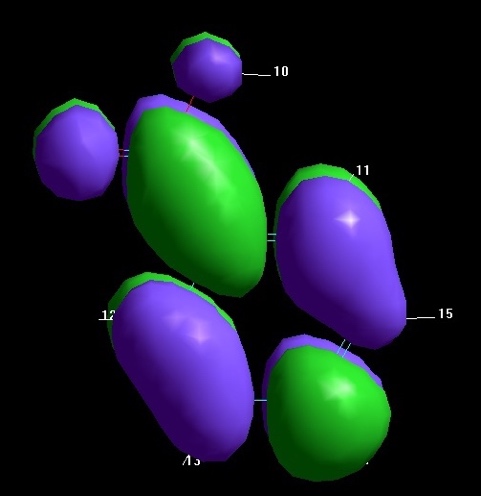
№ 24
Вклады атомных орбиталей в ВЗМО и НВМО
Табл.2 Вклады АО атомов углерода и кислорода в ВЗМО и НВМО
-
Атом
Атомная орбиталь
Вклад в ВЗМО
Вклад в НВМО
С1
pz
0.49332
-0.35306
C2
pz
0.50652
-0.19368
C3
pz
0.00405
0.50956
C4
pz
-0.50232
-0.20113
C5
pz
-0.49769
-0.34641
C6
pz
-0.00406
0.46494
C7
pz
-0.00146
0.32931
O8
pz
0.00437
-0.27480
O9
pz
-0.00256
-0.13271
Определение нуклеофильных и электрофильных свойств молекулы
Энергия НВМО молекулы бензойной кислоты отрицательна (-0,4680573 эВ), следовательно, бензойная кислота проявляет в химических реакциях электрофильные свойства свойства.
Построение распределения молекулярного электростатического потенциала (МЭП)

На рисунке изображена карта МЭП молекулы бензойной кислоты, которая позволяет интерпретировать электрофильные и нуклеофильные свойства молекулы. Рисунок показывает области положительного и отрицательного распределения электростатического потенциала, глубокий минимум (фиолетовая область) показывает неподеленные электронные пары атомов кислорода, таким образом возможно образование водородных связей, что типично для карбоновых кислот.
Квантово-химическое обоснование применения теории резонанса
Табл.3 Сравнение данных расчётов для бензойной кислоты и бензола
-
Нумерация атомов в молекулах
Бензойная кислота
Бензол
Атом
Заряд
Атом
Заряд
о-С1
-0.068
С1
-0.130
м-С2
-0.149
С2
-0.130
п-С3
-0.094
С3
-0.130
м-С4
-0.147
С4
-0.130
о-С5
-0.071
С5
-0.130
С6
-0.117
С6
-0.130
С7
0.352
Н7
0.130
О8
-0.365
Н8
0.130
О9
-0.317
Н9
0.130
Н10
0.155
Н10
0.130
Н11
0.139
Н11
0.130
Н12
0.137
Н12
0.130
Н13
0.141
Н14
0.158
Н15
0.246
Граничные структуры бензойной кислоты:
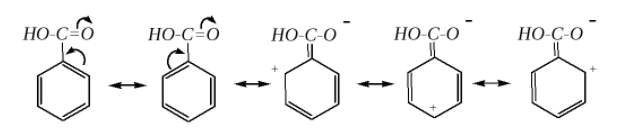
Выше приведены заряды на атомах в исследуемом соединении, а также заряды на атомах незамещенной молекулы бензола, также рассчитанные методом AM1. Наблюдаемое распределение зарядов на атомах согласуется с существующим представлением, о реакционной способности соединения. Как следует из строения бензойной кислоты, карбоксильная группа является электроакцепторным заместителем (Ⅱ рода) и обладает -I и -М – эффектами, они дезактивируют ароматическое ядро к электрофильной атаке и ориентируют ее в мета-положение. Поэтому бензойная кислота достаточно легко вступает в реакции электрофильного замещения атомов водорода в мета-положение ароматического кольца. Полученные результаты хорошо согласуются со свойствами бензойной кислоты как ориентанта Ⅱ рода. Полученные результаты дают количественную оценку данного эффекта.
