- •Активный центр фермента:
- •Типы специфичности ферментов
- •Этапы ферментативного катализа.
- •Кинетика ферментативных реакций.
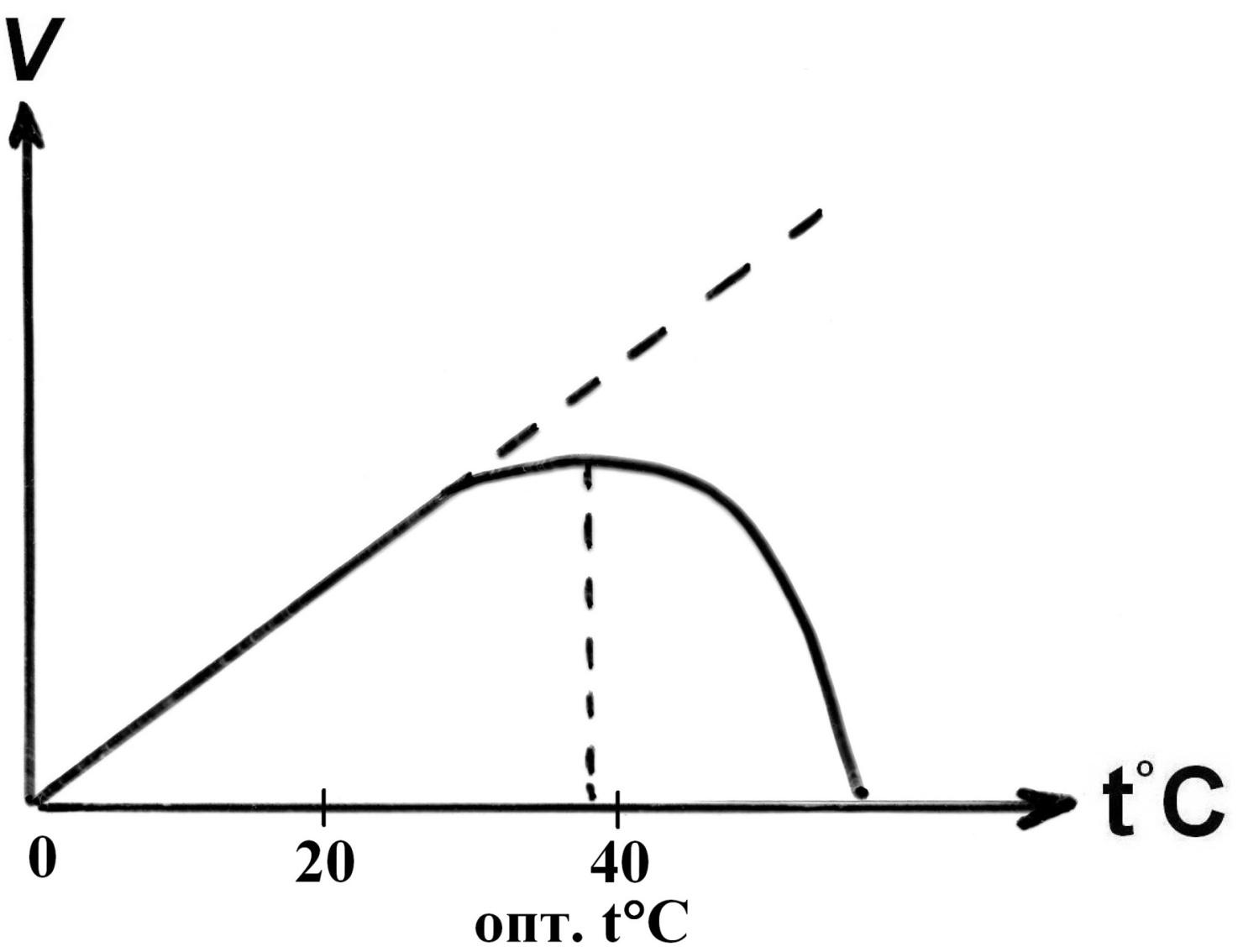
- •При нагревании:
- •Органические вещества, предшественниками которых, как правило, являются витамины;
- •Принимают непосредственное участие в катализе, наряду с радикалами аминокислот.
- •Восстановленная форма
- •Основные подклассы:
- •Активность фермента.
Ферменты – это биологические катализаторы белковой природы.
Катализаторы – это вещества, принимающие участие в химических реакциях, ускоряя их, но сами в них не расходующиеся.
Ферменты катализируют химические реакции, происходящие в организме.
Ф ерменты
катализируют превращение веществ,
которые называются субстратами (S)
в продукты (P):
ерменты
катализируют превращение веществ,
которые называются субстратами (S)
в продукты (P):
Отличие ферментов от небиологических катализаторов:
-
Высокая эффективность действия (скорость ферментативных реакций в 106 – 1012 раз выше, чем соответствующих неферментативных реакций).
-
Высокая специфичность действия (фермент катализирует превращение одного конкретного субстрата, либо схожей группы субстратов).
-
Мягкие условия протекания ферментативных реакций (t ~ 37 C, нормальное атмосферное давление, pH, близкий к нейтральному).
-
Способность к регуляции.
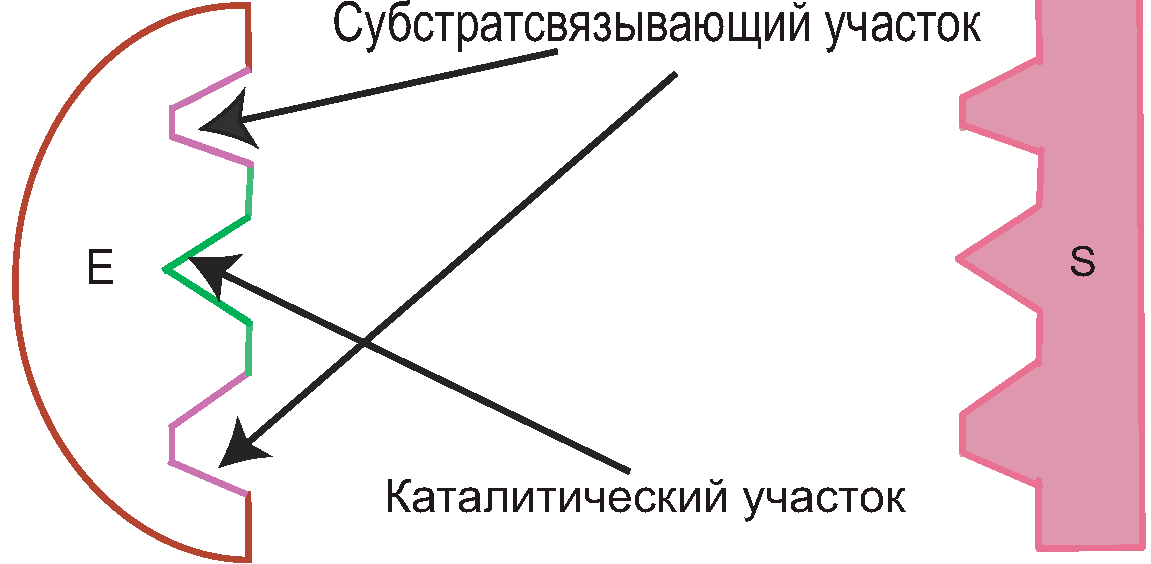
Активный центр фермента:
-
Участок молекулы фермента, сформированный на уровне третичной структуры, ответственный за связывание с субстратом по принципу комплементарности и участвующий в катализе.
-
Расположен в узком гидрофобном углублении (щели) поверхности молекулы фермента.
-
Активный центр фермента в отличие от активного центра белка имеет 2 участка:
-
Субстратсвязывающий участок;
-
Каталитический участок.
-
-
В активный центр фермента часто входит участок или домен для связывания кофактора.
Типы специфичности ферментов
I. Субстратная II. Каталитическая


 (пути
превращения)
(пути
превращения)
Абсолютная
1.
Стерео-
специфичность
3.
Относительная
(групповая)
2.
I.1. Абсолютная субстратная специфичность – Фермент катализирует превращение только одного конкретного субстрата.
Пример:

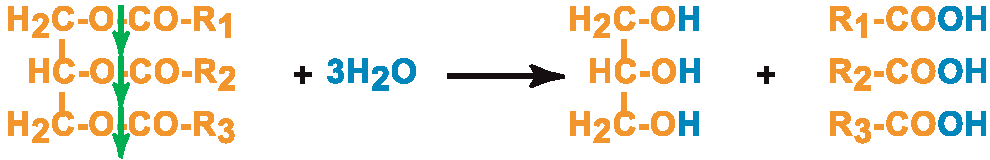
I.2. Относительная (групповая) субстратная специфичность – Фермент катализирует однотипные превращения схожих по строению веществ.
Пример: Фермент Липаза катализирует гидролиз жиров:
I.3. Стереоспецифичность – Фермент катализирует превращение только одного из стереоизомеров для данного вещества.
Пример: Фермент Фумараза катализирует присоединение воды только к фумарату, но не к малеиновой кислоте:

II. Каталитическая специфичность (специфичность пути превращения) – фермент катализирует только одно превращение субстрата из всех возможных:
П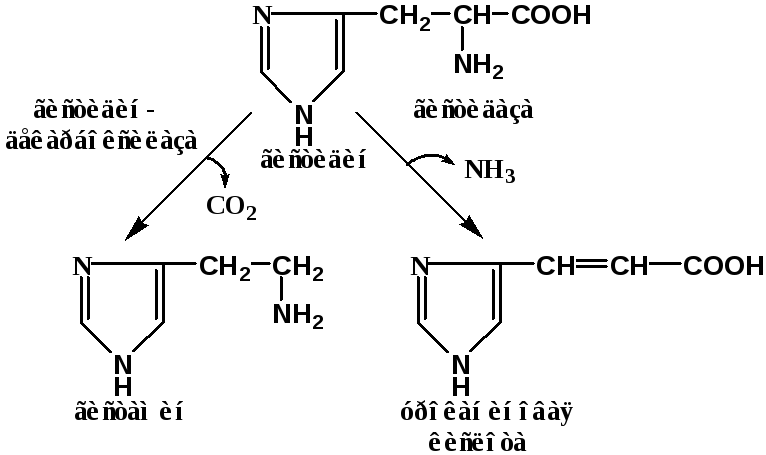 ример:
ример:
Этапы ферментативного катализа.
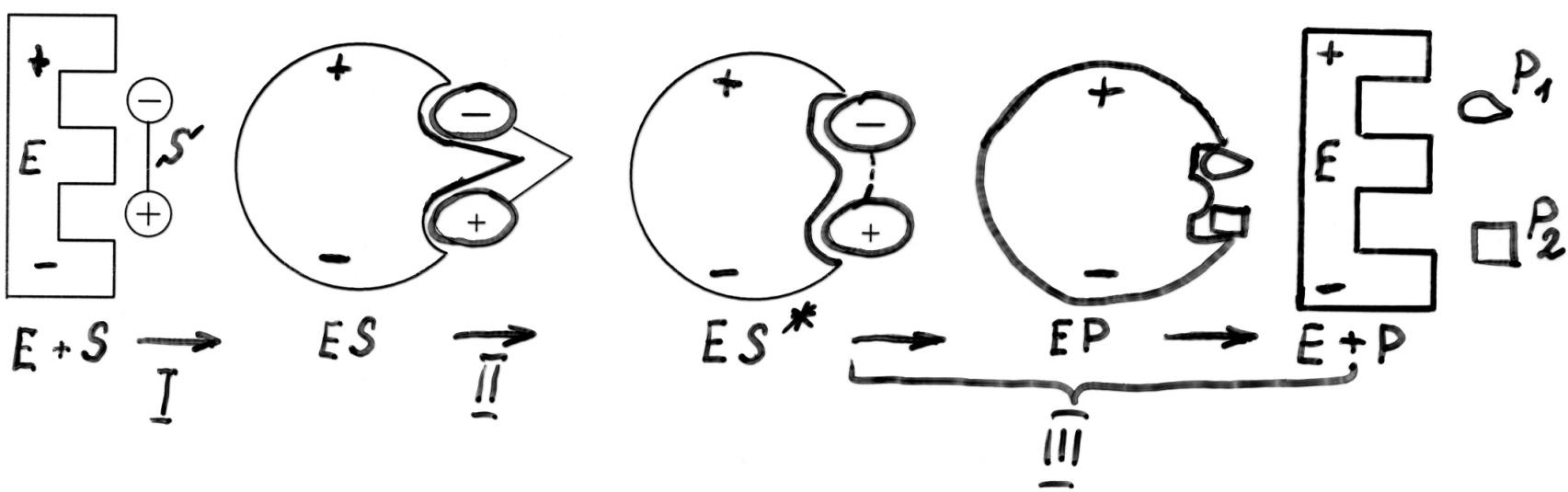
I – образование фермент-субстратного комплекса:
На этом этапе: а) субстрат приближается к активному центру фермента.
б) происходит взаимное изменение конформации E и S, возникает строгая комплементарность между S и активным центром E (индуцированное соответствие).
II. Дестабилизация связей в молекуле субстрата.
III. Образование продуктов реакции и выход их из области активного центра фермента.
(III этап часто делят на III и IV:
III этап: образование продуктов реакции.
IV этап: выход продуктов из области активного центра фермента.)
Кинетика ферментативных реакций.
I. Зависимость скорости реакции от концентрации субстрата:
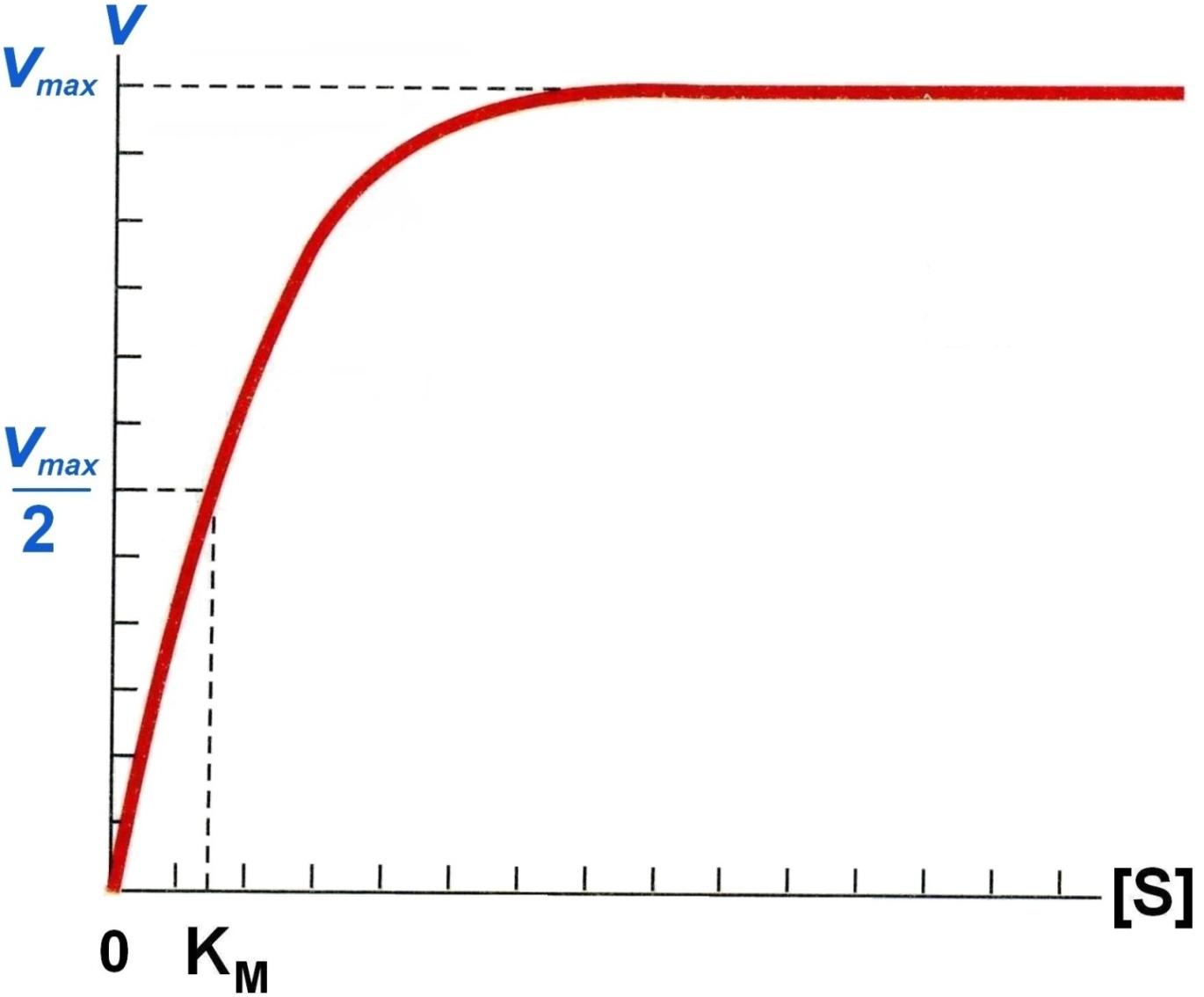
Vmax – это такая V ферментативной реакции, при которой достигается полное насыщение фермента субстратом, т.е. когда все активные центры фермента связаны с субстратом.
KM – константа Михаэлиса:
1) KM численно равна концентрации субстрата, при которой скорость реакции равна ½ Vmax.
2) KM показывает сродство E к S. Чем меньше KM, тем больше сродство и наоборот.
II. Зависимость скорости реакции от температуры: