- •Министерство здравоохранения и социального развития Российской Федерации
- •Тема: Способы выражения состава растворов. Приготовление растворов Решение задач
- •Тема: Количественный анализ. Теоретический материал к занятию:
- •Домашнее задание:
- •Лабораторная работа. Определение массы гидроксида натрия в растворе.
Ф![]() .И.О.____________________________
Группа _______________ Факультет
______________________
.И.О.____________________________
Группа _______________ Факультет
______________________
Министерство здравоохранения и социального развития Российской Федерации
Государственное бюджетное образовательное учреждение высшего профессионального образования
ПЕРВЫЙ МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ
УНИВЕРСИТЕТ имени И.М. СЕЧЕНОВА

ОБУЧАЮЩАЯ ЛАБОРАТОРНАЯ ТЕТРАДЬ
ПО КУРСУ ОБЩЕЙ ХИМИИ

СТУДЕНТА_____________________ ГРУППЫ
__________________________ФАКУЛЬТЕТА
__________________________ОТДЕЛЕНИЯ
ФАМИЛИЯ _____________________________
ИМЯ ___________________________________
ОТЧЕСТВО _____________________________
ПРЕПОДАВАТЕЛЬ ______________________
20___ - 20____ учебный год
Москва
Занятие 1. Дата ____.____. 20___
Тема : Способы выражения состава растворов. Приготовление растворов.
Теоретический материал к занятию:
Эквивалент – это реальная или условная частица вещества Х, которая в данной кислотно-основной реакции эквивалентна одному иону водорода или в данной окислительно-восстановительной реакции одному электрону.
Массовая доля
растворенного вещества ![]()
Х – растворенное вещество
Молярная концентрация,
![]()
Молярная концентрация
эквивалента 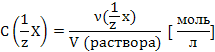
Фактор
эквивалентности, ![]()
Молярная масса
эквивалента, ![]()
Плотность раствор,
![]()
Моляльная
концентрация, ![]()
Задача.
Какой объем соляной кислоты (ρ=1,070 г/мл) и воды необходим для приготовления раствора HCl объемом 200 мл и молярной концентрацией 0,1 моль/л для кислотно-основного титрования натрия тетрабората.
|
Дано |
Решение |
|
V (р-р) =200 мл = 0,2 л С (HCl) = 0,1 моль/л ρ (р-р) = 1,07 г/мл М (HCl) = 36,5 г/моль _____________________ m ( р-р HCl) и V (H2O) = ?
|
(m (р-р HCl) – неизвестна) |
2. Массу исходного раствора HCl можно рассчитать по формуле :
m (p-p HCl) = m (HCl) / V (HCl) (m (HCl) и V (HCl) – неизвестны)
3. Массовую долю ω можно найти в справочнике, зная плотность ρ исходного раствора HCl. Массу HCl можно рассчитать зная молярную массу вещества и количество вещества
m (HCl) = M (HCl) · n (HCl) (n (HCl) – неизвестно)
4. Количество вещества HCl можно рассчитать зная объем раствора и его концентрацию
n (HCl) = V (p-p) · C(HCl) (обе величины даны в условии задачи)
4.1 n (HCl) = 0,2 л · 0,1 моль/л = 0,02 моль
4.2 m (HCl) = 36,5 г/моль · 0,02 моль = 0,73 г
4.3 ω (%) = 14% или ω (в долях) = 0,14 (по таблице №14)
4.4 m (p-p HCl) = 0,73 г / 0,14 = 5,2 г
4.5 V (р-р HCl) = 5,2 г / 1,07 г/мл = 5мл
4.6 V(H2О) = 200 мл - 5 мл = 195 мл
Тема: Способы выражения состава растворов. Приготовление растворов Решение задач
1. Можно ли использовать для инъекций раствор хлорида натрия, с концентрацией 0,154 моль/л (плотность раствора 1,001 г/л.)?
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2. Рассчитайте молярную концентрацию раствора пероксида водорода с массовой долей вещества равной 3% (плотность раствора пероксида водорода с массовой долей вещества 2% равна 1,0058 г/л, а с массовой долей вещества 4% равна 1,013 г/л.).
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
3. Вычислите, какую массу раствора соли с массовой долей 10% следует взять для приготовления 100 г раствора той же соли с массовой долей, равной 6%.
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
4. Смешали по 100 мл растворов KI и КВr с концентрациями 0,1 моль/л. Какова стала концентрация ионов калия и йодид-ионов?
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
|
ХИМИЧЕСКАЯ ПОСУДА | ||
|
|
|
|
|
Мерная колба |
Коническая колба |
Пробирки |
|
|
|
|
|
Бюретка |
Химический стакан |
Пипетка Мора |
|
|
|
|
|
Мерные цилиндры |
Воронка |
Капельница |
|
|
|
|
|
Чашка Петри |
Предметные стекла |
Стеклянные палочки |
|
|
|
|
|
Штатив |
Горелка |
Штатив Бунзена |
Занятие 2. Дата ____.____. 20___