
ЛР БТС / 0501_Konunnikov_otschet_LR_4
.docxМИНОБРНАУКИ РОССИИ
Санкт-Петербургский государственный
электротехнический университет
«ЛЭТИ» им. В.И. Ульянова (Ленина)
Кафедра физической химии
отчет
по лабораторной работе №4
по дисциплине «Химия»
Тема: Скорость химических реакций
Студент гр. 0501 |
|
Конунников Г.А. |
Преподаватель доц., к. х. н. |
|
Рахимова О.В. |
Санкт-Петербург
2020
Цель работы: Изучение влияния концентрации реагирующих веществ и температуры на скорость гомогенной химической реакции.
Основные теоретические положения
Скорость химической реакции – это изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства. И определяется по формуле (1):
|
(1) |
где ∆n
– изменение количества вещества, моль;
∆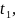 t
– изменение времени, с;
V
– объем, л.
t
– изменение времени, с;
V
– объем, л.
Скорость химической реакции зависит от: концентрации, природы реагирующих веществ, наличие катализатора, температуры (правило Вант-Гоффа, Уравнение Аррениуса), давления, площадь поверхности реагирующих веществ.
Зависимость скорости химической реакции от концентрации определяется законом действующих масс: закон действующих масс устанавливает соотношение между массами реагирующих веществ в химических реакциях при равновесии, а также зависимость скорости химической реакции от концентрации исходных веществ. Он определяется по формуле (2):
|
(2) |
где v
– скорость химической реакции,
 ;
k
– константа скорости химической реакции;
[A],
[B]
– молярные концентрации веществ.
;
k
– константа скорости химической реакции;
[A],
[B]
– молярные концентрации веществ.
Константой скорости химической реакции называется численно равна скорости реакции при концентрации каждого из реагирующих веществ равной 1 моль/л., и она зависит от температуры, присутствия катализатора.
Скорость химической реакции от влияния температуры и описывается правилом Вант-Гоффа: При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два—четыре раза. Правило Вант-Гоффа определяется формулой (3):
|
(3) |
где

 – скорости при температурах
– скорости при температурах
 ;
;
 – температурный коэффициент скорости
реакции, принимающий значения 2-4 для
большинства реакций.
– температурный коэффициент скорости
реакции, принимающий значения 2-4 для
большинства реакций.
Физический смысл температурного коэффициента γ – заключается в том, что он показывает во сколько раз увеличивается скорость химической реакции при увеличении температуры на каждые 10 °С.
Зависимость константы скорости химической реакции от температуры описывается основным законом химической кинетики – уравнением Аррениуса (4):
|
(4) |
где k
– константа скорости реакции; A
– предэкспоненциальный множитель; e
– основание натурального логарифма;
Ea
– энергия активации, Дж/моль;
R
– молярная газовая постоянная, R
= 8,31
 ;
T
– температура, К;
;
T
– температура, К;
Энергия активации химической реакции – это эмпирически определяемый параметр, характеризующий показательную зависимость константы скорости реакции от температуры.
Энергия активации химической реакции зависит от природы реагирующих веществ, катализатора и не зависит от температуры.
В лабораторной работе для исследования зависимости скорости реакции от концентрации и температуры используется реакция:
Na2S2O3+H2O+H2SO4 → Na2SO4 + SO2 + S + H2O
Обработка результатов
1. Зависимость относительной скорости химической реакции от концентрации можно увидеть на графике 1.

2. Зависимость относительной скорости химической реакции от температуры можно увидеть на графике 2.

3. На основании правила Вант-Гоффа по формуле (3), выразим и рассчитаем температурный коэффициент γ для трех пар.
 ;
;
 ;
;
 .
.
4. На основании
формулы (4)
выведем значение
 и рассчитываем
энергию активации реакции для трех пар
температур.
и рассчитываем
энергию активации реакции для трех пар
температур.
 Дж;
Дж;
 Дж;
Дж;
 Дж.
Дж.
Выводы: в ходе работы можно проследить, что в зависимости от увеличения скорости химической реакции, концентрация Na2S2O3 увеличивается, а также от температуры опыта, т.е. взаимосвязь между величинами прямопропорциональная.
 ;
;
 ,
,
 ;
;
Следовательно, для реакции правило Вант-Гоффа соблюдается.

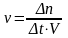 ,
, ,
, ,
, ,
,