
Количественный анализ. Метод кислотно-основного титрования
.pdf
где N – нормальность титруемой сильной кислоты, V1 – объем сильной кислоты (мл),
V2 – общий объем раствора в конце титрования (мл),
;










 ;
;
.
Следует помнить, что индикатор подобран правильно лишь в том случае, если погрешность лежит в пределах 0,1–0,2%.
3.5. Расчеты результатов анализа
Расчет результатов анализа основан на принципе эквивалентности, в соответствии с которым вещества реагируют между собой в эквивалентных количествах:
N1·Vl=N2·V2 , если индекс 1 отнести к стандартному раствору.
Как основу расчетов обычно используют понятие «эквивалентная масса». Эквивалентная масса вещества, участвующего в кислотно-основной реакции, равна массе, которая либо реагирует с одним грамм-ионом водорода, либо вызывает его образование в данной реакции. Так, для реакции Н3РО4 + КОН ↔ КН2РО4 + Н2О эквивалентная масса Н3РО4 равна молекулярной массе, а для реакции Н3РО4 + 2 КОН ↔ К2НРО4 + 2 Н2О
эквивалентная масса H3PO4 будет равна половине молекулярной массы. Соответствующей единицей концентрации является нормальность – число
грамм-эквивалентов растворенного вещества, содержащегося в одном литре раствора. Широко распространен способ расчета результатов анализа с помощью титра раствора и титра по определяемому веществу. Титр показывает число граммов растворенного вещества в одном миллилитре раствора. Титр по определяемому веществу показывает массу определяемого вещества, которая соответствует одному миллилитру рабочего раствора.
3.6. Ошибки определения
Различают абсолютную и относительную ошибки определения.
Разность между полученным результатом и истинным значением определяемой величины, выраженная в абсолютных единицах, называют абсолютной ошибкой определения. Отношение абсолютной ошибки к истинному значению определяемой величины называется относительной ошибкой. Если истинное значение определяемой величины неизвестно, то вместо него берут среднее арифметическое из результатов проделанных определений. Абсолютная ошибка опыта не должна превышать 5%.
11
4. Вопросы для самостоятельной подготовки к коллоквиуму потеме «Кислотно-основное титрование»
1. Сущность титриметрического анализа. Требования, предъявляемые к реакциям в титриметрическом анализе. Точка эквивалентности и конечная точка титрования. Основные расчетные формулы.
2. Классификация методов титриметрического анализа по характеру реакций, лежащих в основе определения, и по способу титрования (прямое и обратное, определение по замещению).
3. Рабочие растворы в методе кислотно-основного титрования. Первичные стандартные растворы. Первичные стандарты, требования, предъявляемые к ним. Вторичные стандартные растворы. Приготовление стандартных растворов из фиксаналов.
4. Графический метод изображения титрования. Расчет и построение кривых титрования сильных и слабых протолитов. Скачок титрования. Зависимость величины скачка титрования от константы кислотности или основности, концентрации растворов, температуры. Титрование смеси протолитов и многопротонных кислот. Титрование солей.
5.Кислотно-основное титрование в неводных средах. Классификация
неводных растворителей |
по протолитическим |
свойствам |
и по |
влиянию |
на силу электролитов. Автопротолиз. |
Влияние |
диэлектрической |
||
проницаемости растворителя на силу кислот и оснований. |
|
|
||
6. Кислотно-основные |
индикаторы. Ионная |
и хромофорная |
теории |
|
индикаторов. Ионно-хромофорная теория. Интервал перехода окраски индикатора. Показатель титрования (рТ). Наиболее часто применяемые кислотно-основные индикаторы, их характеристика. Выбор индикатора для различных типов кривых титрования. Влияние различных факторов на
показания индикатора. Смешанные индикаторы. Индикаторные |
ошибки |
титрования, их вычисление. |
|
7. Примеры практического применения кислотно-основного |
титрования. |
Определение кислот и щелочей. Определение жесткости воды. |
|
5.Задачи и упражнения
1.Из 5,3 г Na2CO3 приготовили 1 дм3 раствора. Для этого раствора вычислить молярную концентрацию, нормальность и титр. (Ответ: С=0,1000
моль/дм3; N=0,2000 моль/дм3; T=0,0053 г/дм3).
2.Титр раствора HNO3, равен 0,0063 г/см3. Вычислить молярную концентрацию этого раствора и Т (HNO3/CaO). (Ответ: T=0,0028 г/см3).
3.Какую массу (100% NaOH) щелочи следует взять для приготовления одного дм3 раствора с титром 0,0040 г/см3? (Ответ: m=4,00 г).
4.Какую навеску буры (Na2B4O7 ∙10H2O) следует взять для приготовления
0,5 дм3 0,1 М раствора? ( Ответ: m=19,0685 г).
5.Сколько раствора НС1 плотностью 1,1 г/см3 (20,39% HCl) следует взять для приготовления 1 дм3 0,2 М раствора? (Ответ:V=32,5 см3).
12
6.Сколько раствора HNO3 плотностью 1,15 г/см3 (20,48% HNО3) следует взять для приготовления 1 дм3 раствора с T(HNO3)=0,0063 г/см3? (Ответ: V= 21,5 см3).
7.До какого объема следует разбавить 1 дм3 0,2 М раствора HNO3, чтобы получить раствор с T(HNO3)=0,0063 г/см3? (Ответ: до 2,000 дм3).
8.Сколько 2 М раствора НСl следует добавить к 1 дм3 0,15 М раствора HCl, чтобы получить 0,2 М раствор? (Ответ:V=27,78 см3).
9.Вычислить молярную концентрацию раствора HNO3, если на титрование 0,2500 г химически чистой Na2CO3 израсходовали 20,50 см3 этого раствора. (Ответ: С=0,2301М).
10.Растворением навески тетрабората натрия (буры) 0,6227 г приготовили
200 см3 раствора; 20 см3 этого раствора оттитровали 19,5 см3 раствора HCl. Вычислить нормальность раствора буры и молярную концентрацию раствора НС1.(Ответ: С(буры)=0,01633 моль/дм3; С(HCl)=0,1675 М).
11.Вычислить массовую долю индифферентных примесей в образце технической азотной кислоты, если навеска ее 1,000 г оттитрована 24,00 см3
КОН; Т(КОН)=0,01120 г/см3. (Ответ: 68.56%).
12.Навеска уксусной кислоты 1,000 г растворена в мерной колбе вместимостью 200 см3. На титрование 20 см3 этого раствора израсходовали 15,50 см3 раствора NaOH; T(NaOH)=0,004088 г/см3. Вычислить массовую долю CH3СООН в образце. (Ответ: 95,12%).
13.К анализируемому раствору хлорида аммония прибавили 25,00 см3 раствора NaOH с T(NaOH)=0,004500 г/см3. Затем кипячением удалили из раствора аммиак, а избыток NaOH оттитровали 10,50 см3 раствора НС1 с Т(HCl)=0,003750 г/см3. Вычислить массу аммиака в анализируемом растворе. (Ответ: m=2945 мг).
14.Вычислить величину навески химически чистого СаСО3, если после обработки ее 50,00 см3 0,2 М раствора НС1 на титрование остатка кислоты израсходовано 10,00 см3 раствора NaOH. Установлено, что на титрование
25,00 см3 NaOH расходуется 24,00 см3 HCI. (Ответ: m=404,3 мг).
15.Вычислить рН раствора, полученного при титровании в момент, когда к
20см3 0,2 М раствора добавлен 0,2 М раствор NaOH в количестве: а) 17,00 см3;
б) 20,00 см3; в) 21,00 см3.(Ответ: а) 1,8; б) 7; в) 12,8).
16.Определить скачок титрования при нейтрализации 0,01 М раствора HCI 0,01 раствором NaOH и подобрать индикатор для этого титрования.
17.Определить скачок титрования при нейтрализации 0,05 М раствора CН3СOOH 0,1 М раствором NaOH и подобрать индикатор для этого титрования.
18.Вычислить рН раствора, полученного при титровании в момент, когда к
10см3 0,2 М раствора NH4OH добавлен 0,1 М раствор НС1 в количестве: а) 10,00 см'; б) 15,00 см3; в) 20,00 см3. (Ответ: а) 9,3; б) 9,9; в) 5,1).
19.Можно ли точно оттитровать 0,01 М раствор HCI 0,01 М раствором NaOH с бромфеноловым синим (рТ=3.8)?(Ответ: нет).
20.Можно ли точно оттитровать 0,01 М раствор СН3СООН 0,1 М раствором
13
NaOH с нейтральным красным (рТ=7)? (Ответ: нет).
21.Вычислить погрешность титрования 20 см3 0,1 М раствора СН3СООН
0,1 М раствором NaOH до pH=10 (Ответ: OH=0,2%).
22.Вычислить погрешность титрования 20 см3 0,1 М раствора NH4OH 0,2 М раствором НС1 до рН=4. (Ответ: Н+=0,075%).
23.На титрование навески 0,7092 г натриевого щелочного вещества в присутствии фенолфталеина расходуется 12,95 мл, а в присутствии метилового оранжевого 26,02 мл 0,5100 н. раствора серной кислоты. Что является основным продуктом в исследуемом веществе и какова его массовая доля? (Ответ: Na2СО3; 98,7%).
24.Какую навеску 80% карбоната натрия надо взять, чтобы на титрование ее с фенолфталеином пошло 20 мл 0,1000 н. раствора HСl.(Ответ: m=0,2650 г).
25.Какой из индикаторов (метиловый оранжевый, фенолфталеин, лакмус)
пригоден для титрования: a) C6H5COOH+NaOH; б) HCOOH+NaOH; в) HNO3+NaOH; г) NH3+HCl; д) Na2CO3+HCl; e) Nа2СО3+2 НС1; ж) KCN+HCl; з) Na3PO4+HCl; и) Na3PO4+2 HCl?
26. В каком случае (из двух сравниваемых) величина скачка титрования будет больше: а) 0,1 М NH3+0,1 М HCl и 0,1 М NaOH+0,1 М HCl; б) 0,1 М СH3СОH+0,1 M NaOH и 0,1 М HCl+0,1 М NaOH; в) 0,1 М HF+0,1 М NaOH и 0,1 М HIO3+0,1 M NaOН?
27.Для нейтрализации 5,0 мл раствора серной кислоты потребовалось 4,82 мл 0,1012 н. раствора едкого натра. Вычислить нормальность и титр кислоты.
28.Сколько мл 0,16 н. раствора хлорида натрия необходимо для осаждения всего серебра из раствора, содержащего 3,4 г серебра?
29.К 12,0 мл раствора гидроксида калия добавили 20,0 мл 0,12 н. раствора серной кислоты. Для нейтрализации избытка кислоты потребовалось прилить к раствору 6,0 мл 0,09 н. раствора гидроксида натрия. Вычислить нормальность взятого раствора гидроксида калия.
30.К 10,0 мл раствора синильной кислоты добавили нитрат серебра в избытке. На нейтрализацию полученного раствора, содержащего азотную кислоту, потребовалось 7,65 мл 0,01966 н. раствора едкого натра. Рассчитать нормальность раствора синильной кислоты.
31.Сколько мл 36% раствора соляной кислоты ( ρ=1,18 г/мл) потребуется для приготовления 10 л 0,05 н. раствора?
32.На титрование раствора, содержащего 0,4980 г Na2B4O7•10H2O, израсходовано 25,2 мл соляной кислоты. Вычислить нормальность и титр соляной кислоты.
33.Смешали разные объемы 0,004 н раствора едкого натрия и 0,002 н раствора соляной кислоты. Каково значение рН полученного раствора?
34.Вычислить рН для растворов, в которых [Н+] составляет 0,2; 0,04; 4•10-3; 5•10-6 моль/л.
35.Вычислить [Н+] и [ОН-] для растворов, имеющих следующие значения рН: 1,6; 4,0; 4,52; 9,16; 12,7.
14
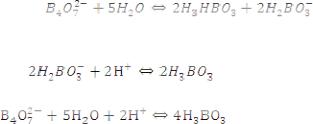
36.Вычислить степень ионизации уксусной кислоты в 0,001 н. раствора и рН этого раствора ( Кк =1,8•10-5 ).
37.Приготовили раствор, содержащий уксусную кислоту и ацетат натрия в равных молярных концентрациях. Вычислить рН раствора (Кк=1,8•10-5).
38.Чем можно объяснить, что раствор дигидрофосфата калия имеет кислую реакцию, а раствор гидрофосфата – щелочную?
39.Что такое интервал перехода индикатора и показатель титрования?
40.Каково соотношение между точкой нейтральности и точкой эквивалентности?
41. Вычислить рН 0,1н. растворов следующих кислот: азотистой
( Кк =5,1· 10-4), борной (5,8·10-10 ), дихлоруксусной (5,0·10-2), муравьиной (1,8· 10-4 ), сероводородной ( КI=1·10-7 ).
42.Вычислить рН в точке эквивалентности при нейтрализации тех же растворов кислоты (см. упр. 41) 0,1 н. раствором едкого натра.
43.К 15 мл 0,1 н. раствора соляной кислоты добавили 21 мл 0,1н. раствора едкого натра. Вычислить рН полученного раствора.
44.Построить кривую титрования 0,02 н. раствора едкого натра 0,02 н. раствором соляной кислоты.
45.Содержание соляной кислоты в желудочном соке человека составляет 0,4–0,5 %. Вычислить рН желудочного сока приняв его плотность за 1г/мл.
6.Экспериментальная часть
6.1. Лабораторная работа № 1. Приготовление рабочего титрованного раствора соляной кислоты
|
Реактивы: |
1. |
НСl 0,1 н. |
2. |
Na2B4O7 ·10 H20 0,1 н. |
3. |
Индикаторы: метиловый оранжевый, фенолфталеин, смешанный. |
Стандартный раствор НС1 обычно готовят разбавлением соответствующего объема концентрированной HCl, полученный раствор стандартизируют по первичному стандарту (в данном случае Na2B4О7 ·10 H2О).
Тетраборат в водном растворе подвергается гидролизу
Н2ВО3 - – недотитрованная борная кислота, которая ведет себя как основание, которое может быть оттитровано кислотой:
Суммарное уравнение –
Следовательно, эквивалент тетрабората равен половине молекулярной массы.
Кроме того, исходный раствор тетрабората натрия представляет собой
15

буферный раствор, у которого СА= СВ, и рН = рК (Н3ВО3) =9,24, то есть действительно имеет щелочную реакцию.
В точке эквивалентности в растворе будет присутствовать слабая борная кислота, рН которой можно рассчитать (С=0,1н.):








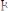









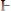


 ; рН = 5,12.
; рН = 5,12.
Следовательно, в качестве индикатора можно использовать метиловый оранжевый (рТ=4,1), смешанный (бромкризоловый синий и метиловый оранжевый в соотношении 3:1, рТ=5,1) или метиловый красный (рТ=5,2).
Возможно также использование другого смешанного индикатора (метиленовый красный и метиленовый синий в соотношении 1:1, рТ=5,4), переход окраски из зеленой (щелочная среда) в красно-фиолетовую (кислая среда).
Методика. Аликвоту 10 мл первичного стандартного раствора (Na2B4O7·10 Н2O) переносят в колбу для титрования, разбавляя 20 мл дистиллированной воды (отмеряют цилиндром или мерным стаканом), добавляют 1–2 капли индикатора метилового оранжевого и титруют при перемешивании из бюретки раствором НС1 до перехода окраски раствора из желтой в оранжевую. Если используют индикатор метиловый красный, то титрование заканчивают, когда желтая окраска раствора переходит в оранжево- розовую, если смешанный – зеленая окраска переходит в вино-красную.
При титровании с метиловым оранжевым или метиловым красным удобно пользоваться раствором свидетеля. Готовят его следующим образом. В колбу для титрования вносят 40 мл воды, 1–2 капли метилового оранжевого и 1–2 капли 0,1 н. раствора НС1 до изменения окраски раствора.
Титрование проводят до тех пор, пока параллельные определения (не менее трех) не будут отличаться более чем на 0,1–0,2 мл. Данные титрования занесите в таблицу и рассчитайте нормальность НС1.
|
|
|
|
|
|
|
NHCl, |
|
|
Индикатор |
VHCl, мл |
|
V |
||
экв/л |
мл |
|
|
HCl, |
экв/л |
||
|
|
мл |
|||||
|
|
|
|
|
|
|
|
6.2. Лабораторная работа № 2. Определение нормальности раствора NaOH по титрованному раствору НСl
Реактивы:
1.НС1 (0,1н. титрованный раствор).
2.NaOH ( 0,1 н.).
3.Индикаторы: метиловый оранжевый, фенолфталеин.
Методика. В колбу для титрования вносят 10 мл раствора NaOH, 1–2 капли индикатора и титруют точным раствором НСl до перехода окраски
16
индикатора. Или делают наоборот: титруют аликвоту кислоты раствором NaOH из бюретки до появления характерной окраски индикатора, устойчивой в течение 30 секунд.
При титровании кислоты со щелочью перемешивание не должно быть слишком интенсивным во избежание поглощения раствором СО2 из воздуха.
Данные титрования занесите в таблицу, аналогичную таблице в лабораторной работе № 1, и рассчитайте нормальность щелочи.
6.3. Лабораторная работа № 3. Определение содержания хлороводородной кислоты в растворе с различными индикаторами.
Расчет нндикаторной ошибки
Реактивы:
1.NaOH (0,1н. титрованный раствор).
2.НСl (анализируемый раствор).
3.Индикаторы: метиловый оранжевый, фенолфталеин, смешанный.
Титрование ведется так же, как и в случае стандартизации раствора щелочи. По данным титрования рассчитывают содержание соляной кислоты в pacтворе (г), относительную ошибку эксперимента, индикаторную ошибку, ее знак.
6.4. Лабораторная работа № 4. Определение фосфорной кислоты
Реактивы:
1.NaOH (0,1 н. титрованный раствор).
2.Н3Р04.
3.Индикаторы: метиловый оранжевый, фенолфталеин.
4.NaH2PO4(0,033М).
Фосфорная кислота является трехосновной кислотой и не принадлежит к числу сильных кислот. Константы диссоциации равны:
К1=7,6×10-3; рК1=2,21;
К2=6,2×10-8; рК2=7,21; К3=4,2×10-13; рК3=12,38.
Прямое дифференцированное титрование возможно по первым двум ступеням (К1/К2≈105 и К2/К3≈105). Третьего скачка на кривой титрования наблюдаться не будет.
Подобрать индикаторы можно, рассчитав рН в 1-й и 2-й точках эквивалентности.
1-я т.э. Состав раствора: NaH2PO4, Н2О.
H2PO4 – амфолит, то есть может быть и кислотой, и основанием.
Индикаторы: метиловый оранжевый и смешанный.
2-ят.э. Составраствора:Na2HPO4, Н2О.
HPO42- – амфолит, то есть может быть и кислотой, и основанием.
Индикатор: фенолфталеин.
17

Для определения фосфорной кислоты проводят два титрования с двумя индикаторами. Эквивалентная масса но метиловому оранжевому равна 98 г/моль, а по фенолфталеину– 49 г/моль.
Методика. В бюретку наливают стандартный раствор щелочи. Для титрования Н3РО4 до NaH2PO4 отбирают пипеткой 10 мл исследуемого раствора фосфорной кислоты, прибавляют 10 мл дистиллированной воды, 1–2 капли метилового оранжевого и титруют щелочью до перехода окраски раствора из розовой в желтую. (Титрование лучше проводить в присутствии свидетеля. В качестве свидетеля применяют 0,033 М раствор NаН2РО4. Для приготовления свидетеля в коническую колбу мерным цилиндром отбирают 30 мл раствора, к которому прибавляют 1–2 капли метилового оранжевого.) Титрование проводят не менее трех раз.
Для титрования Н3РО4 до Na2HPO4 отбирают пипеткой 10 мл раствора фосфорной кислоты, прибавляют 2 капли фенолфталеина и титруют щелочью до появления розовой окраски.
Данные титрования занести в таблицу:
,мл |
|
,мл |
Индикатор |
, мл |
|
|
|
|
|
По данным титрования рассчитайте содержание фосфорной кислоты и относительную погрешность эксперимента.
6.5. Лабораторная работа № 5. Определение хлороводородной и борной кислот при совместном присутствии
Реактивы:
1.NaOH (0,1 н. титрованный раствор).
2.Анализируемый раствор, содержащий HCl и СН3СООН.
3.Индикаторы: метиловый оранжевый, фенолфталеин.
При титровании смеси сильной и слабой кислот до начала титрования концентрация ионов Н+ будет практически равна концентрации сильной кислоты, так как в ее присутствии ионизация слабой кислоты будет полностью подавлена. По этой причине при титровании такой смеси с подходящими индикаторами практически полностью будет оттитрована только сильная кислота, а затем, если константа ионизации слабой кислоты не очень мала (КНАn ≥ 10 -7), будет оттитрована и эта кислота. Борная кислота является слабой кислотой (К = 6,4×10-10), поэтому непосредственно ее оттитровать нельзя. Но если в раствор добавить некоторые органические вещества (маннит, глицерин и т.п.), которые образуют с борной кислотой более сильные комплексные кислоты, то возможно титрование ее с таким индикатором, как фенолфталеин.
Методика. В бюретку наливают раствор щелочи. Раствор, содержащий соляную и борную кислоты, помещают в мерную колбу на 100 мл, доводят до метки дистиллированной водой и хорошо перемешивают. Затем
18

отбирают 10 мл раствора, переносят в коническую колбу, добавляют 1–2 капли метилового оранжевого и титруют раствором щелочи до перехода окраски индикатора из розовой в желтую. Отмечают количество щелочи, пошедшей на титрование в присутствии метилового оранжевого (оно соответствует содержанию соляной кислоты в пробе).
Затем в титруемый раствор добавляют 50 мл глицерина, хорошо перемешивают содержимое колбы, добавляют 5 капель фенолфталеина и продолжают титрование до перехода окраски из желтой в оранжево-красную. Добавляют еще 5 мл глицерина. Если оранжево–красная окраска исчезает, продолжают титровать до ее появления. Количество щелочи, пошедшей на титрование раствора в присутствии глицерина и фенолфталеина, соответствует содержанию борной кислоты.
Поправка. Глицерин может содержать некоторое количество свободной кислоты, на нейтрализацию которой затрачивается щелочь. Поэтому следует сделать поправку: в колбу для титрования вносят 10 мл глицерина, смешивают с 20 мл воды, добавляют 5 капель фенолфталеина и титруют до слабо-розовой окраски. Полученный объем щелочи вычитают из объема, затраченною на титрование борной кислоты.
Данные титрования занести в таблицу:
V |
NNaOH |
VNaOH, |
VNaOH, |
, |
, |
анализируемого |
|
идущий на |
идущий на |
идущий на |
идущий на |
раствора, мл |
|
титрование |
титрование |
титрование |
титрование |
|
|
HCl, мл |
Н3ВО3, мл |
HCl, мл |
Н3ВО3, мл |
|
|
|
|
|
|
По данным титрования рассчитайте нормальность, массу каждой кислоты в исследуемом растворе и относительную погрешность эксперимента.
6.6. Лабораторная работа № 6. Определение аммонийных солей
Реактивы:
1.NH4Cl (исследуемый раствор).
2.HCl (0,1 н. титрованный раствор).
3.NaOH (0,1 н. титрованный раствор).
4.CH2O (формальдегид 20%).
5.Индикатор: фенолфталеин.
Ион NH4+ ведет себя в водном растворе как слабая кислота, поэтому прямое титрование с кислотно-основными индикаторами невозможно.



























 ;
;
Соли аммония обычно определяют методом обратного титрования и
19
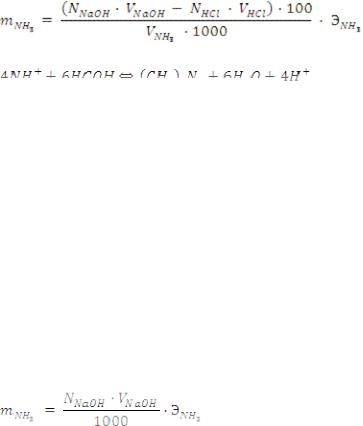
титрования по замещению.
Методика.Метод обратного титрования. В три колбы для титрования переносят по 10 мл исследуемого раствора соли аммония, добавляют в каждую по 15–20 мл раствора щелочи из бюретки (точно). Колбы оставляют на песчаной бане и нагревают до исчезновения запаха аммиака. Для того чтобы удостовериться в полноте отделения, можно в пары, не касаясь горлышка колбы, внести фильтровальную бумажку, смоченную раствором Hg2(NO3)2. Если в парах есть аммиак, бумажка чернеет. Растворы в колбах не должны кипеть во избежание разбрызгивания. Можно каждую колбу закрыть воронкой носиком вниз и затем воронку обмыть водой. Убедившись в отсутствии аммиака, колбы снимают, охлаждают. Если объем сильно уменьшился, его разбавляют водой, осторожно обмывая стенки колбы. Добавляют 1–2 капли фенолфталеина. Титруют раствором НСl из бюретки до обесцвечивания малинового раствора.
Определение содержания аммиака проводят по формуле для обратного титрования:
Метод замещения (формальдегидный). Метод основан на реакции


























 6
6











Образующаяся в результате кислота эквивалентна определяемой аммонийной соли, ее титруют раствором щелочи. Аликвоту анализируемого раствора переносят в колбу для титрования, добавляют из бюретки 5 мл 20% раствора формальдегида и дают постоять 2 минуты. Затем добавляют 2–3 капли фенолфталеина и титруют из бюретки медленно при перемешивании раствором щелочи до появления бледно-розовой окраски, устойчивой в течение 30 секунд.
Поправка. Формальдегид содержит некоторое количество муравьиной кислоты, на нейтрализацию которой расходуется стандартный раствор щелочи, поэтому следует ввести поправку. В колбу для титрования наливают 10 мл (двойное количество) 20% раствора формальдегида, добавляют 2–3 капли фенолфталеина и титруют щелочью до появления бледно-розовой окраски. Объем щелочи делят на две части, вычитают из общего объема, пошедшего на титрование исследуемого раствора. Расчет ведется по прямому титрованию:
6.7. Лабораторная работа № 7. Определение карбонатов и бикарбонатов (карбонатов и щелочи) при совместном присутствии
Реактивы:
1.Na2CO3+NaHCO3 (Na2CO3+NaOH) (исследуемый раствор).
2.НС1 (0,1 н. титрованный раствор).
3.BaCl2 (10%).
4.Индикаторы: фенолфталеин, метиловый оранжевый.
Раствор Na2CO3 в водном растворе ведет себя как двупротонное
20
