
лекции / все лекции по охт
.pdf
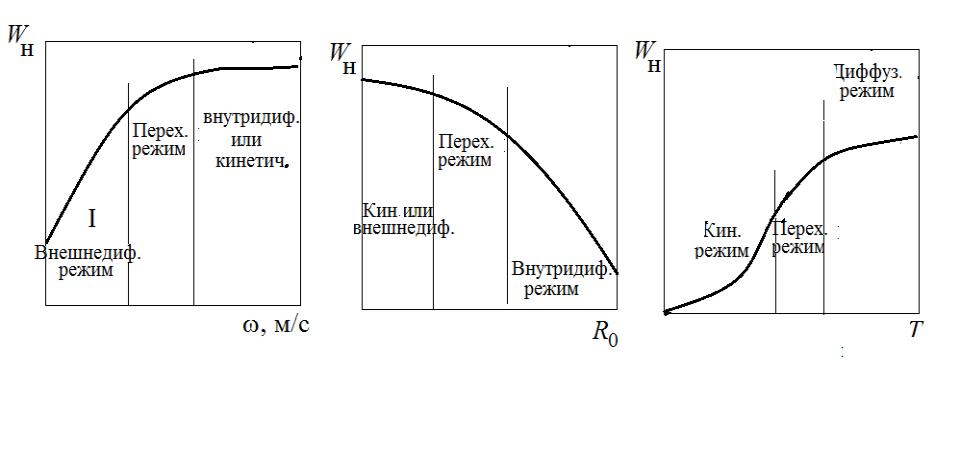
в) Кинетический режим
Лимитирующая стадия − химическая реакция, Для этой стадии движущая сила сЯ с0 будет максимальной, т.к. сЯ <<сП, сП с0 и
константа скорости реакции значительно ниже коэффициента массобмена и коэффициента диффузии D.
Наблюдаемая скорость процесса: |
W |
|||||
|
|
|
|
|
||
|
|
|
|
|
н |
|
Скорость III-го этапа WIII = |
|
|
2 |
2 |
|
|
4πR |
с |
|||||
|
kρ |
|||||
|
|
0 |
я |
0 |
||
Изменение размера ядра во времени: |
||||||
-d /dt = W |
III |
/(4 R 3n 2) = |
||||
я |
|
|
0 |
0 я |
||
|
3 |
2 |
с |
|
kρ |
||
|
R |
я |
0 |
|
|
|
|
|
0 |
|
|
kc0/(R0n0).
Интегрируем и получаем:
|
R n |
|
|
|
|
t |
0 0 |
ρ |
|
||
1 |
я |
|
|||
|
kс |
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
Расчетные формулы: t |
к |
= R n /(kс |
); |
t/tк = 1 − |
и t/tк = 1 − (1−х )1/3 |
|
0 0 0 |
|
я |
В |

Способы интенсификации гетерогенного процесса
а) tк = R0n0/(3 с0); б) tк = R02n0/(6Dс0); в) tк = R0n0/(kс0).
Концентрация компонента А в газовой фазе всегда благоприятно влияет на уменьшение tк, т.е. увеличение интенсивности процесса. Температура Т наиболее сильно влияет на величину константы скорости k, и именно в кинетическом режиме температура сильнее всего будет влиять на интенсивность процесса.
Скорость потока, обтекающего частицу влияет на коэффициент массообмена , и если процесс протекает во внешнедиффузионном режиме целесообразно перейти к турбулентному режиму.
Дробление частиц (уменьшение R0) всегда благоприятно влияет на интенсивность процесса, но особенно сильно во внутридиффузионной области.
18
ОПРЕДЕЛЕНИЕ ЛИМИТИРУЮЩЕЙ СТАДИИ
ЛЕКЦИЯ 5
ГЕТЕРОГЕННЫЙ КАТАЛИТИЧЕСКИЙ ПРОЦЕСС
Катализ – это явление ускорения химической реакции под влиянием веществ, называемых катализаторами.
Действие катализатора заключается в том, что он открывает новый реакционный путь. Не входя в стехиометрическое уравнение реакции, катализатор многократно вступает в химическое взаимодействие с участниками реакции с образованием промежуточных соединений. Образование любого из промежуточных соединений требует меньшей энергии активации, чем при проведении реакции в том же направлении в отсутствии катализатора. Катализатор восстанавливает свой химический состав после каждого цикла промежуточных взаимодействий.
•катализОСНОВНЫЕможет бытьХАРАКТЕРИСТИКИиспользован для ускоренияКАТАЛИЗАвсех термодинамически возможных химических реакций;
•с помощью катализатора можно возбудить («разбудить») термодинамически возможные химические реакции, а не только ускорить;
•наличие промежуточного химического взаимодействия катализатора с реагирующими веществами при катализе;
•катализатор не расходуется в процессе реакции в отличие катализатор от инициатора. Инициатор гибнет в ходе реакции и при этом вносит свободную энергию своего превращения в химическую систему, инициируя цепь химических превращений, тогда как катализатор не вносит свою свободную энергию в систему (не совершает работу);
3
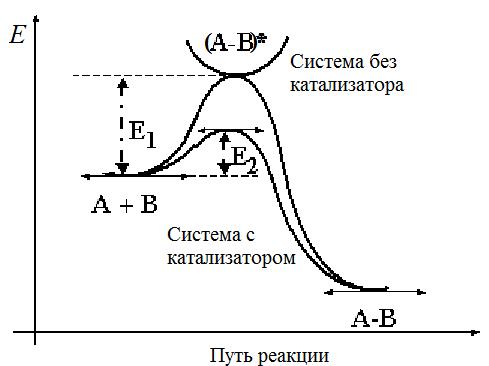
ИЗМЕНЕНИЕ ЭНЕРГИИ СИСТЕМЫ ПО РЕАКЦИОННОМУ ПУТИ
• Рисунок
КЛАССИФИКАЦИЯ КАТАЛИТИЧЕСКИХ РЕАКЦИЙ
по фазовым признакам каталитические реакции :
гомогенные,
гетерогенные
микрогетерогенные (ферментативные).
5
ПАРАМЕТРЫ ПОРИСТОЙ СТРУКТУРЫ
•Sуд − удельная внутренняя поверхность; на которой протекает реакция; значение Sуд для катализаторов составляет от 5 до
300 м2/г;
•− порозность − доля объема пор, через которые происходит
транспорт реагентов внутрь пористого зерна катализатора; обычно значение составляет 0,4−0,5;
•rп − средний радиус пор; его значения лежат в интервале 10− 100 нм.
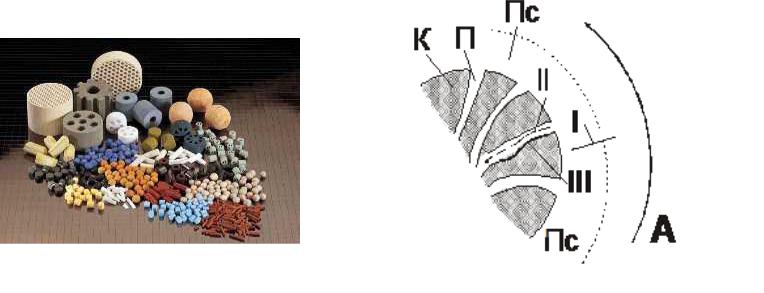
ГЕТЕРОГЕННЫЙ ПРОЦЕСС В ПОРИСТОМ КАТАЛИЗАТОРЕ
Схема и структура гетерогенно-каталитического химического
процесса:
К – катализатор П – поры катализатора
Пс – пограничный слой I, II, III – этапы процесса
