
- •Различают 4 вида субстратной специфичности ферментов:
- •Применение ферментов в качестве лекарственных препаратов
- •Окислительное декарбоксилирование пировиноградной кислоты: суммарное уравнение, строение и регуляция пируватдегидрогеназного комплексeа, связь с цпэ, биологическое значение.
- •Цикл трикарбоновых кислот (цитратный цикл): последовательность реакций, связь с цпэ, регуляция, биологическая роль.
- •Энергетическая
- •Теория Митчелла. Условия синтеза атф. Коэффициент фосфорилирования р/о.
- •Анаэробный гликолиз: схема процесса, энергетический эффект, и биологическое значение.
- •Лактатный цикл. Биологическое значение.
- •Глюконеогенез из аминокислот и глицерина. (схема процесса). Глюкозо- аланиновый цикл. Биологическое значение.
- •Синтез пуриновых нуклеотидов: схема, ферменты, регуляция, запасные пути синтеза.
- •Нарушения обмена пуриновых нуклеотидов: гиперурикемия, синтдром Леша-Нихана. Биохимические основы лечения подагры.
- •Биосинтез пиримидиновых нуклеодитов: схема, ферменты, регуляция, нарушения.
- •Нарушение обмена пиримидиновых нуклеотидов
- •Наследственная форма
- •Приобретенная форма
- •Распад пиримидиновых нуклеотидов: схема, ферменты.
- •Аденилатциклазная система передачи сигналов в клетки, роль g-белков в механизме трансдукции сигнала, вторичные посредники.
- •Либерины, статины, тропные гормоны гипофиза.
- •Адреналин: строение, синтез, регуляция секреции, ткани-мишени, механизм передачи сигнала, влияние на метаболизм в тканях-мишенях.
- •Мишени и эффекты
- •Ну или проще
- •80. Обмен железа: всасывание, транспорт, депонирование, регуляция, Роль железа в организме. Нарушения обмена железа в организме человека.
- •Существуют три способа перемещения железа из просвета кишечника в энтероциты:
- •Регуляция
- •Роль железа в организме:
- •Избыток железа
- •Железодефицит
- •Противосвертывающие системы крови: антитромбиновая и фибринолитическая.
- •Функции протеина s (ps):
- •Механизмы обезвреживания токсических веществ в печени: микросомальное окисление, реакции конъюгации
- •Nadph-зависимая монооксигеназная система
- •Nadh-зависимая монооксигеназная система
- •Распад гема, образование и обезвреживание билирубина. «Прямой» и
- •Биохимические изменения при нарушении обмена билирубина
- •Референтные величины концентрации общего билирубина в
- •Гемолитическая (надпеченочная) желтуха
- •Паренхиматозная (печёночная) желтуха.
- •Лабораторная диагностика
- •Механическая или обтурационная (подпеченочная) желтух.
- •Диагностическое значение определения билирубина и других желчных пигментов в крови и моче.
- •Эластин.
- •Свойства:
- •Возвращается в первоначальное состояние после снятия нагрузки.
- •Структурные и регуляторные белки мышц и их роль в мышечном сокращении
- •Функции субъединиц тропонина
- •Толстые нити образованы белком миозином
- •– Й этап.
- •На этой стадии атф не расщепляется, т.Е. Служит не источником энергии, а аллостерически изменяет конформацию миозиновой головки и тем самым ослабляет связь миозина с актином
- •Мышечное расслабление
- •Сокращение гладких мышц
- •Стадия – стадия начальных изменений
- •Стадия – стадия поздних изменений
- •Усилением:
- •Ослаблением:
Понятие о катаболизме и анаболизме. Принципы
метаболизма: унификация и конвергенция. Специфические и общий путь катаболизма углеводов, жиров и белков.
Анаболизм — это совокупность процессов биосинтеза органических веществ, компонентов клетки и других структур органов и тканей.
Катаболизм — это совокупность процессов расщепления сложных молекул, компонентов клеток, органов и тканей до простых веществ (с
использованием части из них в качестве предшественников биосинтеза) и до конечных продуктов метаболизма (с образованием макроэргических и восстановленных соединений).
Конвергенция – объединение различных путей превращения орг веществ в единый общий путь.
Унификация – постепенное снижение числа участников обменных процессов и использование в общем пути катаболизма единого метаболита - АсКоА

Особенности ферментативного катализа. Зависимость скорости ферментативных реакций от температуры, рН среды, количества фермента и
концентрации субстрата. Константа Михаэлиса.
Более высокая активность по сравнению с химическими катализаторами (увеличение скорости в 101 1013 раз).
Большинство ферментов отличаются специфичностью действия, так что
практически каждая реакция превращения исходного реагента (субстрата) в продукт осуществляется специальным ферментом.
Способность к изменению своей активности




(V реакции растет до момента полного заполнения активных центров/истощения количества субстрата)

3. Активный центр и механизм действия ферментов. Специфичность действия ферментов.

Различают 4 вида субстратной специфичности ферментов:
Абсолютная специфичность – способность фермента катализировать превращение только одного субстрата.
Относительная специфичность – фермент катализирует превращение нескольких субстратов, имеющих один тип связи.
Относительная групповая специфичность – фермент катализирует превращение нескольких субстратов, имеющих один тип связи, но требуется наличие определенных функциональных групп, входящих в состав субстратов.
Стереохимическая специфичность – фермент катализирует превращение только одного стереоизомера.



 Классификация
ферментов,
примеры
ферментативных
реакций
каждого
класса.
Классификация
ферментов,
примеры
ферментативных
реакций
каждого
класса.


Ингибирование ферментов: виды, характеристика, примеры.
Использование ингибиторов в качестве лекарственных препаратов.

1)Асперин ингиб простогландинсинтазу => сниж.синтез простогландинов => сниж.воспаление,температура,боль.
2)Пеницилин ингиб Е кат образование пентоглициновых мостиков дающих жесткость КС => в отсут.жесткости бактерия погиб
3)Аллопкринол конт.ингиб ксантиноксидазы => синтез молочной к-ты и проявл подагры.
Способы регуляции активности ферментов. Физиологическое значение,
примеры.
Доступность субстрата или кофермента
Компартментализация - это сосредоточение ферментов и их субстратов в одном компартменте (одной органелле)
Генетическая регуляция - (изменение количества фермента) может происходить в результате увеличения или снижения его синтеза.
Ограниченный (частичный) протеолиз проферментов

Аллостерическая регуляция


 Белок-белковое
взаимодействие
Белок-белковое
взаимодействиеКовалентная (химическая) модификация (например: фосфорилирование/дефосфорилирование)

Аллостерические ферменты. Аллостерическая регуляция активности ферментов. Примеры метаболических путей, регулируемых аллостерическими ферментами.

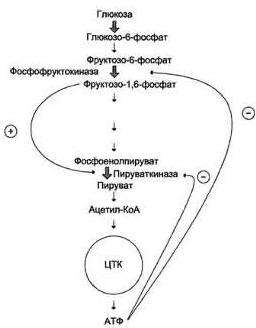 Аллостерическими
эффекторами могут выступать самые
различные вещества:
субстраты
и конечные продукты метаболических
путей, иногда – промежуточные
метаболиты
Аллостерическими
эффекторами могут выступать самые
различные вещества:
субстраты
и конечные продукты метаболических
путей, иногда – промежуточные
метаболиты

Пример:
Регуляция активности ферментов: фосфорилирование -
дефосфорилирование, роль протеинкиназ и
протеинфосфатаз в клетке. Примеры метаболических путей, регулируемых такими способами.

Киназы переносят фосфатную группу на субстрат, фосфатазы забирают.
Например: Глюкагон – фосфорилирование ферментов – распад жира, гликогена; Инсулин – дефосфорилирование ферментов – синтез гликогена.
Регуляция активности ферментов: частичный протеолиз, значение в переваривании белков и свертывании крови.

Также: Трипсин из трипсиногена, факторы свертывания крови…
Использование ферментов в медицине: энзимодиагностика и энзимотерапия
Энзимодиагностика заключается в постановке диагноза заболевания (или синдрома) на основе определения активности ферментов в биологических жидкостях человека.
Ферменты, катализирующие одну и ту же химическую реакцию, но с разной первичной структурой белка, называют изоферментами.
Например: лактатдегидрогеназа (ЛДГ)катализирует обратимую реакцию окисления лактата (молочной кислоты) до пирувата (пировиноградной кислоты)
Н4 (изоформа ЛДГ1); Н3М (изоформа ЛДГ2) – сердце, почки Н2М2 (изоформа ЛДГ3);
НМ3 (изоформа ЛДГ4);М4 (изоформа ЛДГ5) - в скелетных мышцах и печени
Креатинкиназа (КК)которая катализирует реакцию образования креатинфосфата. Изофермент ВВ находится преимущественно в головном мозге, ММ - в скелетных мышцах и МВ - в сердечной мышце.
АлАТ и АсАТ – печень и сердце.
