
хим синтез / 25_26_27
.docx25. механизм присоединения несемметричных реагентов (вода, НГаl) к олефинам. Правило Морковникова.
Олефины (от лат. oleum-масло) (алкены, этиленовые углеводороды., ненасыщенные ациклические углеводороды, содержащие одну двойную связь С=С; общая формула СnН2n.
Олефины-высокореакционноспособные соединения. Наиболее характерны для них реакции электрофильного присоединения по двойной связи, протекающие, как правило, по бимолекулярному механизму через стадию образования карбкатиона или мостикового иона:
На первой стадии электрофильная частица (чаще всего это бывает протон H+) взаимодействует с p-электронами двойной связи и образует p-комплекс, который затем превращается в карбокатион путем образования ковалентной s-связи между электрофильной частицей и одним из атомов углерода:
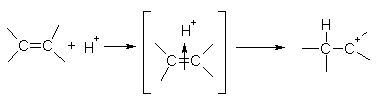
алкен p-комплекс карбокатион
На второй стадии карбокатион реагирует с анионом X-, образуя вторую s-связь за счет электронной пары аниона:
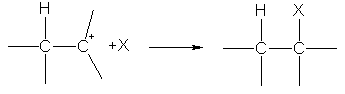
Присоединение электрофилов подчиняется Марковникову правилу: при присоединении протонных кислот или воды к несимметричным алкенам или алкинаматом водорода присоединяется к наиболее гидрогенизированному атому углерода, например:
![]()
Рассмотрим конкретные примеры реакций присоединения.
1) Гидрогалогенирование. При взаимодействии алкенов с галогеноводородами (HCl, НВr) образуются алкилгалогениды:
СН3-СН=СН2 + НВr ® СН3-СНВr-СН3.
Продукты реакции определяются правилом Марковникова.
Следует, однако, подчеркнуть, что в присутствии какого-либо органического пероксида полярные молекулы НХ реагируют с алкенами не по правилу Марковникова:
|
|
R-O-O-R |
|
|
СН3- СН=СН2 + НВr = |
→ |
СН3-СН2-СН2Вr |
Это связано с тем, что присутствие перекиси обусловливает радикальный, а не ионный механизм реакции.
2) Гидратация. При взаимодействии алкенов с водой в присутствии минеральных кислот (серной, фосфорной) образуются спирты. Минеральные кислоты выполняют роль катализаторов и являются источниками протонов. Присоединение воды также идет по правилу Марковникова:
СН3-СН=СН2 + НОН ® СН3-СН(ОН)-СН3.
26. механизм электрофильного присоединения к сопряженным диеновым системам (1,2- , 1,4 – присоединения). Образование сопряженных карбкатионов.

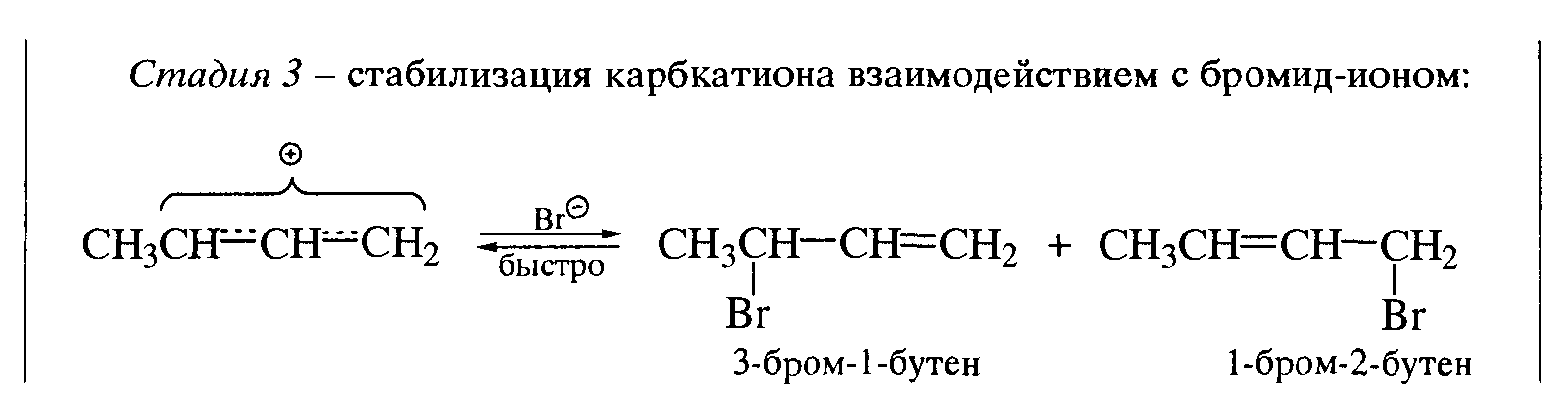

27. Нуклеофильное замещение атома галогена. Общая схема реакции:
R–X
+ :Y ![]() R–Y
+ :X –,
R–Y
+ :X –,
где X – галоген; :Y – нуклеофильный реагент – донор пары электронов (H2O:, HO:–, :NH3, :NH2R, :CN – и т.п.).
Замещение галогена происходит по одному из двух возможных механизмов. Рассмотрим эти механизмы на примере замещения галогена на гидроксильную группу (гидролиз галогеноуглеводородов) в изопропилхлориде (CH3)2CH–Cl под действием водного раствора щелочи:
(CH3)2CH–Cl
+ :OH – ![]() (CH3)2CH–OH
+ :Cl –
(CH3)2CH–OH
+ :Cl –
Механизм I (двухстадийный) Cтадия 1. Алкилгалогенид, отщепляя галоген (электролитическая диссоциация), превращается в карбокатион:
![]()
Cтадия 2. Карбокатион взаимодействует с нуклеофилом (донором пары электронов) с образованием конечного продукта:

Стадия 1 является лимитирующей. Поскольку в ней участвует только одна частица (молекула галогеналкана), реакция считается мономолекулярной. Данный механизм обозначается символом SN1 (мономолекулярное нуклеофильное замещение).
Механизм II (одностадийный)
Этот механизм нуклеофильного замещения заключается в практически одновременном отщеплении галогенид-иона и присоединении гидроксид-аниона (без образования карбокатиона) и идет в одну стадию:
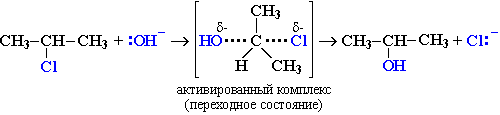
Этот механизм называют бимолекулярным нуклеофильным замещением и обозначают символом SN2.
Механизм замещения зависит от строения реагентов и условий реакции. Для первичных галогеналканов предпочтительней двухстадийный механизм, а для третичных - одностадийный. Вторичные алкилгалогениды занимают промежуточное положение: механизм реакции зависит от условий ее проведения и может быть смешанным.
Как объяснить влияние строения галогеналкана на механизм реакции?
На лимитирующей стадии в механизме I (SN1) происходит образование карбокатиона. Чем стабильнее этот катион, тем легче он образуется. Третичный катион R3C+ стабильнее, чем вторичный R2CН+ и, тем более, первичный RCН2+ (три +I-эффекта алкильных групп R в третичном катионе, два - во вторичном и один - в первичном).
С другой стороны, энергия переходного состояния в одностадийном механизме II (SN2) тем ниже, чем меньше пространственные препятствия для его достижения, т.е. чем меньше алкильных групп у атакуемого атома углерода.
