
Хімія_u_prog_med_med_full
.pdfФорма № Н - 3.04 Вінницький національний медичний університет імені М.І.Пирогова
Кафедра біологічної та загальної хімїі
“ЗАТВЕРДЖУЮ”
проректор з навчальної роботи проф. Гумінський Ю.Й “31”серпня 2012 року
РОБОЧА ПРОГРАМА НАВЧАЛЬНОЇ ДИСЦИПЛІНИ
Медична хімія
(шифр та назва навчальної дисципліни)
напрям підготовки 1101 медицина
(шифр та назва напряму підготовки)
спеціальність лікувальна справа 7.110101;
педіатрія 7.110104
Інститут, факультет, відділення |
ВНМУ імені М.І.Пирогова, |
|
медичний факультет №1,№2 |
|
кафедра біологічної та загальної хімїі |
2012 рік
1

Робоча програма із навчальної дисципліни «Медична хімія» для студентів
за напрямом підготовки медицина 1101,
спеціальністю 7.110101 лікувальна справа
7.110104 педіатрія
«29» серпня 2012р. – стр. 28
Розробники: доцент, к.х.н. Смірнова О.В.
Робоча програма затверджена на засіданні кафедри біологічної та загальної хімії
Протокол від “29”серпня 2012 року, № 1
Завідувач кафедри |
Заічко Н.В. |
||
|
|
(підпис) |
(прізвище та ініціали) |
«29» серпня |
2012року |
|
|
Схвалено методичною радою загальнотеоретичних дисциплін Вінницького національного медичного університету імені М.І.Пирогова
Протокол від. “30”серпня 2012 року, № 1
Голова ради |
|
доц. Король А.П. |
2
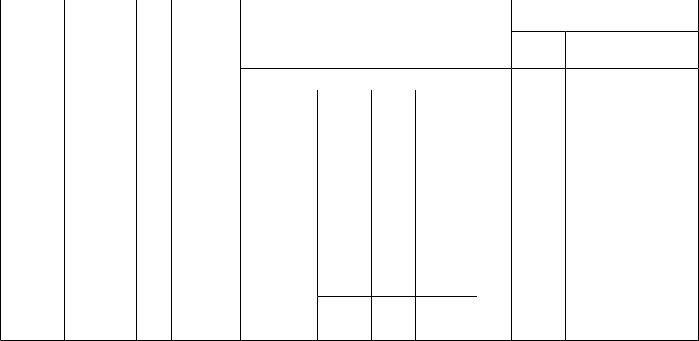
Опис навчального плану з дисципліни «Медична хімія» для студентів медичного факультету №1,2
спеціальність 7.110101 «Лікувальна справа», 7.110104 «Педіатрія»
Форма навчання |
Рік навчання |
Семестр |
Кредитів |
Модулів |
Диференційний залік |
Всього |
Денна 1 I,II 4 1 1 12 0
|
Кількість годин |
||
|
Аудиторних |
Диференц ійннй |
|
|
занятьПрактичих |
|
|
Лекції |
ПМК |
2 |
|
20 |
46 |
2 |
|
Види контролю
ПМК Диференційний. залік
СРС
50 I |
II сем. |
сем. |
|
Примітка:
1 кредит ECTS – 30 годин. Аудиторна робота – 74%, СРС – 26%. Співвідношення кількості годин аудиторних занять до СРС: 150/70 = 2,14/1
Робоча навчальна програма із медичної хімії складена на основі програми навчальної дисципліни «Медична хімія» для студентів вищих медичних закладів освіти ІІІ-ІV рівнів акредитації. Спеціальність: 7.110101 «Лікувальна справа», 7.110104 «Педіатрія», «Медико-профілактична справа», 7.110105, Київ, 2005, с. 27.
3
1. ПОЯСНЮВАЛЬНА ЗАПИСКА
Програма із медичної хімії для вищих медичних закладів освіти України IIIIV рівнів акредитаціі складена для спеціальностей 7.110101 «Лікувальна справа», 7.110104 «Педіатрія» напряму підготовки 1101 «Медицина» у відповідності із діючими нормативними документами:
-освітньо-кваліфікаційної характеристики (ОКХ) та освітньо-професійної програм (ОГП) підготовки фахівців, затверджених наказом МОН України №239 від 16.04.03 «Про затвердження складових галузевих стандартів вищої освіти з напряму підготовки 1101 «Медицина»;
-рекомендацій щодо розроблення навчальних програм навчальних дисциплін, затверджених наказом МОЗ України №152 від 24.03.2004 «Про затвердження рекомендацій щодо розроблення навчальних програм навчальних дисциплін» зі змінами та доповненнями внесеними наказом МОЗ України №492 від 12.10.2004 «Про внесення змін та доповнень до рекомендацій щодо розроблення навчальних програм навчальних дисциплін»;
-наказу МОЗ України №148 від 31.01.03 « Про заходи щодо реалізацій
положень Болонської декларації |
у системі вищої медичної та |
фармацевтичної освіти»; |
|
-експериментального навчального плану, розробленого на принципах Європейської кредитно-трансферної системи (ECTS) і затвердженого Наказом МОЗ України від 31.01.2005 №52.
-наказу МОЗ України №414 від 2007 «Про зміни до наказу МОЗ України №52 від 31.01.2005»
Згідно навчального плану підготовки фахівців за спеціальністю - Згідно навчального плану підготовки фахівців за спеціальністю «Лікувальна справа», «Педіатрія», за освітньо-кваліфікаційним рівнем «Спеціаліст» вивчення навчальної дисципліни «Медична хімія» здійснюється на 1 курсі (1,II семестр).
Медична хімія як навчальна дисципліна:
а) базується на вивченні студентами біоорганічної хімії, біофізики, медичної біології та інтегрується з цими дисциплінами;
б) закладає основи вивчення студентами фізіології, біологічної хімії, загальної та молекулярної фармакології та токсикології, гігієнічних дисциплін
Організація навчального процесу здійснюється за кредитно-модульною системою відповідно до вимог Болонського процесу.
4
Програма дисципліни «Медична хімія» структурована на один модуль, який поділяється на 2 змістових модулі, та диференційний залік по всьому курсу медичної хімії. Обсяг навчального навантаження описаний у кредитах ECTS, які зараховуються студентам при успішному засвоєнні ними відповідного модулю (залікового кредиту).
Модуль 1 «Кислотно-основні рівноваги та комплексоутворення в біологічних рідинах»
Змістовий модуль 1:
1 Хімія біогенних елементів. Комплексоутворення в біологічних
.рідинах.
Змістовий модуль 2:
2Кислотно-основні рівноваги в біологічних рідинах.
.
Видами навчальної діяльності згідно з навчальним планом є:
а) лекції б) практичні заняття
в) самостійна робота студентів (СРС)
г) індивідуальна самостійна робота студентв.
Теми лекційного курсу розкривають проблемні питання відповідних розділів медичної хімії.
Практичні заняття за методикою їх організації є лабораторними і передбачають:
∙лабораторні дослідження фізико-хімічних властивостей речовин, виявлення певних класів сполук за властивостями їх функціональних груп;
∙визначення присутності речовин в біологічних рідинах за допомогою якісних реакцій;
∙написання хімічних реакцій, ланцюгів перетворень хімічних речовин;
∙вирішення задач, що мають експериментальне або медичне спрямування.
Завоєння тем контролюється (поточний контроль) на практичних заняттях у відповідності з конкретними цілями за допомогою наступних засобів діагностики рівня підготовки студентів:
∙комп’ютерне тестування;
∙тестування на паперовому носії;
∙опитування за темою заняття;
∙вирішення розрахункових задач;
∙проведення лабораторних досліджень і трактування їх результатів;
∙контроль практичних навичок.
5
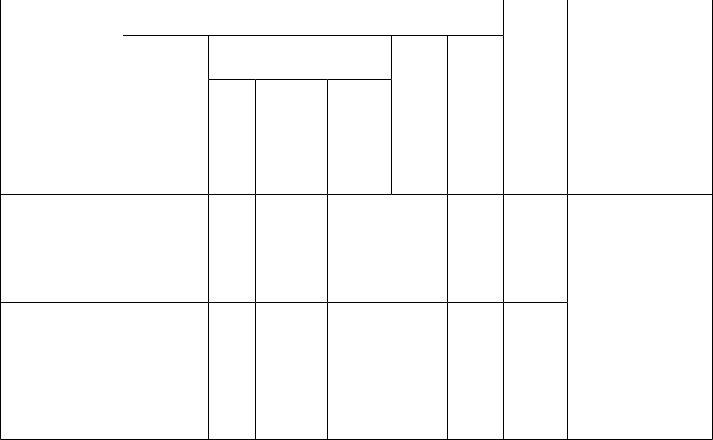
Структурований план підготовки із дисципліни «Медична хімія» для студентів медичногочного факультету
Спеціальність 7.110101 лікувальна справа 7.110104 педіатрія
Структура |
|
Кількість годин, з них |
|
|
|
|
|
|||
навчальної |
Всього |
|
Аудиторних |
|
|
Рік |
Вид |
|
||
дисципліни |
|
|
|
навча |
контролю |
|
||||
годин / |
|
|
|
СРС |
Диф. |
|
||||
|
|
|
|
ння, |
|
|
|
|||
|
кредитів |
Лек |
Прак. |
ПМК |
|
залік |
семес |
|
|
|
|
ECTS |
-цій |
занять |
|
|
тр |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Медична |
120/4 |
20 |
46 |
2 |
50 |
2 |
|
|
|
|
хімія |
|
|
|
|
|
|
|
|
|
|
Модуль 1: |
|
|
|
|
|
|
|
Поточний |
та |
|
Змістових |
60/2 |
6 |
24 |
2 |
28 |
|
1 рік , |
підсумковий |
|
|
модулів - 2 |
|
(стандартизован |
||||||||
(теми №1-14) |
|
|
|
|
|
|
І сем. |
ий |
контроль |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
(диференційний |
||
Модуль 2 |
|
|
|
|
|
|
|
залік): |
|
|
Змістових |
|
|
|
|
|
|
1 рік , |
комп’ютерне |
|
|
модулів 2 |
60/2 |
14 |
22 |
|
22 |
2 |
тестування, |
|
||
(теми |
|
І-II |
письмова |
|
||||||
|
|
|
|
|
|
сем. |
|
|||
№15-25) |
|
|
|
|
|
|
робота |
|
|
|
|
|
|
|
|
|
|
|
|
||
Примітка:
1 кредит ECTS – 30 годин. Аудиторне навантаження – 74%, СРС – 26%. Співвідношення кількості годин аудиторних занять до СРС: 150/70 = 2,14/1
2. МЕТА ВИВЧЕННЯ НАВЧАЛЬНОЇ ДИСЦИПЛІНИ
«МЕДИЧНА ХІМІЯ»
Мета вивчення медичної хімії – кінцеві цілі встановлюються на основі ОПП підготовки лікаря за фахом.
Кінцеві цілі вивчення дисципліни “Медична хімія” полягають у тому, що студент в своїй майбутній професійній діяльності повинен
вміти:
∙6120 інтерпретувати основні типи хімічної рівноваги для формування цілісного фізико-хімфчного підходу до вивчення процесів життєдіяльності організму;
∙20093 застосовувати хімічні методи кількісного та якісного аналізу;
∙6119 класифікувати хімічні властивості та перетворення біонеорганічних речовин в процесі життєдіяльності організму
∙20094 трактувати загальні фізико-хімічні закономірності, що лежать в основі процесів життєдіяльності людини
6
3. ЗМІСТ ПРОГРАМИ
Модуль 1. КИСЛОТНО-ОСНОВНІ РІВНОВАГИ ТА КОМПЛЕКСОУТВОРЕННЯ В БІОЛОГІЧНИХ РІДИНАХ
Змістовий модуль 1. Хімія біогенних елементів. Комплексоутворення в біологічних рідинах
Конкретні цілі:
1. Трактувати взаємозв`язок між біологічною роллю біогенних s-,р-, d -елементів та формою знаходження їх в організмі.
2. Пояснювати принципи будови комплексних сполук. 3.Інтерпретувати особливості будови комплексних сполук як основи їх
застосування в хелатотерапії.
Тема 1. Біогенні s- та p-елементи; біологічна роль, застосування в медицині
Загальні відомості про біогенні елементи. Якісний та кількісний вміст біогенних елементів в організмі людини. Макроелементи, мікроелементи та домішкові елементи. Органогени. Поняття про вчення В.І. Вернадського про біосферу та роль живої речовини (живих організмів). Зв’язок між вмістом біогенних елементів в організмі людини та їх вмістом в довкіллі. Ендемічні захворювання, їх зв’язок з особливостями біогеохімічних провінцій (районів з природним дефіцитом або надлишком певних хімічних елементів в літосфері). Проблеми забруднення та очищення біосфери від токсичних хімічних сполук техногенного походження.
Електронна структура та електронегативність s– і p– елементів. Типові хімічні властивості s– та p– елементів та їх сполук (реакції без зміни ступеня окиснення). Зв’язок між місцезнаходженням s– та p– елементів в періодичній системі та їх вмістом в організмі. Застосування в медицині. Токсична дія сполук.
Якісні реакції на іони CO32-, SO42-, NO2-, S2O32-
Тема 2. Біогенні d-елементи,біологічна роль, застосування в медицині
Метали життя. Електронна структура та електронегативність d- елементів.Типові хімічні властивості d–елементів та їх сполук (реакції зі зміною ступеня окиснення, комплексоутворення). Біологічна роль. Застосування в медицині. Токсична дія d-елементів та їх сполук
Якісні реакції на іони MnO4-, Fe3+, Cu2+, Ag+.
Тема 3 Комплексоутворення в біологічних системах
Реакції комплексоутворення. Координаційна теорія А. Вернера та сучасні уявлення про будову комплексних сполук. Поняття про комплексоутворювач (центральний іон). Природа, координаційне число, гібридизація орбіталей комплексоутворювача. Поняття про ліганди. Координаційна ємність ( дентатність ) лігандів. Внутрішня та зовнішня сфери комплексів. Геометрія
7
комплексного іону. Природа хімічного зв’язку в комплексних сполуках. Класифікація комплексних сполук за зарядом внутрішньої сфери та за природою лігандів. Внутрішньокомплексні сполуки. Поліядерні комплекси.
Залізо-, кобальто-, мідєта цинковмісні біокомплексні сполуки. Поняття про металолігандний гомеостаз. Порушення гомеостазу. Комплексони та їх застосування в медицині як антидотів при отруєнні важкими металами (хелатотерапія) та як антиоксидантів при зберіганні лікарських препаратів.
Змістовий модуль 2. Кислотно-основні рівноваги в біологічних рідинах
Конкретні цілі:
1.Вміти характеризувати кількісний склад розчинів.
2.Вміти готувати розчини із заданим кількісним складом.
3.Аналізувати кількісний вміст в розчині кислот та основ за домогою метдів кист лоно-основного титрування.
4.Робити висновки щодо кислотності біологічних рідин на підставі водневого показника
5.Пояснювати механізм дії буферних систем та їх роль в підтримці кислотно-основної рівноваги в біосистемах.
6.Аналізувати взаємозв`язок між колігативними властивостями концентрацією розчинів.
Тема 4 Величини, що характеризують кількісний склад розчинів. Приготування розчинів
Роль розчинів в життєдіяльності організмів. Класифікація розчинів. Механізм процесів розчинення. Термодинамічний підхід до процесу розчинення. Розчинність речовин.
Розчинність газів у рідинах. Залежність розчинності газів від тиску (закон Генрі-Дальтона), природи газу та розчинника, температури. Вплив електролітів на розчинність газів (закон Сєченова). Розчинність газів у крові. Кесонна хвороба.
Розчинність рідин та твердих речовин в рідинах. Залежність розчинності від температури, природи розчиненої речовини та розчинника. Розподіл речовини між двома рідинами, що не змішуються. Закон розподілу Нернста та його значення у явищі проникності біологічних мембран.
Величини, що характеризують кількісний склад розчинів. Приготування розчинів із заданим кількісним складом.
Тема 5. Основи титриметричного аналізу
Основи титриметричного аналізу. Методи титриметричного аналізу. Метод кислотно-основного титрування. Кислотно-основні індикатори.
Тема 6. Кислотно-основна рівновага в організмі. Водневий показник біологічних рідин
Розчини електролітів. Електроліти в організмі людини. Ступінь та константа дисоціації слабких електролітів. Властивості розчинів сильних електролітів.
8

Активність та коефіцієнт активності. Іонна сила розчину. Водно-електролітний баланс - необхідна умова гомеостазу.
Дисоціація води. Іонний добуток води. Водневий показник рН. Значення рН для різних рідин людського організму в нормі та патології.
Теорії кислот та основ. Типи протолітичних реакцій: реакції нейтралізації, гідролізу та іонізації. Гідроліз солей. Ступінь гідролізу, залежність його від концентрації та температури. Константа гідролізу. Роль гідролізу в біохімічних процесах.
Тема 7. Буферні системи, класифікація та механізм дії
Буферні розчини, їх класифікація. Рівняння Гендерсона-Гассельбаха. Механізм буферної дії.
Тема 8. Визначення буферної ємності. Роль буферів в біосистемах
Буферна ємність. Буферні системи крові. Бікарбонатний буфер, фосфатний буфер. Білкові буферні системи. Поняття про кислотно-основний стан крові.
Тема 9. Колігативні властивості розчинів
Колігативні властивості розведених розчинів неелектролітів. Відносне зниження тиску насиченої пари розчинника над розчином. Закон Рауля. Ідеальні розчини. Зниження температури замерзання та підвищення температури кипіння розчинів у порівнянні з розчинниками. Осмос та осмотичний тиск. Закон ВантГоффа. Колігативні властивості розведених розчинів електролітів. Ізотонічний коефіцієнт. Гіпо-, гіперта ізотонічні розчини.
Кріометрія, ебуліометрія, осмометрія, їх застосування в медико-біологічних дослідженнях. Роль осмосу в біологічних системах. Осмотичний тиск плазми крові. Рівняння Галлера. Онкотичний тиск. Плазмоліз та гемоліз.
|
Тематичний план лекцій із модуля 1 |
||
№ |
|
|
|
п/ |
Тема |
лекції |
Години |
п |
|
|
|
1 |
Комплексоутворення в |
біологічних |
системах. |
|
Основи хелатотерапії. |
|
2 |
2Кислотно – основні рівноваги в біосистемах
2
3Колігативні властивості біологічних рідин
|
2 |
Разом: |
6 |
9

Тематичний план практичних занять модуля 1
№ |
|
|
|
|
|
|
|
|
|
п/п |
|
|
|
Тема заняття |
|
|
Години |
||
модуль1. |
|
1 |
Вступ.Техніка безпеки. |
Періодична |
система |
Д.І. |
|
||
1 |
|
Менделєєва. Електронна будова атомів елементів та їх |
2 |
||||||
|
|
||||||||
|
|
|
іонів. Тестовий контроль для визначення початкового |
|
|||||
Змістовий |
|
|
рівня знань |
|
|
|
|
|
|
|
2 |
Біогенні s-елементи, хімічні властивості, біологічна |
2 |
||||||
|
|
||||||||
|
2 |
|
роль, застосування в медицині |
|
|
|
|||
|
|
3 |
Біогенні р-елементи, хімічні властивості, біологічна |
2 |
|||||
|
3 |
|
роль, застосування в медицині |
|
|
|
|||
|
|
4 |
Біогенні d-елементи, хімічні властивості, біологічна |
2 |
|||||
|
4 |
|
роль, застосування в медицині |
|
|
|
|||
|
5 |
5 |
Комплексоутворення в біологічних системах. |
|
2 |
||||
модуль2 |
6 |
Способи |
вираження |
|
концентрації |
розчинів. |
2 |
||
|
|
||||||||
6 |
|
Приготування розчинів. |
|
|
|
|
|
||
7 |
7 |
Основи титриметричного аналізу. Метод нейтралізації. |
2 |
||||||
Змістовий |
9 |
Алкаліметрія. |
|
|
|
|
2 |
||
|
Кислотно-основна рівновага в організмі. Водневий |
||||||||
|
8 |
8 |
Метод нейтралізації Ацидіметрія |
|
|
2 |
|||
|
|
|
|
|
|
|
|
|
|
|
9 |
|
показник біологічних рідин |
|
|
|
|
||
|
|
1 |
Буферні системи, класифікація та механізм дії. |
|
2 |
||||
|
10 |
|
|
|
|
|
|
|
|
|
|
1 |
Буферна емкість. Роль буферних розчинів в |
2 |
|||||
|
11 |
біосистемах. |
|
|
|
|
|
||
|
|
1 |
Колігативні властивості розчинів. Осмос |
|
|
2 |
|||
|
12 |
Разом: |
|
|
|
|
|
24 |
|
|
|
|
|
|
|
|
|
||
|
|
1 |
Підсумковий контроль засвоєння модулю1 (кислотно- |
2 |
|||||
|
13 |
основні |
рівноваги |
та |
комплексоутворення |
в |
|
||
|
|
|
біологічних рідинах) |
|
|
|
|
|
|
|
|
|
Разом: |
|
|
|
|
|
2 |
10
