
lek04 / Лекция 4 Репликация ДНК синтез белка
.doc
Конспект лекции №4
Тема. Молекулярные основы воспроизводства клетки.
Одно из крупнейших открытий не только XX века, но и всей истории науки связывают с именами Джеймса Уотсона и Френсиса Крика. В 1953 году они предложили гипотезу о макромолекулярной структуре ДНК. В основе их гипотезы лежит предположение о том, что двойная спираль ДНК удерживается с помощью комплементарного спаривания азотистых оснований нуклеотидов водородными связями. Этот принцип является универсальным механизмом обеспечения фундаментальных свойств всех живых организмов. По принципу комплементарности на молекулярном уровне происходит деление (размножение) клеток и биосинтез белка - основа функционирования клетки.
Репликация (удвоение, редупликация) ДНК требует 5 главных условий. Отсутствие любого из них делает воспроизводство живой клетки невозможным.
1. Наличие исходной матрицы – всей "старой" молекулы ДНК. Она определяет точную последовательность нуклеотидов. Без нее "новая" молекула будет бессмысленной. В цепочке ДНК тройка последовательных нуклеотидов (триплет) кодирует 1 аминокислоту или сигнал о прекращении синтеза (см. таблицу 1).
2. Наличие строительного материала. Строительным сырьем для ДНК являются отдельные дезоксирибонуклеотиды с азотистыми основаниями ДНК (аденин, гуанин, цитозин, тимин). В процессе их подготовки к синтезу нуклеотиды взаимодействуют с АТФ и превращаются в нуклеозидтрифосфаты (аденинтрифосфат, гуанинтрифосфат, цитозинтрифосфат и тиминтрифосфат), которые обладают собственной энергией для соединения в цепочки.
3. Наличие энергии. Энергия АТФ для синтеза новых цепочек ДНК опосредуется нуклеозидтрифосфатами (см. выше).
4. Наличие катализаторов реакций синтеза ферментов (ДНК-полимеразы, ДНК-лигазы и др.).
5. Наличие места для синтеза. Местом репликации ДНК является ядро эукариотической клетки или цитоплазма (прокариоты).
Отсутствие любого из данных условий делает процесс синтеза невозможным.
Последовательность событий при репликации ДНК.
Расхождение нитей двойной спирали. При этом, разрываются водородные связи между комплементарно спаренными азотистыми основаниями старых параллельных цепочек ДНК. Образуется сразу несколько репликационных точек.
Свободные дезоксирибонуклеотиды комплементарно спариваются с освободившимися на старых материнских цепочках нуклеотидами и соединяются в новые цепочки прочными ковалентными связями.
Этот процесс обеспечивают сложные ферментные комплексы в состав которых входит ДНК-полимераза, ДНК-лигаза и др.
Таблица 1. Универсальный генетический код. Последовательности азотистых оснований в триплетах и кодируемые ими аминокислоты для и-РНК. Свойства генетического кода.
в т о р о е о с н о в а н и е всего 64 трип-
┌────────┬────────┬────────┬────────┐ лета генети-
│ У │ Ц │ А │ Г │ ческого кода
┌─┼────────┼────────┼────────┼────────┼─┐
│У│УУУ Фен │УЦУ Сер │УАУ Тир │УГУ Цис │У│ 61 триплет ко-
п│ │УУЦ Фен │УЦЦ Сер │УАЦ Тир │УГЦ Цис │Ц│т дирует все 20
е│ │УУА Лей │УЦА Сер │УАА стоп│УГА стоп│А│р аминокислот,
р│ │УУГ Лей │УЦГ Сер │УАГ стоп│УГГ Трп │Г│е если 1 амино-
в├─┼────────┼────────┼────────┼────────┼─┤т кислоту коди-
о│Ц│ЦУУ Лей │ЦЦУ Про │ЦАУ Гис │ЦГУ Арг │У│ь рует не 1 три-
е│ │ЦУЦ Лей │ЦЦЦ Про │ЦАЦ Гис │ЦГЦ Арг │Ц│е плет, а более,
│ │ЦУА Лей │ЦЦА Про │ЦАА Глн │ЦГА Арг │А│ то такой код
о│ │ЦУГ Лей │ЦЦГ Про │ЦАГ Глн │ЦГГ Арг │Г│о называют вы-
с├─┼────────┼────────┼────────┼────────┤─┤с рожденным
н│А│АУУ Иле │АЦУ Тре │ААУ Асн │АГУ Сер │У│н
о│ │АУЦ Иле │АЦЦ Тре │ААЦ Асн │АГЦ Сер │Ц│о 1 триплет мо-
в│ │АУА Иле │АЦА Тре │ААА Лиз │АГА Арг │А│в жет кодировать
а│ │АУГ Мет │АЦГ Тре │ААГ Лиз │АГГ Арг │Г│а только 1 ами-
н├─┼────────┼────────┼────────┼────────┼─┤н нокислоту
и│Г│ГУУ Вал │ГЦУ Ала │ГАУ Асп │ГГУ Гли │У│и
е│ │ГУЦ Вал │ГЦЦ Ала │ГАЦ Асп │ГГЦ Гли │Ц│е 3 триплета ко-
│ │ГУА Вал │ГЦА Ала │ГАА Глу │ГГА Гли │А│ дируют оконча-
│ │ГУГ Вал │ГЦГ Ала │ГАГ Глу │ГГГ Гли │Г│ ние синтеза -
└─┴────────┴────────┴────────┴────────┴─┘ - это термини-
рующие кодоны
Сокращения:
стоп - кодон окончания синтеза
1. Ала - L-Аланин 11. Тре - L-Треонин У-урацил
2. Вал - L-Валин 12. Цис - L-Цистеин Ц-цитозин
3. Лей - L-Лейцин 13. Тир - L-Тирозин А-аденин
4. Иле - L-Изолейцин 14. Асн - L-Аспаргин Г-гуанин
5. Мет - L-Метионин 15. Глн - L-Глутамин
6. Про - L-Пролин 16. Асп - L-Аспаргиновая кислота
7. Фен - L-Фенилаланин 17. Глу - L-Глутаминовая кислота
8. Трп - L-Триптофан 18. Лиз - L-Лизин
9. Гли - L-Глицин 19. Арг - L-Аргинин
10. Сер - L-Серин . 20. Гис - L-Гистидин
Способ удвоения ДНК, описанный Уотсоном и Криком, известен под названием полуконсервативной репликации. Каждая дочерняя двойная спираль имеет 1 старую (консервативную) цепь материнской молекулы и 1 новую цепь. Полуконсервативный характер репликации ДНК доказан в опытах Меселсона и Сталя в серии изящных экспериментов в 1958 году.
Кишечные палочки выращивали на питательной среде с тяжелым изотопом азота N15 в течение многих поколений. Затем микробные клетки с тяжелой ДНК переносили на питательную среду с обычным азотом N14. Через 50 минут (время, соответствующее появлению нового поколения кишечных палочек при 36 С) брали пробы клеток и центрифугировали 20 часов при 40000 g в растворе (CsCl) с градиентом плотности (чем глубже, тем выше плотность раствора). ДНК кишечных палочек погружались на такую глубину, которая соответствовала их плотности, т.е., чем тяжелее была молекула, тем глубже она погружалась. Когда центрифужную пробирку исследовали в ультрафиолетовых лучах, слой ДНК имел вид узкой полосы.
Сравнили глубину этих полос при исследовании тяжелой материнской культуры (N15), легкой обычной культуры (N14) и пересаженной с тяжелого азота на обычный (N15+N14).
Если бы репликация ДНК имела полуконсервативный характер, то пересаженная культура давала бы полоску полутяжелой ДНК глубже легкой и выше тяжелой (рис. 1). Так и случилось. Исследования ДНК следующих поколений кишечной палочки дали еще более убедительное доказательство полуконсервативного характера репликации ДНК и справедливость гипотезы Уотсона и Крика.
Рисунок 1. Результаты экспериментов Меселсона и Сталя по изучению репликации ДНК
N15 N14 N(14=15)
│ │ │ │ │ │
├─────┤ ├─────┤ ├─────┤ плотность низкая
│ │ │ │ │ │
│ │ │ │ │ │
│ │ │ │ │ │
│ │ │ │ │ │ плотность средняя
│ │ ╞═════╡ │ │
│─ ─ ─│─ ─ │─ ─ ─│─ ─ ╞═════╡
╞═════╡ │ │ │ │
│ │ │ │ │ │ плотность высокая
└─────┘ └─────┘ └─────┘
обе обе полу-
цепи цепи тяжелая
тяжелые легкие ДНК
Биосинтез белка.
Принцип комплементарного спаривания азотистых оснований нуклеотидов лежит в основе реализации генетической информации в процессе биосинтеза белка.
Главные условия для биосинтеза белка похожи на условия репликации ДНК.
1. Наличие исходной матрицы – участка молекулы ДНК- гена. Ген имеет строго определенную последовательность нуклеотидов, а значит определяет точную последовательность аминокислот в полипептидной цепочке собираемого белка.
2. Наличие строительного материала. Строительным сырьем для РНК являются отдельные рибонуклеотиды с азотистыми основаниями: аденин, гуанин, цитозин, урацил.
3. Наличие энергии АТФ.
4. Наличие ферментов (например, РНК-полимеразы).
5. Наличие места для синтеза. Местом первого этапа биосинтеза белка является ядро эукариотической клетки или цитоплазма (прокариоты), а второй этап протекает на рибосомах гранулярной эндоплазматической сети.
Последовательность событий при биосинтезе белка.
Условно выделяют главных 2 этапа этого процесса, но между ними происходит процессинг - "созревание" и-РНК.
1. Транскрипция. Дословно "транскрипция" переводится, как "переписывание". На первом этапе происходит синтез и-РНК из свободных рибонуклетидов. Лучше называть первый этап синтезом и-РНК.
- Расхождение нитей двойной спирали ДНК, как испорченной застежки - молнии ("старые" водородные связи между комплементарно спаренными азотистыми основаниями параллельных цепочек Формируется «репликационный глазок» - ДНК разрываются не с конца молекулы а с любого участка, при этом, впереди и позади разрыва по цепочке ДНК эти водородные связи сохраняются).
- Свободные рибонуклеотиды комплементарно спариваются с освободившимися на ДНК азотистыми основаниями нуклеотидов "новыми" водородными связями.
- Фермент РНК-полимераза сшивает рибонуклеотиды ("наживленные" водородными связями) в цепочку и-РНК прочными ковалентными связями.
- Новая и-РНК отходит от участка ДНК (цепочки ДНК восстанавливают "старые" водородные связи).
В результате процессинга из и-РНК вырезаются "технологические" участки нуклеотидов, не содержащие информацию о строении синтезируемого белка (интроны). Далее происходит сшивание (сплайсинг), оставшихся после вырезания участков и-РНК, содержащих информацию о синтезируемом белке (экзонов) и формирование зрелой м-РНК.
2. Трансляция. Трансляция - процесс сборки молекул белка из аминокислот. Это перевод информации с "языка" нуклеиновых кислот на "язык" белков.
- К рибосомам с помощью т-РНК транспортируются аминокислоты, фиксированные на "черешке клеверного листа" т-РНК.
- Антикодоны т-РНК комплементарно взаимодействуют с триплетными кодонами и-РНК и образуют водородные связи.
- В начале процесса трансляции с рибосомальным активным центром связывается инициирующая и-РНК. У эукариот инициирующий кодон всех и-РНК всегда кодирует аминокислоту метионин (стартовый кодон АУГ).
- Две соседние молекулы т-РНК, связавшиеся на рибосоме с и-РНК, создают условия для образования пептидной связи между аминокислотами, фиксированными на их "черешках".
- После образования пептидной связи первая т-РНК, "отпускает" свою аминокислоту, а сама разрывает водородные связи и уходит с рибосомы в цитоплазму на "охоту" за новой аминокислотой. Вторая т-РНК (с двумя аминокислотами), спаренная с и-РНК, смещается на место первой в рибосоме.
- Следующая т-РНК с третьей аминокислотой образует комплементарные водородные связи с третьим кодоном и-РНК, создавая условия для пептидной связи между второй и третьей аминокислотой, процесс повторяется и полипептидная цепочка растет.
- Рост полипептидной цепочки продолжается до терминирующего стоп-кодона и-РНК, после которого новый белок покидает рибосому.
- Молекула и-РНК связывается сразу с несколькими рибосомами, формируя полирибосому. Это позволяет синтезировать одновременно несколько одинаковых молекул белка.
После трансляции первичные структуры новых молекул белка связываются с особыми ферментативными комплексами - шаперонами или фолдазами. В них происходит преобразование пространственного (трехмерного) строения новых белков. Этот процесс окончательного формирования рабочих структур называется фолдинг.
Т. о., с помощью генетического кода ДНК можно записать любую последовательность аминокислот и синтезировать любой белок.
ДНК хранит информацию и о молекулах небелковой природы (нуклеотиды, фосфолипиды, углеводы, пигменты и т.д.). Чтобы инициировать любую биохимическую реакцию надо обеспечить ее ферментативным аппаратом. Чтобы получить небелковое соединение (например, пигмент), надо сделать белок-фермент-катализатор для его синтеза. И в этом случае ключевым молекулярным механизмом является принцип комплементарного спаривания азотистых оснований нуклеотидов.
Блок дополнительной информации.
Экспрессия генов.
Как известно, в ДНК содержится определенная генетическая информация:
- о структуре всех белков и РНК организма,
- о порядке реализации этой информации в разных клетках в процессе онтогенеза (индивидуального развития) и при различных функциональных состояниях.
Поскольку во всех соматических клетках организма один и тот же набор из 46 хромосом, то, несмотря на подчас сильные отличия между клетками, все они содержат в своих ДНК одну и ту же генетическую информацию. (Некоторое исключение составляют лимфоциты, в процессе формирования которых происходит перестройка генов иммуноглобулинов - антител.)
Данное обстоятельство - генетическая эквивалентность ядер всех соматических клеток организма послужило основанием для клонирования животных. В процессе репликации ДНК генетическая информация воспроизводится целиком, чтобы затем передаваться дочерним клеткам.
Но, кроме того, эта информация экспрессируется (реализуется) в клетке, обуславливая все проявления ее жизнедеятельности. Однако экспрессии подвергается отнюдь не вся имеющаяся в ядре генетическая информация, а лишь какая-то (обычно весьма небольшая) ее часть.
Этим-то и обусловлены особенности тех или иных клеток тем, каков спектр (набор) функционирующих генов и каковы при этом уровни их активности.
Экспрессия информации о структуре определенного белка включает 2 основных этапа (рис. 1).
Рисунок 1. Основные этапы экспрессии генов
П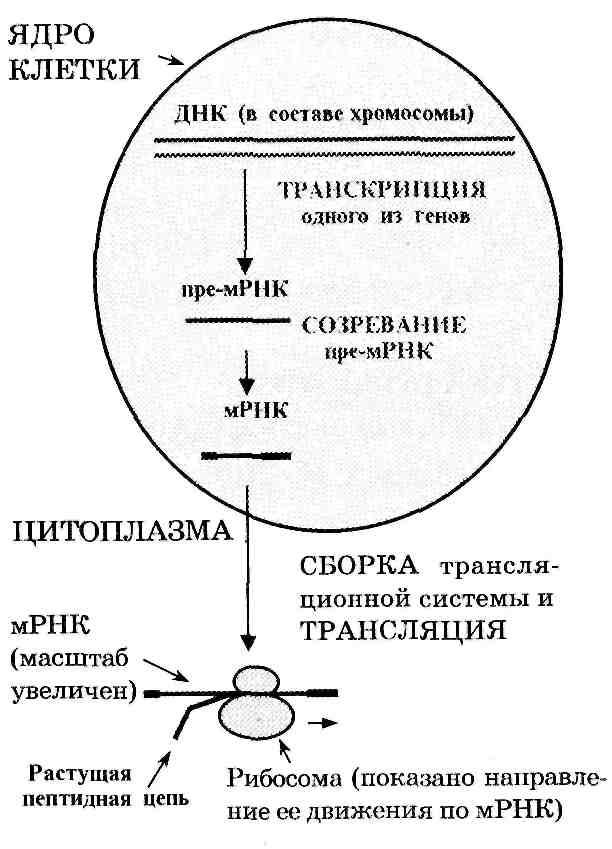 ервый
этап — транскрипция:
образование в клеточном ядре на
соответствующем гене (локализующемся
в одной из хромосом) специального
посредника — матричной РНК (м-РНК).
ервый
этап — транскрипция:
образование в клеточном ядре на
соответствующем гене (локализующемся
в одной из хромосом) специального
посредника — матричной РНК (м-РНК).
Смысл этого процесса — переписывание информации о структуре белка с огромного неподвижного носителя (ДНК в составе хромосомы) на небольшой подвижный носитель - м-РНК. Примерно так же обстоит дело, когда с жесткого диска компьютера, содержащего тысячи файлов, переписывают один из них на дискету. С той лишь разницей, что м-РНК в процессе записи информации образуется из новых нуклеотидов. Следовательно, м-РНК, считанные с разных генов, должны отличаться друг от друга — как отличаются друг от друга сами гены. Другое важное обстоятельство: непосредственный продукт транскрипции гена правильней называть предшественником м-РНК (пре-м-РНК). Дело в том, что новообразованная м-РНК подвергается, тут же (в ядре) созреванию, или процессингу. При этом она претерпевает существенную модификацию.
И лишь после того зрелая м-РНК (видимо, в комплексе со специальными белками) поступает из ядра в цитоплазму.
Второй этап — трансляция: синтез белка на рибосомах по программе, диктуемой м-РНК. Суть этой программы - определение очередности, в которой аминокислоты должны включаться в строящуюся пептидную цепь. Причем в процессе участвуют не свободные, а активированные аминокислоты: каждая из них связана с т. н. транспортной РНК (т-РНК), т. е. находится в виде аминоацил-т РНК (аа-т РНК). Для каждой из 20 аминокислот имеется своя специфическая форма т-РНК, а чаще — даже не одна, а несколько форм.
Рибосомы же играют в трансляции роль молекулярных машин, обеспечивающих правильное взаимодействие участников. В состав рибосомы входят четыре молекулы т. н. рибосомной РНК (р-РНК) — по одной молекуле каждого из 4-х видов р-РНК. Объединяясь с рибосомными белками, они образуют две субъединицы рибосомы и выполняют в них структурную, а также, возможно, каталитическую функции.
Таким образом, в трансляции участвуют РНК трех классов — м-РНК, т-РНК и р-РНК.
После окончания трансляции новый белок обычно не работает. Он должен приобрести рабочую (третичную или четвертичную) структуру. Этот процесс называется фолдинг (рис. 2).
Рисунок 2. Схема фолдинга.

Таким образом, как видим, фолдинг - очень важный этап в образовании работоспособных белков.
Вместе с тем оказалось, что добавление в среду некоторых белковых фракций клетки значительно облегчает рефолдинг (восстановление активности) денатурированных белков. Отсюда и возникло представление о вспомогательных белках (или факторах) фолдинга.
Затем было обнаружено, что данные факторы можно разделить на две группы.
Первая группа - это белки с каталитической активностью, т.е. ферменты фолдинга, или фолдазы. Пока обнаружено только два таких белка.
Как и прочие ферменты, они требуются лишь в каталитических количествах, т. е. в концентрациях, на порядки меньших, чем у «обслуживаемых» ими белков.
Вторая группа - т. н. молекулярные шапероны. Полагают, что сюда входят белки с самыми разными механизмами действия. Например, шапероны могут обеспечить белку удобное место для безопасного сворачивания в третичную структуру - котел с крышкой.
Объединяют же их следующие два обстоятельства:
- они требуются в количествах, близких к стехиометрическим, т. е. сравнимых по величине с концентрацией сворачиваемых белков;
- они, как и фолдазы, не входят в состав конечных продуктов фолдинга, какими бы сложными олигомерными образованиями эти продукты ни были.
Показательно в связи с этим исходное значение слова «шаперон» в английском языке: это пожилая дама, сопровождающая молодую девушку на балах.
Аналогично и молекулярные шапероны: способствуя правильному фолдингу, они как бы впервые выводят «в свет» новосинтезированные белки.
Из предыдущего изложения можно представить, что фолдинг - особенно с участием фолдаз и шаперонов - всегда приводит полипептидную цепь к «правильной», наиболее оптимальной в энергетическом и функциональном отношениях, структуре.
К сожалению, это не так. Существует группа тяжелых неврологических болезней, которые обусловлены закономерно повторяющимся «неправильным» фолдингом одного, вполне определенного белка.
Данный белок, если он находится в нормальной конформации, называется прионовым белком. Обнаруживается он в мозгу; функция его неизвестна.
При ряде же заболеваний тот же полипептид оказывается в другой конформации. В последней преобладают участки с бета-структурой, почти отсутствующие в нормальной нативной форме, а молекулы белка имеют повышенную склонность к агрегации. Такой белок называется прионом (от proteinaceous infection particle - белковая инфекционная частица). В данной форме он, видимо, не способен к выполнению своей обычной функции.
Но самое худшее заключается в том, что «неправильная» форма белка вызывает переход в такую же форму и «правильных» форм. Как это происходит, неясно. Возможно, имеет место захват «правильных» молекул агрегатами приона, в результате чего эти молекулы разворачиваются и организуются заново, но по подобию прионов.
Таким образом, прионы в отношении своих исходных молекул играют роль антишаперонов, осуществляющих как бы фолдинг наоборот. Более того, процесс, очевидно, является автокаталитическим: вновь образовавшиеся порции «испорченного» белка начинают «портить» очередные порции нативного белка. Процесс продолжается, пока весь белок не оказывается «испорчен». Болезнь развивается в течение нескольких лет, но неотвратимо приводит к гибели животного или человека.
Как возникают в организме первые порции приона? Иногда, чрезвычайно редко, это происходит спонтанно - в результате ошибки фолдинга. Несколько чаще встречаются мутации, тогда болезнь передается по наследству. Наиболее часто болезнь возникает в результате употребления в пищу тех тканей животного, в которых содержатся прионы. Потому-то данные белки и названы инфекционными частицами.
Их отличает еще одна очень важная особенность - устойчивость к протеазам. Это помогает прионам проникать в неизмененном виде из желудочно-кишечного тракта в нервную ткань, где и запускается вышеизложенный автокаталитический процесс.
Все вместе это делает прионы уникальным инфекционным агентом: это, видимо, единственный случай, когда подобный агент лишен нуклеиновой кислоты (белковая инфекция).
Как же называются вызываемые прионами болезни? У коров это т. н. губчатая энцефалопатия (BSE - bovine spongiform encephalopathy), или коровье бешенство. Употребление человеком мяса таких коров вызывает болезнь Крейнцфельда-Якоба. Использование в популярной литературе термина «вирус коровьего бешенства» неграмотно. Прионы не вирусы. Кроме того, среди туземцев Новой Гвинеи известна еще одна болезнь той же природы - куру, при которой на лице человека то и дело появляются гримасы, как при смехе. Считают, что куру передается в результате каннибализма. Наконец, у овец болезнь называется почесухой: постоянный зуд заставляет животных все время тереться о твердые предметы. Открытие прионовых болезней позволяет некоторым биологам усомнится в так называемой «центральной догме молекулярной биологии». Определяющей однонаправленность потока информации от нуклеиновых кислот к белкам (ДНК↔РНК→белок).
Дополнительная литература.
-
Грин Н., Стаут У., Тейлор Д. Биология: В 3-х т. Т.1: Пер. с англ. / Под ред. Р. Сопера. -М: Мир, 1993. С.206-217.
-
Мушкамбаров Н.Н., Кузнецов С.Л. Молекулярная биология. М.: 2003. 554 с.
