
- •1. Энергетика процессов
- •1.1. Внутренняя энергия, энтальпия
- •1.2. Термохимия, закон Гесса
- •1.3 Энтропия
- •1.4. Энергия Гиббса
- •1.5. Критерий самопроизвольного протекания процессов
- •1.6. Изменение энергии Гиббса в окислительно-восстановительных реакциях
- •1.2. Термохимия, закон г.И. Гесса
- •1.3. Энтропия
- •1.4. Энергия Гиббса
- •1.5. Критерий самопроизвольного протекания процессов
- •1.6. Изменение энергии Гиббса в окислительно-восстановительных реакциях
ВВЕДЕНИЕ
В вузах химического и химико-технологического профиля изучению неорганической химии обычно предшествует дисциплина, где излагаются основные закономерности протекания химических процессов и современные представления о строении вещества. Традиционно в нее включаются элементы химической термодинамики, основы учения о равновесии и рассмотрение ряда важнейших равновесий в водных растворах, общие сведения о протекании химических реакций; элементы теории строения молекул и химической связи, представления о межмолекулярном взаимодействии, теория химической связи в комплексных соединениях и общая информация об этих соединениях.
Данное пособие представляет собой первую часть сжатого конспекта лекций по теоретическим основам химии, оно содержит большое число разобранных задач и заданий, закрепляющих усвоение основного лекционного материала и дающих практические навыки его использования. Такое сочетание лекционного и семинарского материала позволяет самостоятельно изучать необходимые разделы курса, готовиться к зачетам и экзаменам.
В пособие включен материал по следующим разделам курса: элементы химической термодинамики, учение о равновесии, равновесия в растворах, окислительно-восстановительные реакции, комплексные соединения, эквиваленты и закон эквивалентов.
Пособие будет полезно студентам медицинских, химических и технологических вузов, старшеклассникам, занимающимся углубленным изучением химии, и их педагогам.
1. Энергетика процессов
1.1. Внутренняя энергия, энтальпия
Химическая термодинамика, элементы которой используются в общехимических курсах, оперирует так называемыми характеристическими функциями или функциями состояния, позволяющими через значения самих функций и их производных определить любое термодинамическое свойство. Познакомимся с некоторыми из них.
Системой в термодинамике называют тело (вещество, несколько веществ) или группу взаимодействующих тел, мысленно выделяемых, обособляемых от окружающей среды. Примеры систем: Земля, колонна синтеза аммиака, пробирка с реактивами. Система, имеющая постоянный объем и рассматриваемая как необменивающаяся веществом и энергией с окружающей средой, называется изолированной. Создать действительно изолированную систему практически невозможно.
Движение представляет собой неотъемлемое свойство материального мира, мерой движения является энергия. Теплота и работа представляют собой виды энергии. В первом случае (теплота) энергия передается путем хаотического столкновения молекул на границе соприкасающихся тел. Работа качественно разнообразна (работа в поле тяготения, работа электрического поля, работа расширения и т.д.), отражая различные виды взаимодействия, и характеризуется перемещением большого числа частиц.
Закон сохранения энергии (или первый закон термодинамики) утверждает: теплота Q, поведенная к системе, расходуется на совершение системой работы A и на изменение ее внутренней энергии U:
Q = U + A. (1.1)
Внутренняя энергия представляет собой однозначную, конечную и непрерывную (а значит, и дифференцируемую!) функцию состояния, аргументами которой являются температура, давление, природа и число молей вещества и т.д. Как дифференцируемая функция внутренняя энергия обладает свойством независимости ее изменения при переходе от начального состояния (1) к конечному (2) от пути перехода:
U=U2 – U1. (1.2)
А вот теплота в общем случае не является дифференцируемой функцией.
Внутренняя энергия системы подразумевает общий ее запас, включая энергию поступательного и вращательного движения молекул, внутримолекулярную энергию электронов, внутриядерную энергию и т.д. Фактически абсолютная ее величина зависит от уровня наших знаний о различных видах энергии, а также о фундаментальных частицах и характере их взаимодействия. Поэтому до тех пор пока не решена проблема существования последней фундаментальной частицы, сама проблема определения абсолютного значения внутренней энергии лишена смысла.
Обычно работу разделяют на полезную и работу расширения:
А = Апол + Арасш . (1.3)
Работа расширения может быть найдена следующим образом:
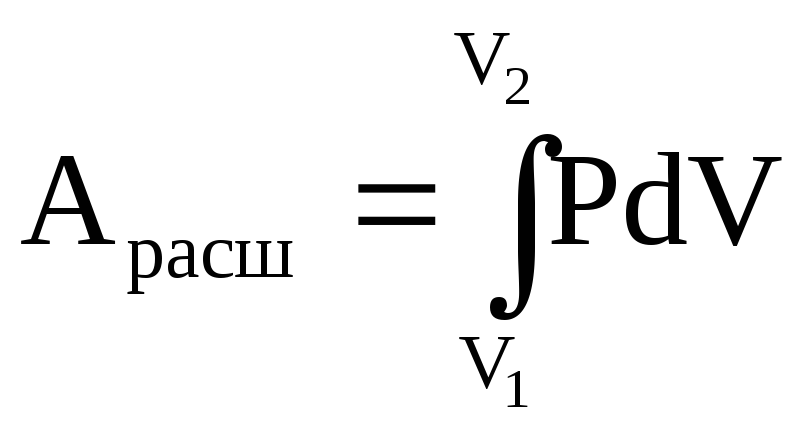 , (1.4)
, (1.4)
где Р - давление, V - объем.
Для изобарного процесса (P=const) уравнение (1.4) принимает вид:
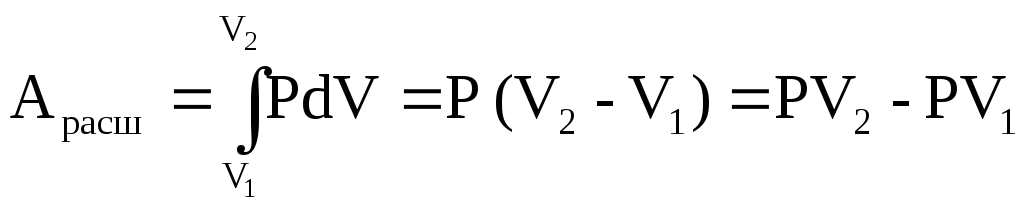 . (1.5)
. (1.5)
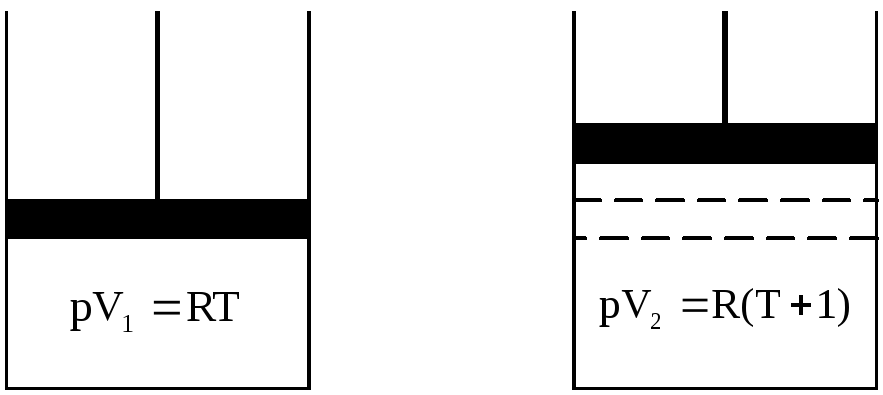 Отметим,
что любая химическая система, в которой
происходит изменение объема, будет
характеризоваться работой расширения.
В связи
с обсуждением этой величины
обратимся к физическому смыслу
универсальной газовой постояннойR.
Рассмотрим систему, содержащую 1 моль
идеального газа, находящегося при
постоянном давлении в цилиндре под
невесомым поршнем, двигающемся без
трения. Систему нагрели на 1 K,
газ расширился, поршень поднялся,
совершена работа расширения (рис.1).
Отметим,
что любая химическая система, в которой
происходит изменение объема, будет
характеризоваться работой расширения.
В связи
с обсуждением этой величины
обратимся к физическому смыслу
универсальной газовой постояннойR.
Рассмотрим систему, содержащую 1 моль
идеального газа, находящегося при
постоянном давлении в цилиндре под
невесомым поршнем, двигающемся без
трения. Систему нагрели на 1 K,
газ расширился, поршень поднялся,
совершена работа расширения (рис.1).
Рис. 1. К пояснению физического смысла газовой постоянной
Состояния газа описываются уравнением Менделеева-Клапейрона для начального состояния системы PV1 = RТ и для конечного состояния PV2 = R (Т+1). Работа расширения согласно (1.4) и (1.5) составит:
Арасш = PV = PV2 – PV1 = R (T+1) – RT = R.
Таким образом, численное значение универсальной газовой постоянной равно работе расширения 1 моль идеального газа, находящегося при постоянном давлении, при нагревании на 1 К.
Рассмотрим систему при постоянном давлении, для которой отсутствует полезная работа (Апол = 0). Согласно соотношениям (1.1) и (1.5):
QP=U+Aрасш = U+PV=U2–U1+PV2–PV1=U2+PV2–(U1+PV1). (1.6)
Вводим новую термодинамическую функцию, называемую энтальпией, которая определяется соотношением:
H = U+РV . (1.7)
Соответственно выражение (1.6) приобретает вид:
QP=H2–H1=H. (1.8)
Как видно из определения, энтальпия будет обладать свойством независимости ее изменения при переходе от начального состояния к конечному от пути перехода; она является однозначной, конечной и непрерывной функцией состояния. Абсолютные значения энтальпий, как и абсолютные значения величин внутренней энергии, неизвестны.
Поэтому в учебной и научной литературе слово "изменение" в выражениях типа "изменение энтальпии (внутренней энергии) в процессе" опускают и говорят об "энтальпии (внутренней энергии) процесса", понимая под этим величины H и U. Подчеркнем, что изобарный режим (в основном Р=1 атм) является наиболее распространенным для лабораторной и промышленной реализации различных процессов.
