18 производство азотки
.docПроизводство азотной кислоты. Химическая и функциональная схемы. Физико-химические основы процесса окисления аммиака, окисления оксида азота и абсорбции диоксида азота. Решение концепции полного использования сырья, эффективного использования энергоресурсов, минимизации отходов, эффективного использования оборудования.
Азотная кислота принадлежит к числу важнейших кислот и по объему производства занимает второе место после серной кислоты.
Существуют два способа производства азотной кислоты:
-
получение разбавленной азотной кислоты с последующим её концентрированием, в случае необходимости;
-
непосредственное получение концентрированной азотной кислоты.
Химическая и функциональная схема производства азотной кислоты.


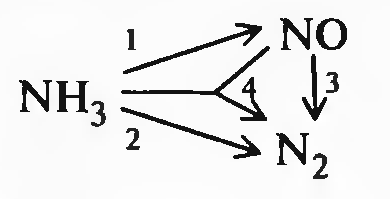
Окисление аммиака
Реакция сложная, каталитическая (платина), экзотермическая, необратимая
![]()
При высокой температуре процесса платина быстро разрушается, поэтому в качестве катализаторов применяют сплавы, содержащие 5-10% родия. Это повышает не только прочность, но и активность катализатора. Т=1100-1200К. В этих условиях практически не образовывается закись азота.
Реакция протекает во внешнедифузионной области, концентрации кислорода и аммиака малы, поэтому реакцию проводят при большом избытке кислорода, чтобы вытеснить аммиак из этой области.
 Увеличение
давления усиливает разложение NO до N2,
но абсорбция лучше проходит при повышенном
давлении. В России окисление проводят
при 0,4 мпа и последующую абсорбция при
1,2 мпа. O2:NH3
= 1:1,8 (соотв. 10% NH3)
Увеличение
давления усиливает разложение NO до N2,
но абсорбция лучше проходит при повышенном
давлении. В России окисление проводят
при 0,4 мпа и последующую абсорбция при
1,2 мпа. O2:NH3
= 1:1,8 (соотв. 10% NH3)
Окисление окиси азота
Реакция
окисления окиси азота до двуокиси –
обратимая, экзотермическая, гомогенная.
![]()
Реакция проходит при температурах ниже 400К, под повышенным давлением, в полом окислительном аппарате. В ходе реакции при охлаждении смеси выделяется вода и реагирует с N2O. Получается 30% азотная кислота, которая собирается и подаётся в абсорбер на соответствующую концентрации полку
Абсорбция двуокиси азота
Образующая по реакции 1 кислота нестойка и сразу разлагается до NO.
Суммарно реакцию можно представить так:
![]()
Используется абсорбционная колонная с переливными ситчатыми тарелками. NO доокисляется в пространстве между тарелками.
![]()
На стадии окисления кислород подают в соотношении 1,8:1, остальной кислород подаётся в абсорбционную колонну для окисления выделившегося NO.
Абсорбция улучшается при уменьшении температуры и увеличении давления.
Полное использование ресурсов:
На стадии абсорбции фазы идут противотоком, что обеспечивает максимальную движущую силу процесса, а жидкая фаза (вода+азотка) должна быть слабокислой, чтобы создать минимальное давление паров кислоты над ней.
Использование энергетических ресурсов и минимизация отходов:


Использование оборудования: