
Ксюха формальдегид
.docxМИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
РОССИЙСКИЙ ХИМИКО-ТЕХНОЛОГИЧЕСКИЙ УНИВЕРСИТЕТ ИМ. Д.И. МЕНДЕЛЕЕВА
Кафедра общей химической технологии

КУРСОВАЯ РАБОТА
По дисциплине: «Общая химическая технология»
Тема: Производство формальдегида путем совмещенного дегидрирования и окисления метанола на катализаторе
Выполнил студент: Батракова К.
Проверил: Игнатенков В.И.
Москва, 2013
Получение формальдегида путем совмещенного дегидрирования и окисления паров метанола на твердом катализаторе представляет химический процесс со сложной последовательно-параллельной реакцией. Кроме основной реакции протекают побочные реакции более глубокого окисления, дегидрирования и гидрирования, ведущие к образованию оксидов углерода, муравьиной кислоты, воды и метана.
Окислительное дегидрирование проводят при недостатке кислорода, поэтому глубокое окисление не получает значительного развития. В то же время само дегидрирование, инициируемое кислородом, протекает быстрее, и все ранее упомянутые побочные реакции не так заметны. Это позволяет проводить реакцию при более высокой температуре (500 - 600°С), большой скорости и времени контакта 0,01 - 0,03 с. Выход формальдегида достигает 80-85% при степени конверсии метанола 85-90%. Катализаторами синтеза формальдегида этим методом служит металлическая медь или серебро, осажденное на Al2O3. Последний катализатор оказался более эффективным и широко применяется в промышленности.
Технологическая схема производства формальдегида окислительным дегидрированием метанола изображен6а на рис. 1. Метанол, содержащий 10 - 12 % воды, из напорного бака 1 непрерывно поступает в испаритель 2. Туда же через распределительное устройство подают воздух, очищенный от пыли и других загрязнений. Воздух барботирует через слой водного метанола в нижней части испарителя и насыщает его парами. В 1 л образующейся паровоздушной смеси должно содержаться приблизительно 0,5 г метанола. Поддержание такого состава смеси очень важно для обеспечения взрывобезопасности и нормального протекания процесса. Поэтому работа испарительной системы полностью автоматизирована: поддерживают постоянные уровень жидкости в испарителе, ее температуру (48 - 50°С) и скорость подачи воздуха, благодаря чему обеспечиваются необходимые температурный режим и степень конверсии в адиабатическом реакторе.
Паровоздушная смесь проходит брызгоуловитель, находящийся в верхней части испарителя, затем перегреватель 3 и поступает в реактор 4, в средней части которого находится катализатор. Реакционные газы сразу же попадают в подконтактный холодильник 5 (смонтирован вместе с реактором), где происходит быстрое охлаждение смеси и предотвращает распад формальдегида. В разных системах охлаждение осуществляют проточной водой или паровым конденсатом, когда холодильник играет роль генератора пара низкого, среднего или даже высокого давления. Полученный пар (или горячая вода) служит для перегрева поступающей смеси в перегреватель 3 и для обогрева испарителя 2.
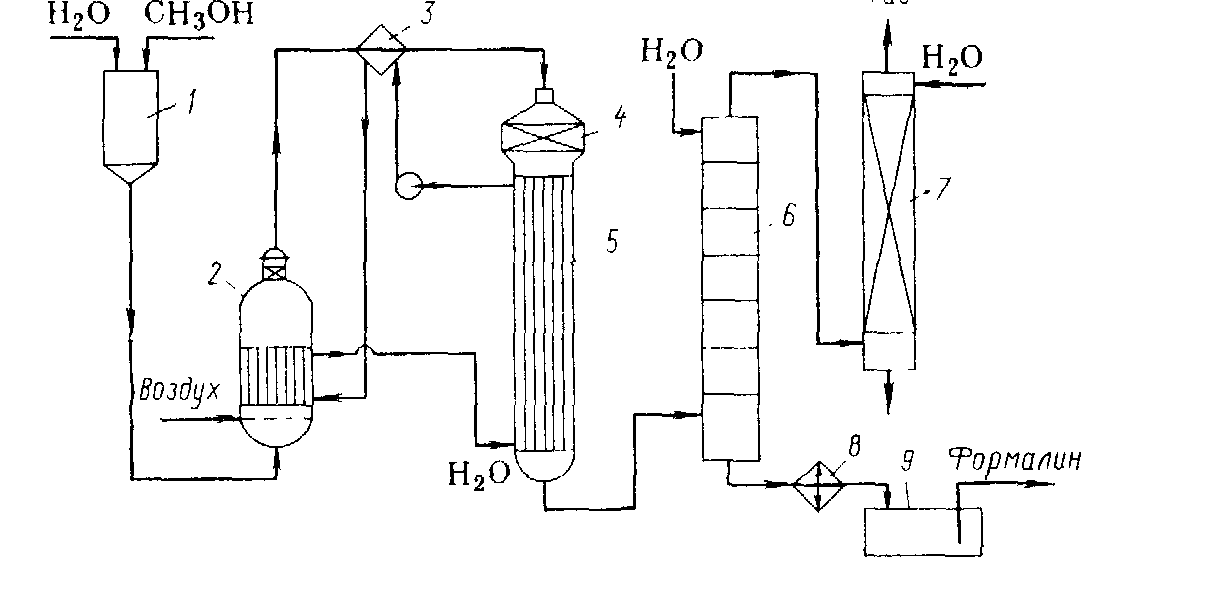
Рис. 1. 1) напорный бак; 2) испаритель; 3) перегреватель; 4) реактор;
5,8) холодильник; 6) абсорбер; 7) скруббер; 9) сборник.
Охлажденные реакционные газы поступают в абсорбер 6, выполненный в виде тарельчатой колонны, жидкость на тарелках охлаждают внутренними или выносными холодильниками. Абсорбер орошают таким количеством воды, чтобы в кубе получился 36 - 37% формалин. Стадии абсорбции и разделения продуктов оформляют двумя разными способами.
По одному из них в абсорбере поглощают как формальдегид, так и непревращенный метанол, который содержится в продуктах реакции в количестве, достаточном для стабилизации формальдегида. В этом случае верхнюю тарелку абсорбера охлаждают рассолом, а колонна 7 служит лишь для санитарной очистки газа, в то время как для получения безметанольного формалина необходима установка для отгонки метанола.
При втором способе в абсорбере поглощают преимущественно формальдегид, тогда скруббер 7 служит для абсорбции метанола, который отгоняют от воды и возвращают на реакцию. В обоих случаях формалин из куба абсорбера 6 охлаждают в холодильнике 8 и собирают в сборнике 9.
Химическая схема производства
-
СН3OH = CH2O + H2;
-
CH3OH + 0,5O2 = CH2O + H2O;
-
CH3OH + H2 = CH4 + H2O;
-
CH2O+ O2 = CO2 + 4H2O;
-
CH2O + 0,5O2 = HCOOH;
-
CO2 + H2 = CO + H2O;
-
2H2 + O2 = 2H2O.
Рассчитать ХТС производства формальдегида
Схема превращения метанола:
(1) + (2) (4) (6)


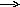 CH3OH
CH2O
CO2
CO
CH3OH
CH2O
CO2
CO

 (3)
(5)
(3)
(5)
CH4 CH2O2
Производительность: 2,0 тыс. т./год = 2.000.000 кг/год.
Перевод: 2.000.000 / 330 * 24 = 252,5 кг/час
М (СH2O) = 30 кг/Кмоль
252,5 / 30 = 8,417 Кмоль/час
Составим материальный
баланс для каждого вещества:
Тогда R = dR1 + dR2 - dR4 - dR5;
R = dA1 + dA2 - dR4 - dR5;
dA1 + dA2 = 0,383A0 + 0,407A0 = 0,79A0;
 0,1dA0
=M 0,79A0 = 7,9 M;
0,1dA0
=M 0,79A0 = 7,9 M;
dR4 = C +S;
dR5 = K;
Получаем:
R = 7,9M – C – S –K ;
R = 7,9*4,8X – 1,7X – 0,3X – 0,7X ;
X = R / 35,22 ;
X = 8,417 / 35,22 = 0,239 (кмоль/ч);
Значит:
К = НСООН = 0,7 * 0,239 = 0,1673;
S = CO = 0,3 * 0,239 = 0,0717;
C = CO2 = 1,7 *0,239 = 0,4063;
M = CH4 = 4,8 * 0,239 = 1,1472;
Найдем количество CH3OH:
N(CH3OH) = A0;
0,1A0 = M = 1,1472;
N(CH3OH) = 1,1472 / 0,1 =11,472 кмоль / ч;
Найдем количество Н2О в спиртовом растворе:
 G(CH3OH)
= 11,472 * 32 = 367,104 кг / ч;
G(CH3OH)
= 11,472 * 32 = 367,104 кг / ч;
367,104 кг / ч 90,3 масс.
%![]()
G(сп.раст.) 100 масс.%
G(сп.раст.) = 100 * 367,104 / 90,3 =406,54 кг / ч;
G(Н2Осп.раст.) = 406,54 – 367,104 = 39,434 кг / ч;
Найдем количество влажного
воздуха:![]()
N(CH3OH) = 11,472 кмоль / ч
42 об.%![]()
N(сп.возд.см) Х 100 об.%
Х = 100 * 11,472 / 42 = 27,314 кмоль / ч;
N(Н2Осп.раст.) = 39,434 / 18 = 2,19 кмоль/ ч;
N(вл.возд.) = 27,314 – 2,19 – 11,472 = 13,652 кмоль /ч;
Найдем все компоненты влажного воздуха:
% Н2О = Р(вод.пар.) / Р(общ.) = 3,8 / 101,3 = 0,0375 = 3.75%
N(вл.возд.) = 13,652 кмоль / ч
100 об.%![]()
![]()
![]()
N(Н2О
возд.) = Х 3,75%![]()
Х = 3,75 * 13,652 /100 = 0,512 кмоль/ ч;
N (сух.возд.) = 13,652 – 0,512 = 13,14 кмоль / ч;
Получаем:![]()
N (сух.возд.) = 13,14 кмоль / ч
100 об.%![]()
N(N2)
= X
79 об.% ![]()
N(02) = Y 21об.%
Х = 79 * 13,14 / 100 = 10,28 кмоль / ч;
Y = 21 * 13,14 / 100 = 2,86 кмоль / ч;
По итогам прихода получаем:
N(CH3OH) = 11,472 кмоль / ч G = 367,104 кг / ч
N(N2) = 10,28 кмоль / ч G = 290,3 кг / ч
N(O2) = 2,76 кмоль / ч G = 88,32 кг / ч
N(H2O) = 0,512 + 2,19 = 2,702 кмоль / ч G = 48,636 кг / ч
Рассчитываем компоненты в расходе:
Кислород расходуется на 2 , 4 , 5 и 7 реакции
2. N(O2) = 0,5 * 0,407A0 = 0,5 * 0,407 * 11,472 = 2,285 кмоль / ч;
4. N(O2) = N(CHOH) = C + S = 0,0717 + 0,4063 = 0,478 кмоль / ч;
5. N(O2) = 0,5 * N(HCOOH) = 0,5 * 0,1673 = 0,0837 кмоль / ч;
7. N(O2) = N (O2 прих.) - (2) - (4) - (5) = 2,86 – 2,285 – 0,478 – 0,0837 =0,0133 кмоль / ч;
Водород образуется и расходуется в 1 , 3 , 6 и 7 реакциях:
1 . N(H2) = N(CH3OH) = 0,383A0 = 0,383 * 11,472 = 4,394 кмоль / ч;
3. N(H2) = N(CH4) = 1,1472 кмоль / ч;
6. N(CO) = N(CO) = 0,0717 кмоль / ч;
7. N(H2) = 2 * N(O2) = 2 * 0,0133 = 0, 0266 кмоль / ч;
Остается непрореагированным:
N(H2) = 4,394 – 1,1472 – 0,0717 – 0,0266 = 3,1484 кмоль / ч;
Спирт непрореагировавший:
N(CH3OH) = (1 – X(общ.)) * А0 = (1 – 0,89) * 11,472 = 1,262 кмоль / ч;
Найдем количество воды:
Н2О образуется в 2 , 3 , 4 , 6 и 7 реакциях:
2. N(H2O) = 0,407A0 = 0,407 * 11,472 = 4,67 кмоль / ч;
3. N(H2O) = N(CH4) = 1,1472 кмоль / ч;
4. N(H2O) = N(O2) = 0,478 кмоль / ч;
6. N(H2O) = N(CO) = 0,0717 кмоль / ч;
7. N(H2O) = N(H2) = 0,0266 кмоль / ч;
Добавляем воду из прихода, так как она не участвовала в реакциях:
N(H2O) = 2,702 + 4,67 + 1,1472 + 0,478 + 0,0717 + 0,0266 = 9,0955 кмоль / ч;
По итогам расхода получаем:
N(HCOH) = 8,417 кмоль / ч G = 252,5 кг / ч
N(HCOOH) = 0,1673 кмоль / ч G = 7,7 кг / ч
N(CO) = 0,0717 кмоль / ч G = 2 кг / ч
N(CO2) = 0,4063 кмоль / ч G = 17,877 кг / ч
N(H2) = 3,1484 кмоль / ч G = 6,297 кг / ч
N(H2O) = 9,0955 кмоль /ч G = 163,72 кг / ч
N(N2) = 10,28 кмоль / ч G = 290,64 кг /ч
N(CH3OH) = 1,262 кмоль / ч G = 35,5 кг / ч
Составляем таблицу материального баланса процесса получения формальдегида
|
Приход |
|
|
Расход |
|
|
статья |
Кг/час |
|
статья |
Кг/час |
|
Спирто-воз.см |
|
|
НСООН |
252,5 |
|
СН3ОН |
367,1 |
|
СН3ОН |
35,5 |
|
О2 |
91,52 |
|
Н2О |
163,72 |
|
N2 |
287,84 |
|
Н2 |
6,297 |
|
H2O |
48,64 |
|
НСООН |
7,7 |
|
|
|
|
СО |
2 |
|
|
|
|
СО2 |
17,877 |
|
|
|
|
СН4 |
18,355 |
|
|
|
|
N2 |
287,84 |
|
|
|
|
|
|
|
Всего |
795,1 |
|
Всего |
791,784 |
Невязка: 0,4%
