
PC1E2010
.RTFВопросы к экзамену по физ.химии ч.1, второй курс, весна 2010г (от 06.06.2010)
ОСНОВЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ
-
Основные понятия химической термодинамики. Система, равновесное состояние и термодинамический процесс. Экстенсивные и интенсивные свойства. Функции состояния и функции процесса. Может ли термодинамическая величина, являющаяся, в общем случае, функцией процесса, приобретать свойства функции состояния? При положительном ответе приведите примеры.
-
Первое начало термодинамики. Внутренняя энергия. Теплота и работа как формы передачи энергии. Взаимосвязь этих величин в изохорном и изотермическом процессах.
-
Первый закон термодинамики, формулировки 1-го закона термодинамики. Внутренняя энергия системы. Теплота и работа как формы передачи энергии. 1-ый закон термодинамики применительно к изотермическому и изохорному процессам.
-
Изобразите схематически на одном графике в координатах параметров состояния Р= f(V) процессы обратимого изотермического и обратимого изобарного расширения идеального двухатомного газа от одного и того же начального состояния до двукратного увеличения объёма. Поясните для какого из указанных выше процессов работа расширения больше?
-
Изохорная и изобарная молярные теплоемкости. Связь между ними для идеального газа. Зависимость изобарной теплоемкости от температуры для веществ в кристаллическом, жидком и газообразном состоянии.
-
Внутренняя энергия и энтальпия системы, их взаимосвязь. Зависимость внутренней энергии и энтальпии вещества от температуры. Интегрирование соответствующих уравнений.
-
Термохимия. Закон Гесса и его термодинамическое обоснование. Связь тепловых эффектов химической реакции при постоянном давлении и постоянном объеме.
-
Тепловой эффект химической реакции. Стандартные теплоты образования и сгорания. Закон Гесса, следствия из закона Гесса.
-
Стандартные теплоты образования и сгорания химических соединений. Их использование для расчета тепловых эффектов химических процессов. Как на основании экспериментальной величины стандартной теплоты сгорания какого-либо вещества рассчитать стандартную теплоту его образования? Какие дополнительные сведения необходимы для этого?
-
Тепловой эффект химической реакции как функция температуры, уравнение Кирхгофа. Характер кривых
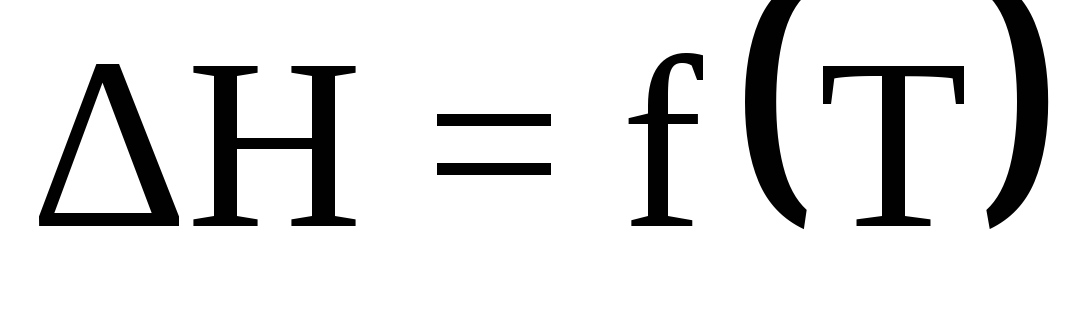 в зависимости от вида кривых
в зависимости от вида кривых
 для исходных и конечных веществ.
для исходных и конечных веществ. -
Вывод и анализ уравнения Кирхгофа. Использование интегральных форм уравнения для вычисления тепловых эффектов химических процессов при заданной температуре (в том числе стандартной теплоты образования при
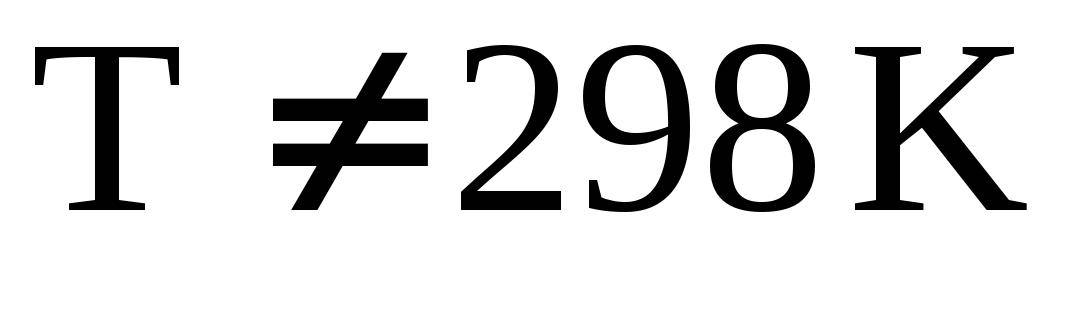 ).
). -
Зависимость теплового эффекта химической реакции от температуры проходит через максимум (вариант: «минимум») при Т=….К. Представьте график температурной зависимости этой функции и график зависимостей сумм теплоемкостей продуктов и исходных веществ (∑νicP,i) от температуры. Дайте необходимые пояснения.
-
Для некоторой реакции сумма теплоемкостей исходных веществ меньше суммы теплоемкостей продуктов. Причем при повышении температуры ΔrСр увеличивается. Изобразите схематически графики зависимости
 для исходных веществ и продуктов реакции
и теплового эффекта реакции от
температуры. Приведите краткое
теоретическое обоснование ответа и
соответствующие математические
выражения.
для исходных веществ и продуктов реакции
и теплового эффекта реакции от
температуры. Приведите краткое
теоретическое обоснование ответа и
соответствующие математические
выражения. -
Второе начало термодинамики. Энтропия, изменение энтропии в термодинамических процессах с участием идеального газа при
 и
и
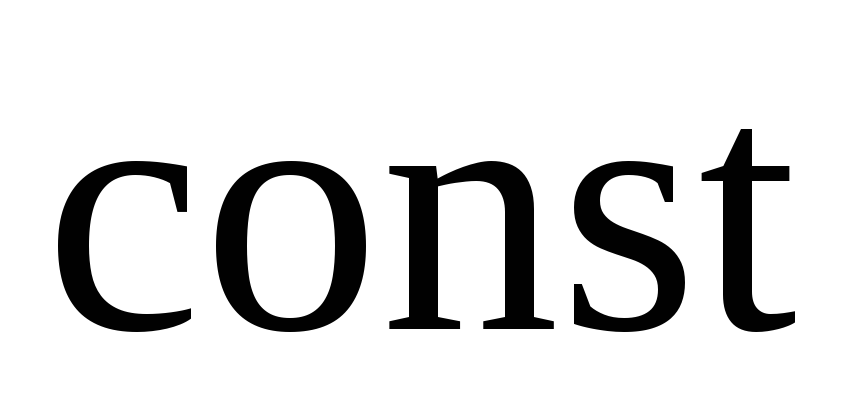 .
.
-
Второе начало термодинамики. Энтропия. Зависимость энтропии от температуры и давления. Изменение энтропии в процессах с участием идеального газа.
-
Второе начало термодинамики. Энтропия. Изменение энтропии в процессе смешения идеальных газов.
-
Самопроизвольные и несамопроизвольные процессы. Второе начало термодинамики. Математическое выражение 2-го закона термодинамики. Изменение энтропии в самопроизвольном процессе, протекающем в изолированной системе.
-
Термодинамически обратимые и необратимые, самопроизвольные и несамопроизвольные процессы. Формулировки и математическое выражение второго начала термодинамики.
-
Второе начало термодинамики, математическое выражение для обратимых и необратимых (самопроизвольных) процессов. Энтропия как критерий равновесия и направления самопроизвольного протекания процесса в изолированной системе.
-
Второе начало термодинамики. Самопроизвольные и несамопроизвольные процессы. Энтропия и энергия Гиббса как критерии равновесия и направления самопроизвольного процесса.
-
Объединенное уравнение I и II законов термодинамики. Энергия Гиббса и энергия Гельмгольца как критерии состояния равновесия и направления химического процесса.
-
Постулат Планка. Аналитический и графический методы определения абсолютной стандартной энтропии вещества.
-
Постулат Планка. Расчет абсолютной энтропии индивидуального вещества на основании постулата Планка в стандартных условиях (
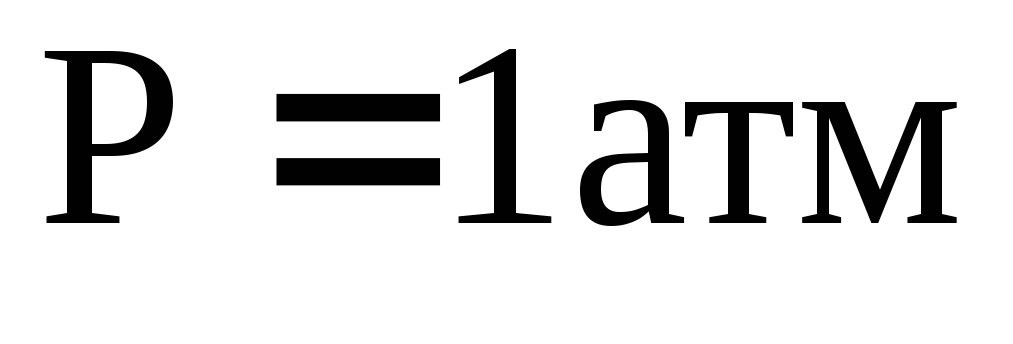 ).
Как найти энтропию газообразного
вещества при
).
Как найти энтропию газообразного
вещества при
 и
и
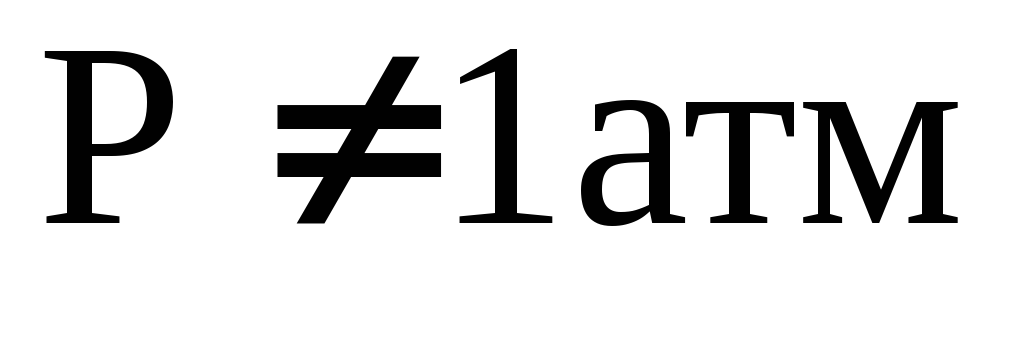 ?
? -
Зависимость энтропии индивидуального вещества от температуры при постоянном давлении. Приведите соответствующее дифференциальное уравнение. Схематически изобразите график этой зависимости в широком температурном интервале, включающем температуры плавления и кипения вещества.
-
Энергия Гиббса, зависимость энергии Гиббса от температуры и давления. Графическое представление и анализ указанных зависимостей.
-
Энергия Гельмгольца. Зависимость энергии Гельмгольца от ее естественных переменных (V и T). Графическое представление указанных зависимостей. Расчет
 в процессах нагревания и расширения
идеального газа.
в процессах нагревания и расширения
идеального газа.
-
Энтропия, энергия Гиббса и энергия Гельмгольца как критерии состояния равновесия и направления процессов.
-
Энергия Гиббса, энергия Гельмгольца. Применение этих термодинамических функций для определения состояния равновесия и направления химического процесса.
-
Энергия Гиббса и энергия Гельмгольца. Применение этих характеристических термодинамических функций для определения состояния равновесия и направления самопроизвольных процессов в изотермических условиях.
-
Применение таблиц стандартных термодинамических величин для расчета
 и
и
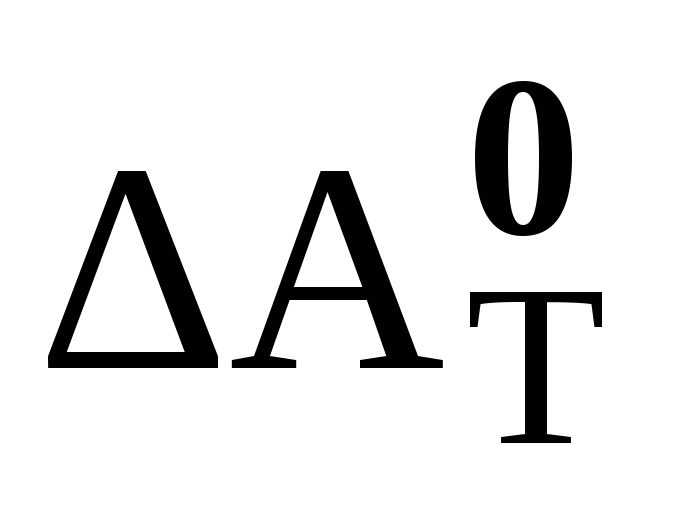 химических реакций.
химических реакций. -
Зависимость энергии Гиббса и энергии Гельмгольца химической реакции от температуры. Уравнения Гиббса-Гельмгольца. Связь
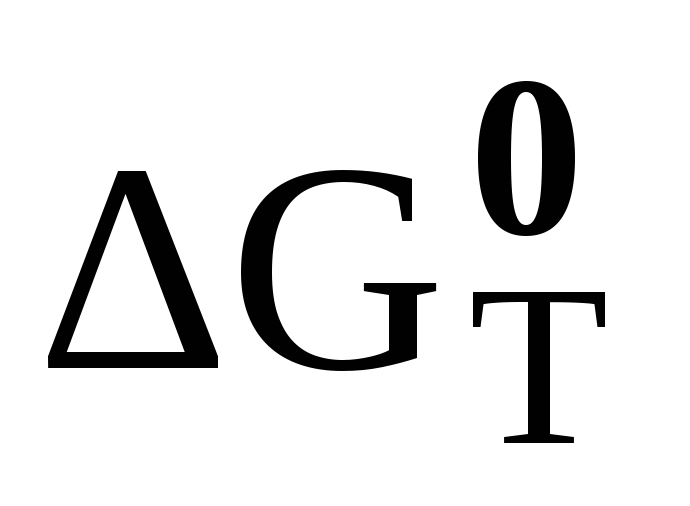 и
и
 химической реакции.
химической реакции. -
Системы переменного состава. Химический потенциал компонента системы. Зависимость химического потенциала от давления и температуры. Условия равновесия и самопроизвольного протекания химического процесса в системах переменного состава.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
-
Краткая характеристика химического равновесия. Закон действующих масс, термодинамическое обоснование (все реагенты – идеальные газы). Термодинамическая и эмпирическая константы равновесия.
-
Направление протекания химического процесса при заданных начальных условиях. Вывод и анализ уравнения изотермы химической реакции.
-
Основные количественные характеристики химического равновесия: константа химического равновесия, степень превращения, степень диссоциации, равновесный выход. Поясните смысл этих величин на примере конкретных химических реакций.
-
Степень диссоциации вещества в реакциях термического разложения (термической диссоциации). Влияние давления и температуры на степень диссоциации. Можно ли изменением этих параметров увеличить степень диссоциации
 на
на
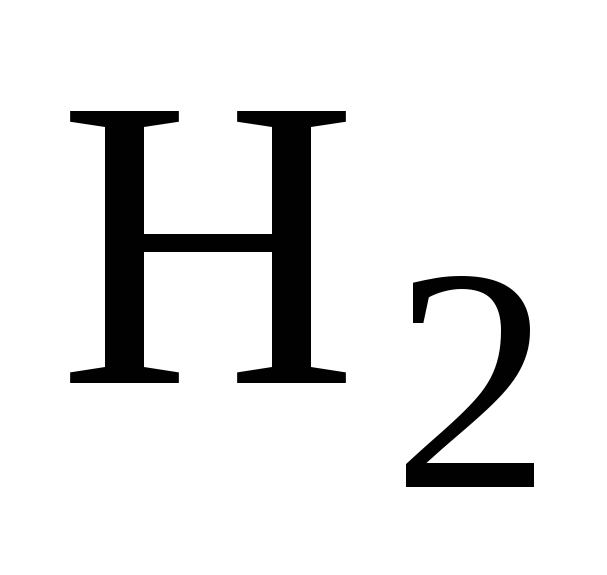 и
и
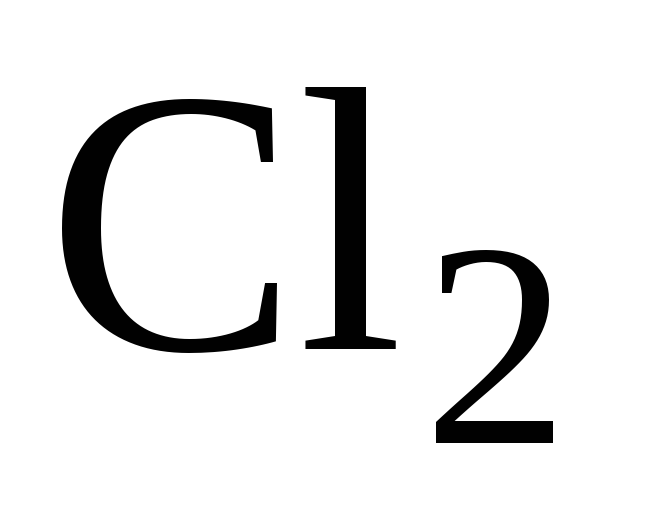 .
. -
Степень превращения исходных веществ и равновесный выход продукта. Способы их расчета при заданной температуре. Какие данные необходимы для этого? Дайте схему расчета любой из этих количественных характеристик химического равновесия на произвольном примере.
-
Степень превращения как количественная характеристика химического равновесия. Как повлияют повышение общего давления и температуры на степень превращения реагента … в газофазной реакции: (дано уравнение)? Приведите обоснование ответа и соответствующие математические выражения.
-
Равновесный выход химической реакции. Выразите в общем виде константу равновесия
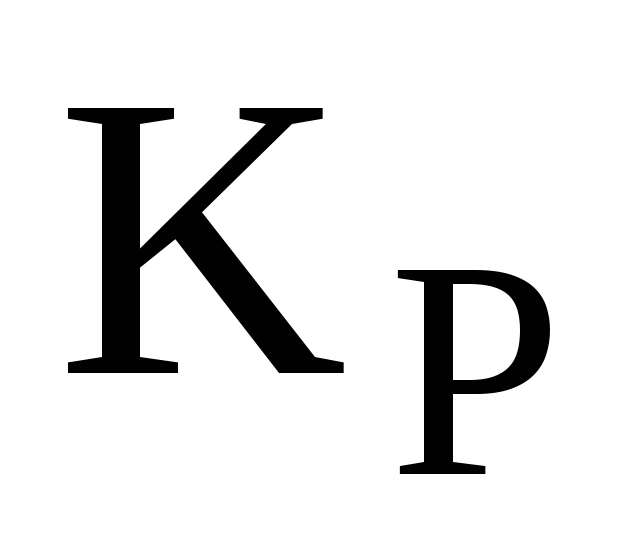 для реакции (дано
уравнение газофазной реакции)
через равновесное число молей компонента
… (х), и общее давление в системе р,
если для проведения реакции исходные
вещества взяты в стехиометрических
количествах.
для реакции (дано
уравнение газофазной реакции)
через равновесное число молей компонента
… (х), и общее давление в системе р,
если для проведения реакции исходные
вещества взяты в стехиометрических
количествах. -
Вывод и анализ уравнения изотермы химической реакции. Химическое сродство. Стандартное химическое сродство.
-
Закон действующих масс и его термодинамическое обоснование. Термодинамическая и эмпирическая константы химического равновесия. Способы выражения эмпирической константы химического равновесия.
-
Константа химического равновесия. Влияние общего давления и примеси инертного газа на равновесный выход продуктов реакции.
-
Способы выражения константы химического равновесия:
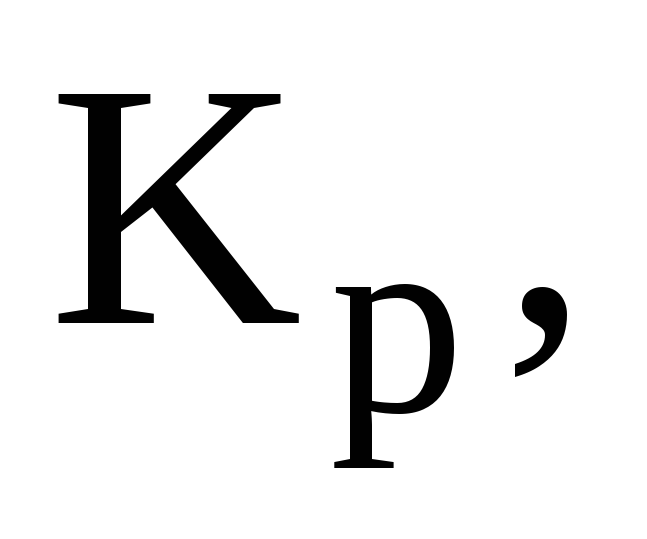 Кс
и Кх.
Связь между эмпирическими константами
равновесия.
Кс
и Кх.
Связь между эмпирическими константами
равновесия. -
Влияние температуры на химическое равновесие. Вывод и анализ уравнения изобары Вант-Гоффа.
-
Константа химического равновесия, ее зависимость от температуры. Расчет тепловых эффектов химических реакций по данным о химическом равновесии.
-
Влияние давления и температуры на константу химического равновесия и смещение химического равновесия. Проиллюстрируйте на примере произвольно выбранной газофазной реакции.
-
Влияние давления, примеси инертного газа и соотношения реагентов на смещение химического равновесия на примере реакции: (дано уравнение).
-
Влияние различных факторов (
 концентрации реагентов) на смещение
химического равновесия. Можно ли
повышением давления добиться увеличения
выхода
концентрации реагентов) на смещение
химического равновесия. Можно ли
повышением давления добиться увеличения
выхода
 в реакции гидрирования пропена?
в реакции гидрирования пропена? -
Термодинамическая и эмпирическая константы химического равновесия. Способы выражения эмпирической константы равновесия. Связь
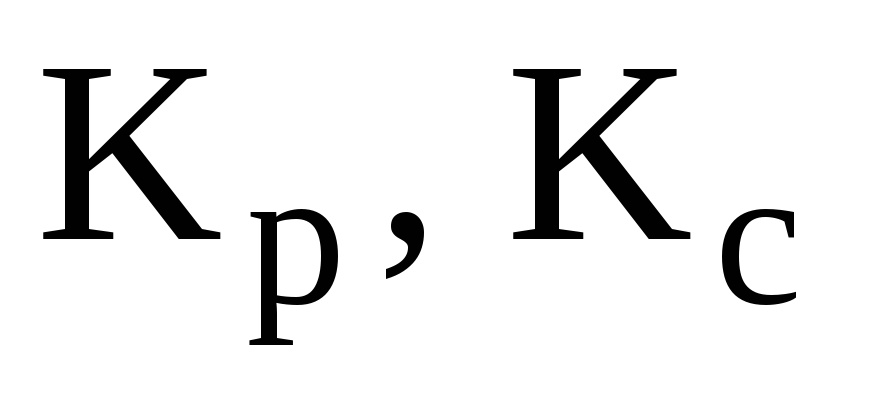 и Кх.
и Кх. -
Константа равновесия химической реакции. Выражение константы равновесия через степень диссоциации и равновесное давление в системе. Рассмотрите на произвольном примере (в другом варианте этого вопроса дано уравнение).
-
Влияние температуры на химическое сродство и константу равновесия газофазных реакций. Проиллюстрируйте на примере реакции гидрирования этилена.
-
Влияние температуры на химическое равновесие. Вывод и анализ уравнения изобары Вант-Гоффа. Приведите пример химической реакции, для которой константа равновесия возрастает с увеличением температуры.
-
Влияние температуры на химическое равновесие. Вывод и анализ уравнения изобары Вант-Гоффа. Приближенное и уточненное интегрирование уравнения.
-
Особенности химического равновесия в гетерогенных системах. Примеры выражения константы химического равновесия для гетерогенных реакций. Влияние давления на смещение химического равновесия.
-
Уравнение изотермы химической реакции, его применение. Запишите уравнение изотермы Вант-Гоффа для химической реакции (дано уравнение гетерогенной реакции), в которой участвуют практически чистые вещества в твёрдом состоянии, а газообразные вещества можно отождествить с идеальными газами. Приведите варианты уравнения для случаев начала и завершения (т.е. установления состояния равновесия) реакции.
-
Химическое равновесие в гетерогенных системах. Приведите выражение для константы равновесия двух реакций: диссоциация карбонатов кальция и магния на соответствующий оксид металла и диоксид углерода. Для какой из этих реакций равновесие смещено в сторону продуктов реакции в большей степени?
-
Проанализируйте влияние температуры на равновесие химической реакции (дано уравнение). Изобразите график температурной зависимости константы равновесия реакции в координатах
 при условии, что
при условии, что
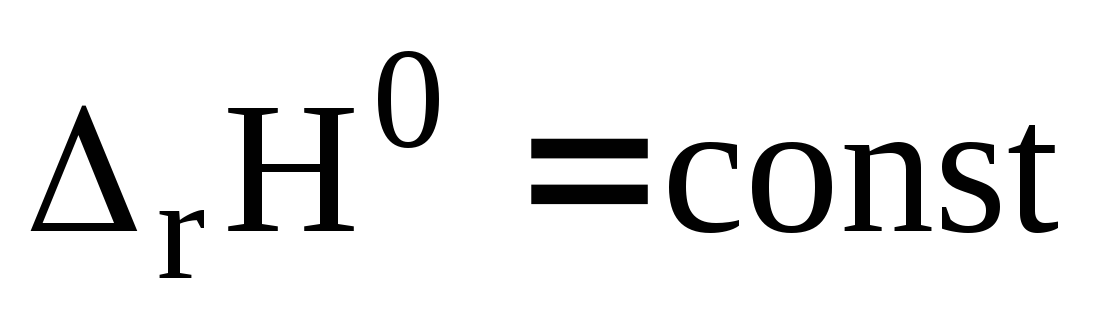 .
Покажите, как на основании этого графика
рассчитать среднюю величину теплового
эффекта.
.
Покажите, как на основании этого графика
рассчитать среднюю величину теплового
эффекта.
-
Представьте графическую зависимость константы равновесия экзотермической химической реакции от температуры в координатах
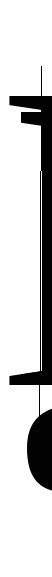 .
Поясните, как на основе указанной
зависимости рассчитать средний тепловой
эффект химической реакции.
.
Поясните, как на основе указанной
зависимости рассчитать средний тепловой
эффект химической реакции.
-
Определение среднего и истинного теплового эффекта реакции по зависимости константы химического равновесия от температуры. Аналитические и графические методы.
-
Методы расчета констант химического равновесия на основании справочных данных о термодинамических величинах.
-
Методы расчета констант химического равновесия. Расчет термодинамической константы равновесия на основании справочных данных о логарифмах констант равновесия реакций образования реагентов из простых веществ. Приведите обоснование этого метода на примере реакции (дана реакция).
-
Расчет стандартного химического сродства и константы химического равновесия при различных температурах.
-
Метод комбинирования уравнений химических реакций как метод определения константы равновесия химической реакции.
ФАЗОВОЕ РАВНОВЕСИЕ В ОДНОКОМПОНЕНТНЫХ СИСТЕМАХ
-
Фазовые равновесия в однокомпонентной системе, диаграмма состояния. Описание кривых и характерных точек на диаграмме. Правило фаз Гиббса.
-
Вывод и анализ уравнения Клапейрона-Клаузиуса для фазовых переходов «твердая фаза – жидкость».
-
Фазовые переходы 1-го рода. Диаграмма состояния однокомпонентных систем для случая, когда
 .
Применение правила фаз Гиббса. Какое
максимальное число фаз может находиться
в равновесии в однокомпонентной системе?
.
Применение правила фаз Гиббса. Какое
максимальное число фаз может находиться
в равновесии в однокомпонентной системе? -
Фазовые равновесия в однокомпонентных системах. Диаграмма состояния. Вывод и анализ уравнения Клапейрона-Клаузиуса для процессов испарения и возгонки.
-
Диаграмма состояния однокомпонентной системы. Анализ уравнения Клапейрона-Клаузиуса для процессов испарения – конденсации. Какими точками начинается и заканчивается кривая, выражающая зависимость давления насыщенного пара над жидкой фазой от температуры.
-
Фазовое равновесие в однокомпонентных системах. Зависимость давления насыщенного пара над жидкой фазой от температуры. Вывод и анализ уравнения.
-
Уравнение Клапейрона-Клаузиуса в интегральной форме (
 для процесса испарения - конденсации.
Определение средней теплоты конденсации
насыщенного пара на основании графической
зависимости
для процесса испарения - конденсации.
Определение средней теплоты конденсации
насыщенного пара на основании графической
зависимости
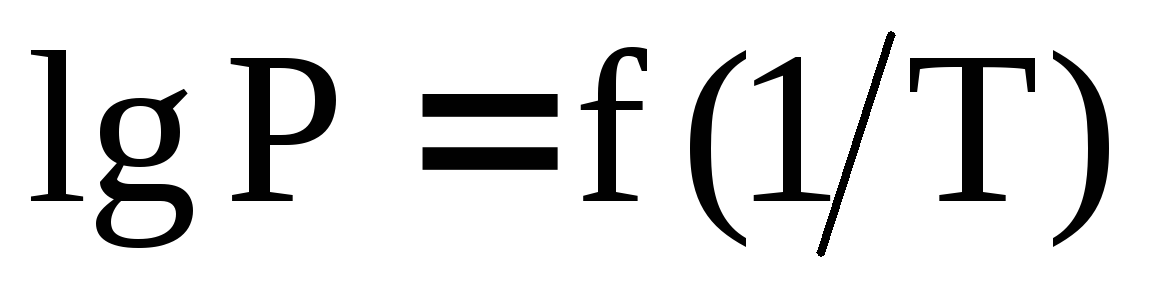 .
. -
Интегральные формы уравнения Клапейрона-Клаузиуса. Приведите уравнения, выражающие зависимость давления насыщенного пара над жидкой фазой от температуры при условиях: а)
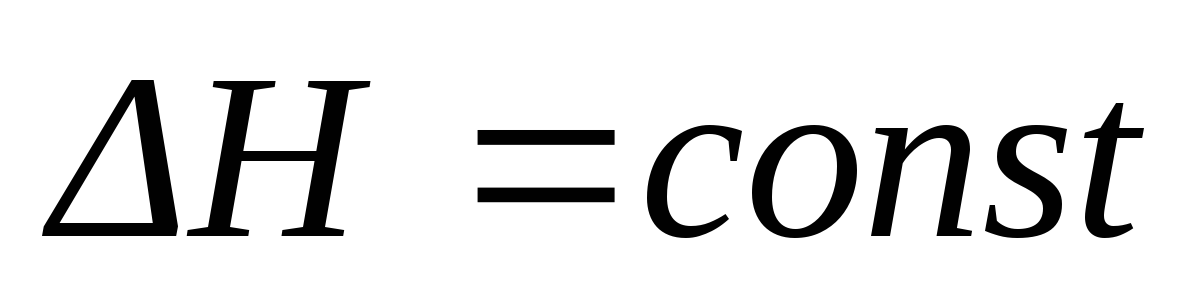 ,
б)
,
б)
 .
Какому из приведенных выше условий
отвечает линейная зависимость в
координатах
.
Какому из приведенных выше условий
отвечает линейная зависимость в
координатах
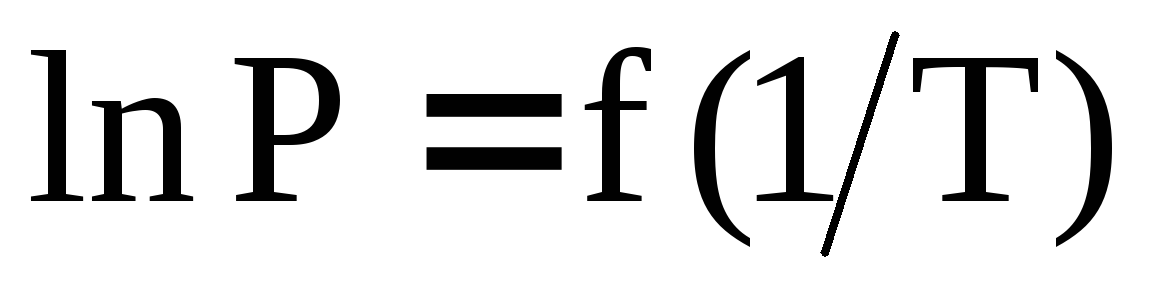 ?
Пар считать идеальным газом.
?
Пар считать идеальным газом. -
Аналитические и графические методы расчета среднего значения теплоты испарения и теплоты возгонки.
-
Графические методы расчета среднего и истинного значений теплоты испарения на основании зависимости давления насыщенного пара от температуры.
-
Расчет термодинамических функций фазовых превращений из экспериментальных данных о зависимости давления насыщенного пара над жидкой и твердой фазами от температуры.
-
Диаграмма состояния однокомпонентной системы. Охарактеризуйте фазовые поля и линии на диаграмме. Каким уравнением описываются все три кривые на диаграмме? Поясните, почему тангенс угла наклона касательной к кривым возгонки и испарения в координатах
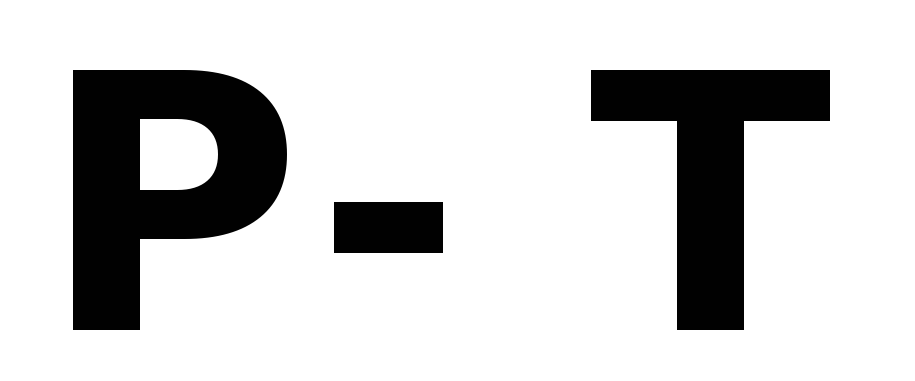 всегда
положителен, тогда как к кривой плавления
он может принимать значения как больше,
так и меньше нуля?
всегда
положителен, тогда как к кривой плавления
он может принимать значения как больше,
так и меньше нуля? -
Диаграмма состояния однокомпонентной системы. Почему ряд веществ при нагревании на воздухе, минуя жидкое состояние, сразу переходят в пар? Проиллюстрируйте ответ анализом схематических диаграмм состояния, приведите примеры.
-
Дайте определение температуры кипения индивидуальной жидкости. Измерены значения температуры кипения жидкости при различных внешних давлениях в интервале
 .
Представьте полученные результаты
измерений (схематически) в координатах
.
Представьте полученные результаты
измерений (схематически) в координатах
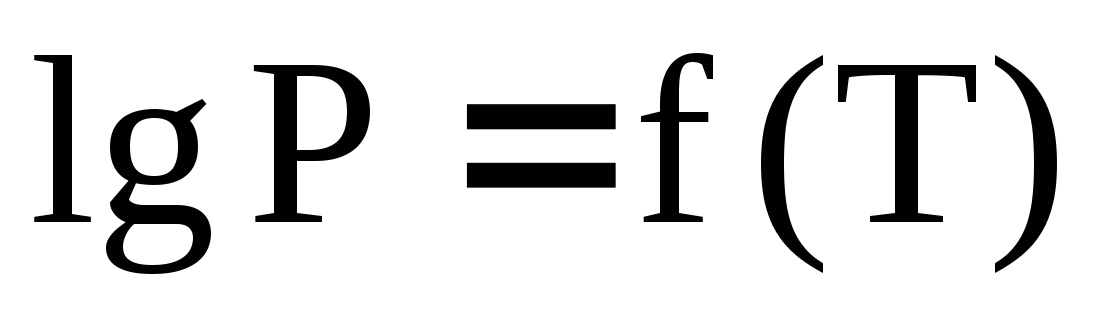 .
Как на основании построенного графика
определить истинную энтальпию
парообразования вещества при некоторой
температуре Т1?
.
Как на основании построенного графика
определить истинную энтальпию
парообразования вещества при некоторой
температуре Т1? -
Плотность жидкого металла больше его плотности в твердом состоянии. Как изменяется температура плавления этого металла при повышении внешнего давления? Изобразите схематически диаграмму состояния однокомпонентной системы (в координатах
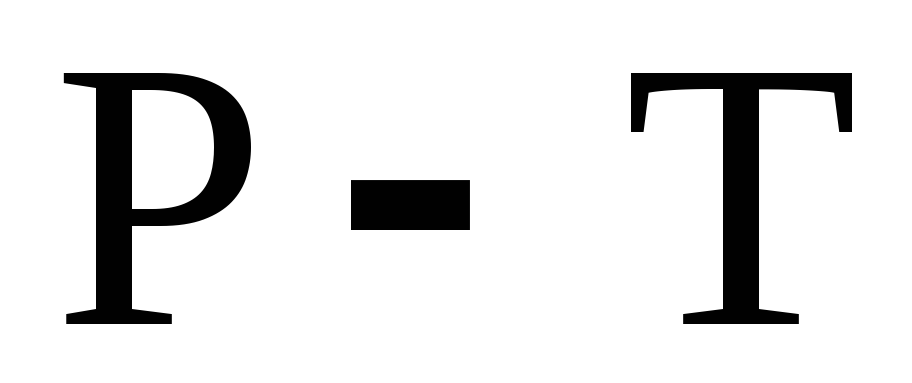 )
для рассматриваемого случая.
)
для рассматриваемого случая.
-
Возрастает, уменьшается или остается неизменной энтальпия испарения вещества с повышением температуры? Представьте эту зависимость в графической форме. Какое значение принимает энтальпия парообразования при критической температуре? Дайте обоснованный ответ.
-
Изобразите схематически график
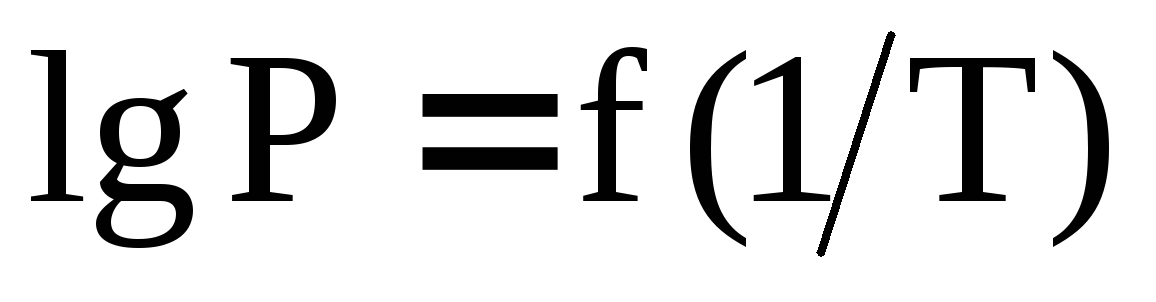 для процесса испарения в случае, когда
для процесса испарения в случае, когда
 .
Приведите аналитическое выражение
графической зависимости. Как на основании
этого графика рассчитать величину
средней теплоты испарения.
.
Приведите аналитическое выражение
графической зависимости. Как на основании
этого графика рассчитать величину
средней теплоты испарения.
-
Имеются данные о зависимости давления насыщенного пара от температуры над жидкой и твердой фазами. Поясните, каким образом представив эти результаты графически в виде зависимостей
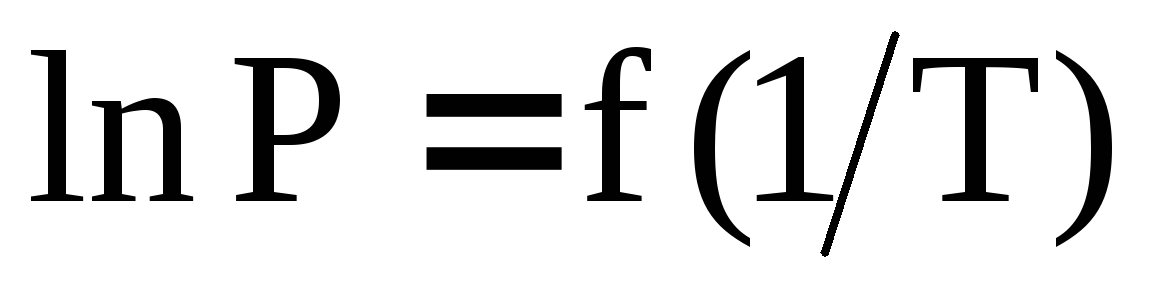 определить координаты тройной точки?
определить координаты тройной точки?
ОСНОВЫ ТЕРМОДИНАМИКИ РАСТВОРОВ
-
Парциальные молярные свойства компонентов системы, определение и математическое выражение. Аналитические и графические методы определения парциальных молярных величин.
-
Парциальные молярные свойства (величины) компонентов раствора. Уравнения Гиббса-Дюгема.
-
Парциальные молярные величины. Вывод и анализ уравнений Гиббса-Дюгема.
-
Графические методы определения парциальных молярных величин (метод касательных и метод пересечений (отрезков).
-
Получена графическая зависимость объема водного раствора от количества молей растворенной мочевины в 1000г воды. Поясните, как определить парциальные молярные объемы компонентов
 и
и
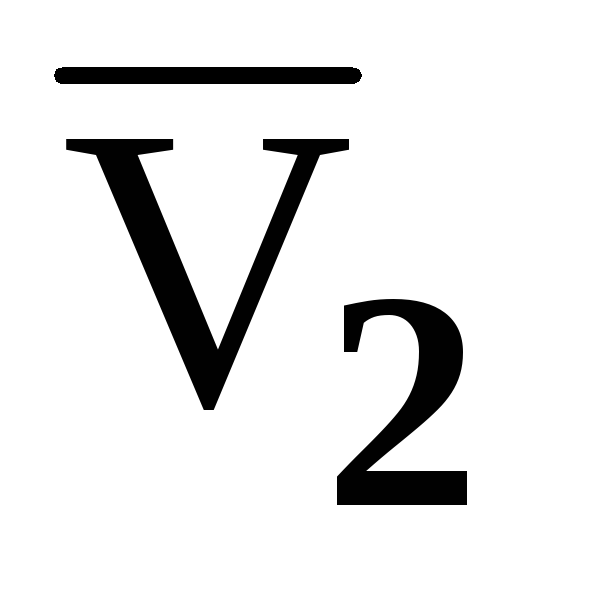 при концентрации раствора m2.
при концентрации раствора m2. -
Относительные парциальные молярные свойства (парциальные молярные функции смешения). Вывод уравнения, связывающего изменение энергии Гиббса при образовании 1 моля идеального раствора
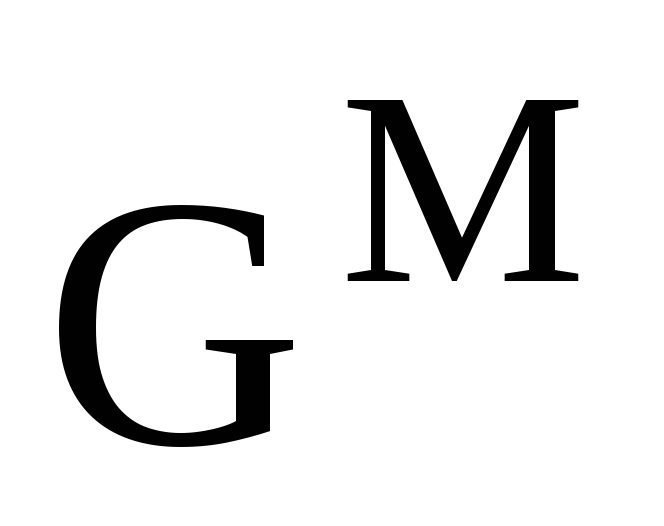 (
( с парциальными молярными энергиями
Гиббса смешения
с парциальными молярными энергиями
Гиббса смешения
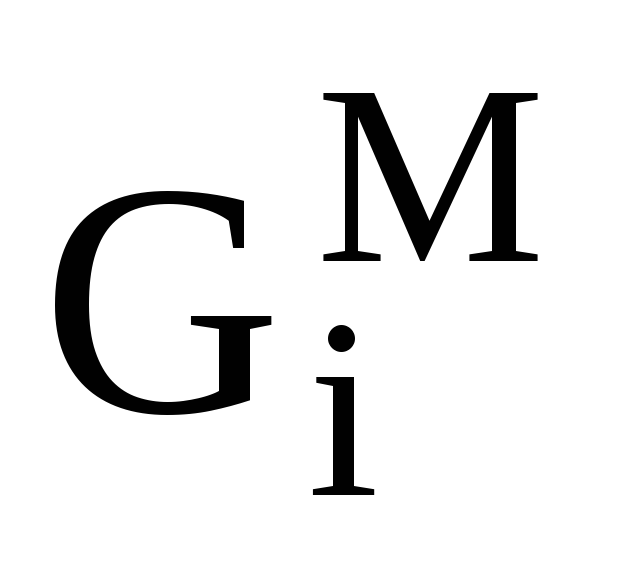 (
(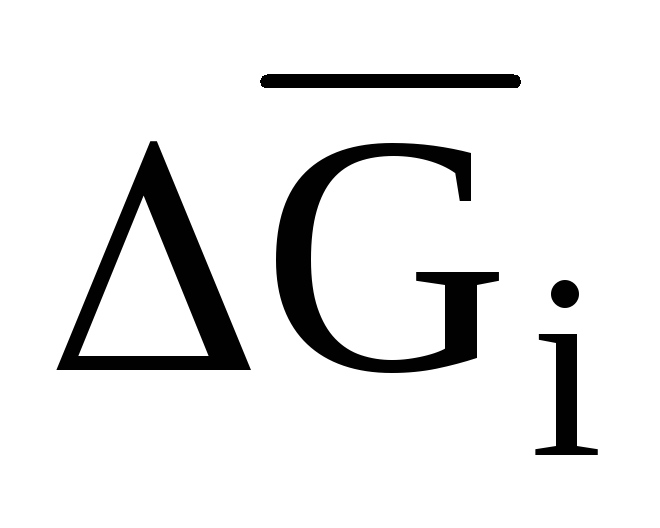 )
для бинарной системы.
)
для бинарной системы. -
Методы определения парциальных молярных величин (свойств) компонентов раствора. Определение парциальных молярных свойств методом касательных.
-
Термодинамические функции смешения при образовании растворов из чистых компонентов. Вывод уравнения, устанавливающего связь термодинамических функций смешения с относительными парциальными молярными свойствами компонентов раствора. Выражения для этих свойств в случае идеальных растворов.
-
Свойства идеальных (совершенных) растворов. Изменение термодинамических функций
 и
и
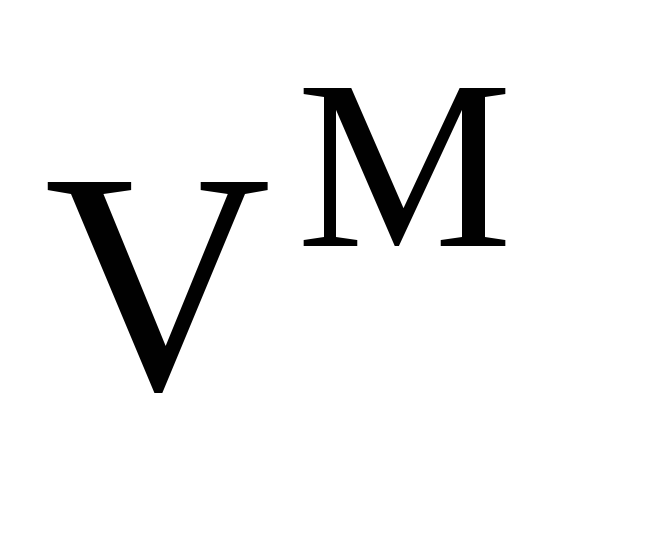
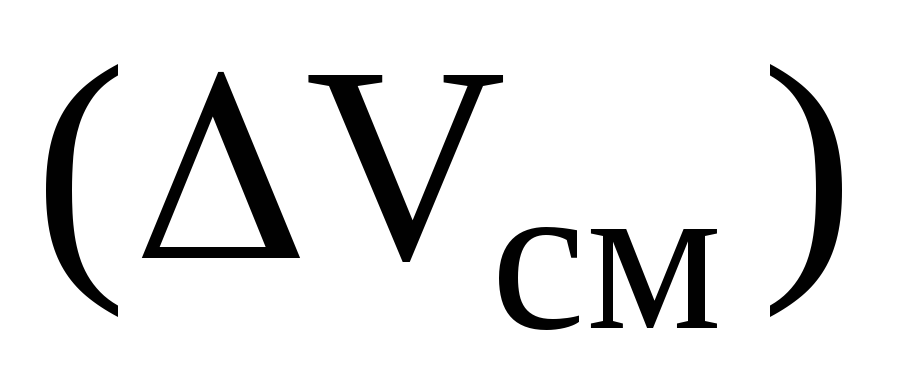 при образовании идеальных растворов
из чистых компонентов.
при образовании идеальных растворов
из чистых компонентов. -
Совершенные (идеальные) растворы. Связь энтропии смешения
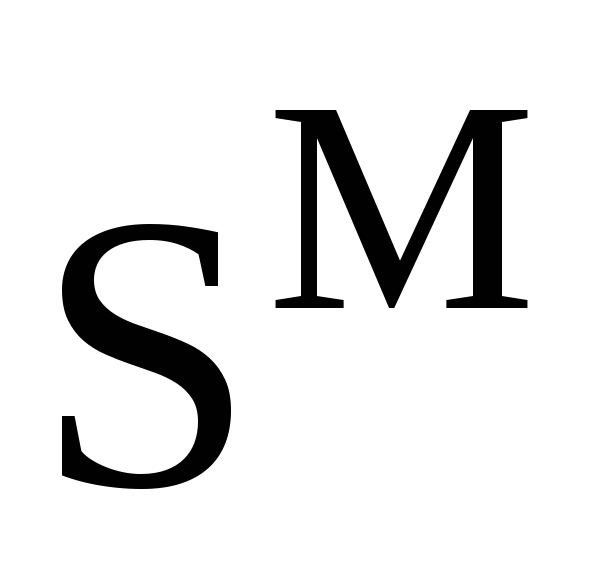
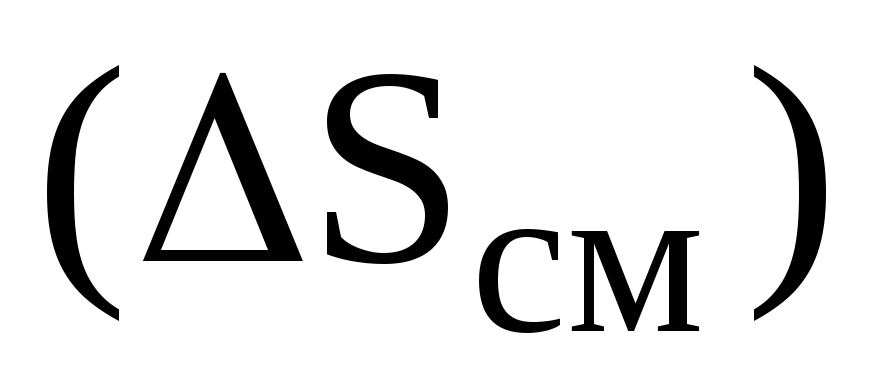 с концентрациями компонентов идеального
раствора. Вывод уравнения.
с концентрациями компонентов идеального
раствора. Вывод уравнения. -
Идеальные растворы. Зависимость давления насыщенного пара от состава раствора, закон Рауля. Термодинамическое обоснование закона Рауля.
-
Равновесие «идеальный раствор – пар». Закон Рауля, графическая интерпретация. Положительные и отрицательные отклонения от закона Рауля.
-
Дайте определение идеального раствора. Уравнения для расчета энергии Гиббса и энтальпии смешения при образовании идеальных растворов из чистых компонентов. Приведите примеры систем, представляющих практически идеальный раствор в жидкой фазе.
-
Неидеальные растворы. Активность и коэффициент активности компонента раствора. Термодинамические функции смешения при образовании неидеальных растворов из чистых компонентов.
-
Активность, коэффициент активности компонента раствора. Экспериментальное определение коэффициента активности компонента раствора по величине давления его насыщенного пара.
-
Активность и коэффициент активности компонента раствора. Выбор стандартного состояния. Симметричная и несимметричная системы сравнения. Методы определения активности.
-
Неидеальные растворы. Активность и коэффициент активности. Стандартные состояния компонентов раствора. Симметричная и несимметричная системы стандартных состояний.
-
Отклонения от закона Рауля. Химический потенциал, активность, коэффициент активности в разных системах стандартных состояний. Экспериментальные методы определения активности и коэффициента активности.
-
Взаимосвязь парциальных молярных величин компонентов бинарного раствора. Вывод и анализ 2-ого уравнения Гиббса-Дюгема.
-
Как на основании зависимости
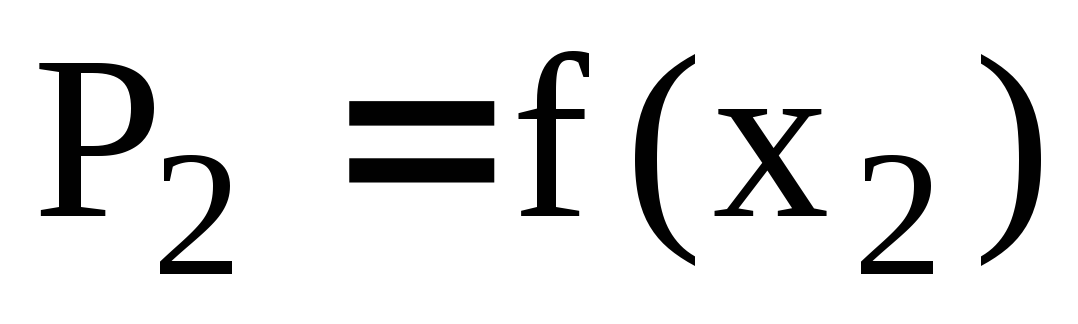 определить величину коэффициента
активности второго компонента
неидеального раствора при заданной
концентрации исходя из стандартного
состояния «чистый компонент». В случае
отрицательных отклонений от закона
Рауля величина
определить величину коэффициента
активности второго компонента
неидеального раствора при заданной
концентрации исходя из стандартного
состояния «чистый компонент». В случае
отрицательных отклонений от закона
Рауля величина
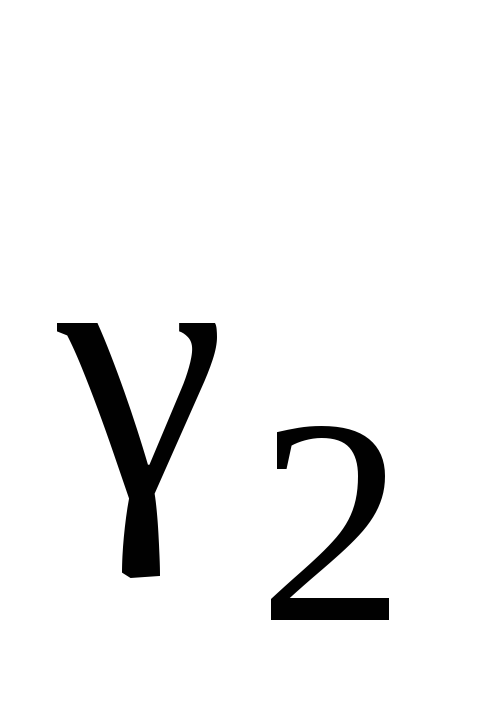 будет больше или меньше единицы? Можно
ли на основании полученного значения
будет больше или меньше единицы? Можно
ли на основании полученного значения
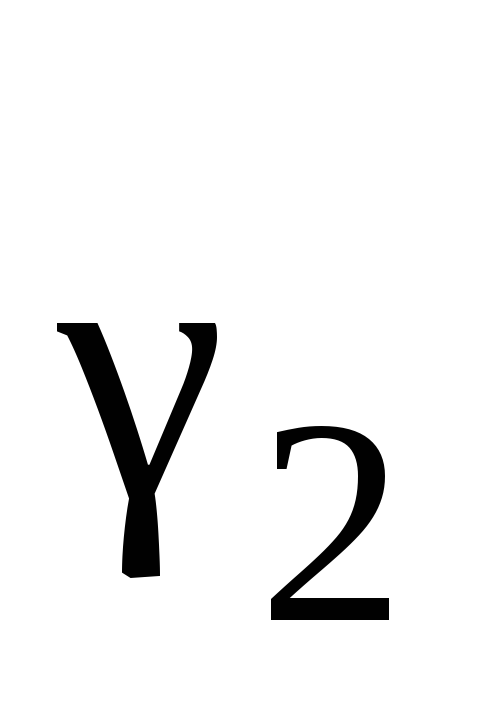 рассчитать коэффициент активности
второго компонента
рассчитать коэффициент активности
второго компонента
 ,
в соответствии со стандартным состоянием
«предельно разбавленный раствор»?
Ответ поясните.
,
в соответствии со стандартным состоянием
«предельно разбавленный раствор»?
Ответ поясните. -
Предельно разбавленные растворы летучих компонентов. Законы Рауля и Генри, их применимость для описания зависимости давления насыщенного пара от состава раствора. Уравнения для химического потенциала растворителя и растворенного вещества.
-
Разбавленные растворы нелетучих веществ в летучем растворителе. Закон Рауля. Следствия из закона Рауля: понижение температуры замерзания (отвердевания) и повышение температуры кипения раствора нелетучего вещества по сравнению с температурой замерзания (кипения) чистого растворителя (показать на р-Т-диаграмме Н2О).
-
Коллигативные свойства растворов нелетучих веществ в летучем растворителе. Взаимосвязь коллигативных свойств. Их использование для определения молярной массы растворенного вещества.
-
Криоскопия. Эбулиоскопия. Использование этих методов для определения молярной массы, степени диссоциации и ассоциации растворенного вещества.
-
Температура кипения растворов нелетучих веществ в летучих растворителях. Проиллюстрируйте с помощью диаграммы фазового равновесия. Эбуллиоскопический метод определения молярной массы растворенного вещества.
-
Приведите выражение для расчета эбулиоскопической постоянной. Каков смысл эбулиоскопической константы, какова ее размерность? Зависит ли величина эбулиоскопической постоянной от концентрации растворенного вещества? Будет ли соответствовать экспериментально измеренное повышение температуры кипения одномоляльного раствора
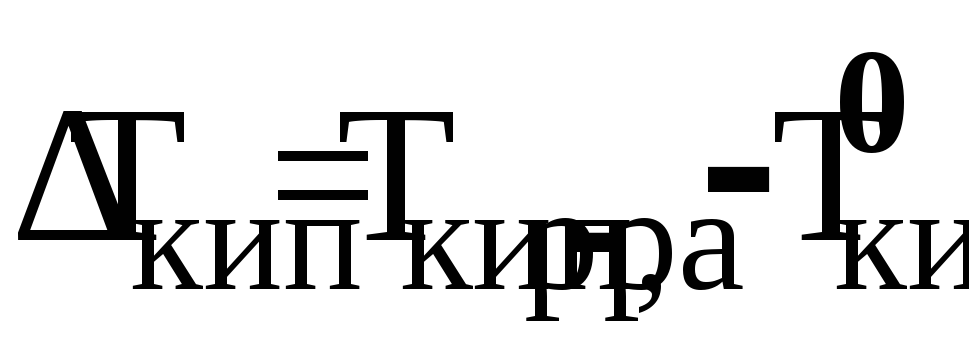 величине эбулиоскопической постоянной?
Дайте обоснованный ответ.
величине эбулиоскопической постоянной?
Дайте обоснованный ответ.
-
Имеются разбавленные водные растворы сульфата натрия и глицерина с одинаковыми моляльными концентрациями. Какой из этих растворов будет иметь более высокую температуру начала кипения при одинаковом внешнем давлении? Приведите объяснение.
-
Разбавленные растворы нелетучих веществ в летучем растворителе. Понижение и относительное понижение давления насыщенного пара раствора, зависимость этих характеристик от температуры. Поясните, как с помощью измерений давления насыщенного пара раствора и чистого растворителя определить молярную массу растворенного вещества?
-
Экспериментально определена величина понижения давления насыщенного пара над водным раствором нелетучего растворенного вещества
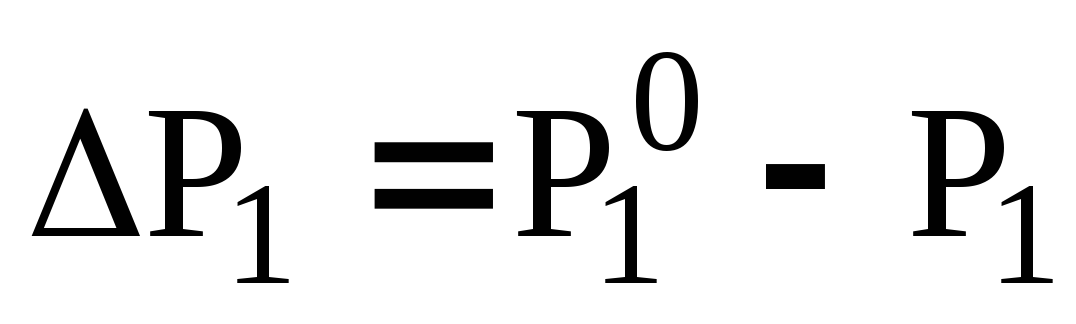 заданной массовой концентрации. Как
на основе этих данных найти его молярную
массу? Растворенное вещество –
неэлектролит.
заданной массовой концентрации. Как
на основе этих данных найти его молярную
массу? Растворенное вещество –
неэлектролит.
-
Зависимость понижения температуры замерзания (отвердевания) раствора нелетучего вещества в летучем растворителе от концентрации раствора. Криоскопическая постоянная и ее смысл. Связь криоскопической постоянной со свойствами растворителя.
-
Температура замерзания (отвердевания) разбавленных растворов нелетучих веществ. Криоскопическая постоянная. Определение молярной массы растворенного вещества криоскопическим методом.
-
Эбуллиоскопический метод определения молярной массы растворенного вещества. Какую поправку необходимо внести в расчетную формулу в случае, когда растворенное вещество присутствует в растворе в диссоциированной или ассоциированной форме?
-
Запишите выражение, используемое для определения молярной массы растворенного вещества криоскопическим методом, и назовите входящие в него величины. Почему результат расчета по этому уравнению иногда называют кажущейся молярной массой? В силу каких причин кажущаяся молярная масса не совпадает с истинной (формульной) молярной массой?
-
Осмос. Осмотическое давление. Использование измерений осмотического давления для определения молярной массы растворенного вещества.
-
Осмос, осмотическое давление, обратный осмос. Имеются два раствора одинаковой моляльной концентрации, в одном растворен электролит, в другом – неэлектролит. Различаются ли осмотические давления приведенных растворов? Дайте пояснения.
-
Явление самопроизвольного переноса растворителя через полупроницаемую мембрану (схема процесса). Осмос, осмотическое давление. Анализ уравнения, связывающего осмотическое давление с концентрацией раствора.
