
1361191805_archive / 330727-programma
.doc
Раздел 1. Химия s-элементов
Подгруппа лития
Общая характеристика элементов, нахождение в природе, получение и свойства, Гидриды, оксиды, пероксиды, надпероксиды, химическая связь в этих соединениях, их свойства. Гидроксиды, их получение и свойства. Общая характеристика солей. Понятие об аммиачном способе получения соды. Особенности химии лития. Применение металлов и их соединений.
Металлы главной подгруппы первой группы – литий, натрий, калий, рубидий, цезий и франций – называются щелочными металлами.
Щелочные металлы в силу повышенной активности встречаются в природе в виде хлоридов, алюмосиликатов, сульфатов и др. Наиболее распространены Na и К, встречающиеся в виде солей в морской воде, а также поваренной соли. Li, Cs, Rb содержатся в незначительных количествах в калиевых и литиевых минералах.
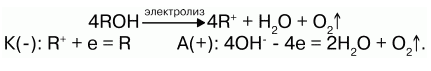
Получение щелочных металлов:
-
восстановлением из их оксидов:
![]()
2) электролизом расплава гидроксидов:
Физические свойства металлов подгруппы лития: невысокие температуры плавления и кипения, малая плотность, все металлы мягкие, легко режутся, кристаллизуются в объемной кристаллической решетке. Металлы серебристо-белые, только цезий золотисто-желтого цвета. Пары металлов имеют разную окраску: Li – кирпичный, Na – желтый, K – фиолетовый, Cs – голубой, Rb – красный. Некоторые сведения об этих элементах представлены ниже.
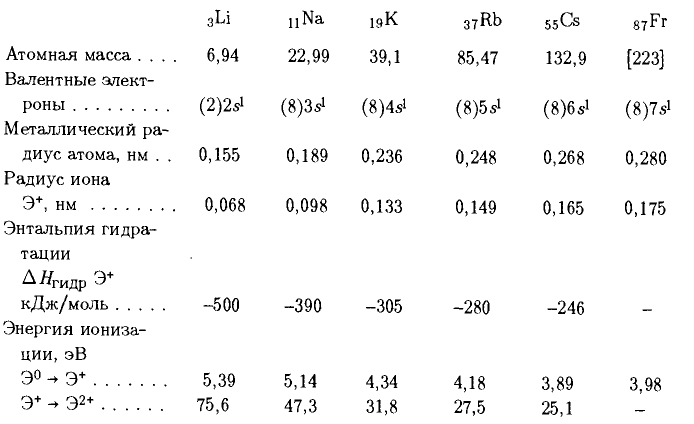
На внешнем энергетическом уровне атомов Li, Na, K, Rb, Cs, Fr на сравнительно большом удалении от ядра находится один электрон, который атомы щелочных металлов довольно легко отдают, превращаясь в однозарядные катионы; этим объясняется очень высокая химическая активность щелочных металлов. Увеличение радиусов атомов с увеличением порядкового номера элементов в главной подгруппе приводит к увеличению химической активности в ряду Li – Na – K – Rb – Cs – Fr. Связь между атомами в металле металлическая.
Все щелочные металлы энергично соединяются с кислородом; рубидий и
цезий самовоспламеняются на воздухе, калий, натрий и литий загораются при не
большом нагревании. При этом только литий образует оксид:
![]()
Натрий, взаимодействуя с кислородом, образует преимущественно пероксид, а калий, рубидий и цезий надпероксиды:
![]()
Восстановлением пероксидов и надпероксидов избытком щелочного метал
ла можно получить оксид:
![]()
Оксиды щелочных и щелочноземельных металлов взаимодействуют с водой с образованием гидроксидов
![]()
Пероксиды и надпероксиды полностью гидролизуются водой с образованием щёлочи:
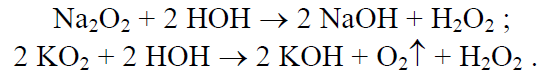
Легко отдавая в химических реакциях валентные электроны, щелочные ме
таллы являются самыми энергичными восстановителями. Их восстановительная
способность настолько велика, что они могут восстанавливать даже атомы водо-
рода, превращая их в отрицательно заряженные ионы H– и образуя при нагрева-
нии с водородом гидриды:
![]()
В ряду напряжений щелочные, щелочноземельные металлы, магний и бе-
риллий стоят далеко впереди водорода и способны восстанавливать водород из
воды:
![]()
Щелочные металлы вступают во взаимодействие почти со всеми неметаллами. Соединения характеризуются преобладающим наличием ионной связи:
Гидроксиды щелочных металлов. Растворы щелочей в воде мылкие на ощупь, они разъедают кожу, ткани, бумагу – едкие щелочи (едкий натр NaOH, едкий калий КОН). На коже они вызывают долго незаживающие раны. Очень гигроскопичны.
В ряду LiOH, NaOH, КОН, RbOH, CsOH сила и растворимость щелочей возрастает, что связано с увеличением размеров ионов щелочных металлов (катионов) и ослаблением электростатического притяжения с гидроксидной группой (анионом).
Химические свойства гидроксидов металлов подгруппы лития:
1) щелочи вступают в реакцию нейтрализации с кислотами, образуя соль и воду:
LiOH + H2SO4 = Li2SO4 + 2 H2O
2) взаимодействуют с кислотными оксидами, образуя как средние, так и кислые соли:
2NaOH + SiO2 = Na2SiO3 + H2O
3) вступают со средними солями в реакцию обмена:
CuSO4 + KOH = Cu(OH)2 + K2SO4,
с кислыми солями :
NaНSO4 + KOH = Na2SO4 + К2SO3 + H2O
4) растворы щелочей вступают в реакцию с амфотерными оксидами – образуются комплексные соли:
Al2O3 + NaOH + 7Н2О = 2Na[Al(ОН)4(Н2О)2];
5) при сплавлении твердых щелочей с оксидами амфотерных металлов образуются двойные безводные соли:
Al2O3 + 2NaOH = 2NaAlO2 (метаалюминат натрия);
6) взаимодействуют с галогенами в зависимости от температурных условий – на холоде:
Cl2 + 2NaOH = NaClO + NaCl + H2O,
при нагревании: 3Cl2 + 6NaOH = NaClO3 + 5NaCl + 3H2O;
7) взаимодействуют с некоторыми органическими веществами:
С2Н5ОН + NaOH = С2Н5ОNa + Н2О;
8) растворы и расплавы щелочей подвергаются электролизу
Способы получение гидроксидов металлов подгруппы лития:
1) реакция металлов с водой: 2К + 2H2O = 2KOH + H2;
2) реакция оксидов металлов с водой: 2К2О + 2H2O = 2KOH.
NaOH и KOH используют в производстве мыла, бумаги, в текстильной промышленности и др.
Соли металлов подгруппы лития имеют большое практическое значение.
Из солей наибольшее значение имеет хлорид натрия – NaCl – поваренная соль. Это необходимая составная часть пищи, консервант, сырье для химической промышленности. Из него получают гидроксид натрия, питьевую соду (NaHCO3), соду (Na2CO3) и многие другие соединения натрия. Многие соли натрия образуют кристаллогидраты. Na2S2O3*Н2О – тиосульфат натрия, соответствующий тиосерной кислоте Н2S2O3, применяется в фотографии, для фиксации проявленных бумаг. Na2SO4*10H2O – десятиводный сульфат натрия, глауберова соль, используется в сульфатном способе получения соды и в производстве стекла. Na2CO3*10H2O – карбонат натрия или кальцинированная сода применяется в стекольной, мыловаренной, целлюлозно-бумажной, текстильной, нефтяной, химической промышленностях, а также в быту. NaNO3 – нитрат натрия, натриевая или чилийская селитра – используется как минеральное удобрение. Соли калия – необходимые минеральные удобрения. Na2SiO3 – силикат натрия – используется в производстве стекла. Соли калия выделяются из раствора в основном без кристаллизационной воды. К2CO3 – карбонат калия или поташ – используется в производстве мыла, в производстве тугоплавкого стекла, в фотографии. КNO3 – карбонат калия или калиевая селитра – применяется при изготовлении черного пороха. КCl – хлорид калия – применяется в качестве удобрения. Многие соли калия встречаются в природе: КCl*MgCl*6Н2О – карналлит; КCl*NaCl – сильвинит. Соли К содержатся в квасцах.
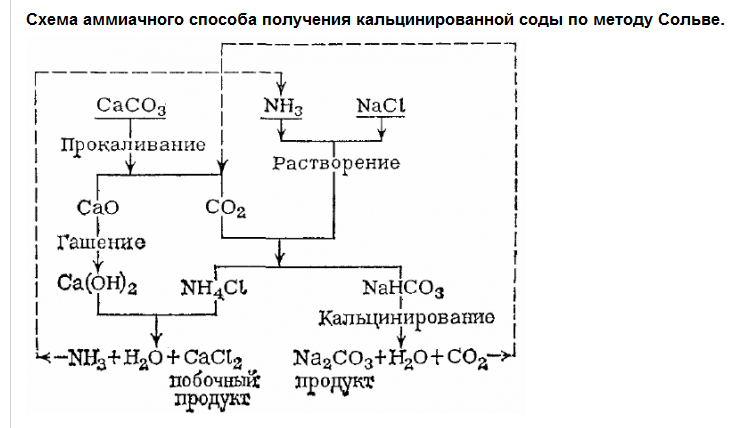
Аммиачный способ получения соды был предложен еще в 1838–1840 английскими инженерами-химиками Г.Грей-Дьюаром и Д.Хеммингом. Они пропускали через воду газообразные аммиак NH3 и диоксид углерода CO2, которые при взаимодействии дают раствор гидрокарбоната аммония NH4HCO3:
NH3 + CO2 + H2O = NH4HCO3,
а затем добавляли к этому раствору хлорид натрия NaCl, чтобы выделить малорастворимый на холоде гидрокарбонат натрия NaHCO3:
NH4HCO3 + NaCl = NaHCO3¯ + NH4Cl
Гидрокарбонат натрия отфильтровывали и нагреванием превращали в соду:
2 NaHCO3 = Na2CO3 + CO2 + H2O
Диоксид углерода CO2, необходимый для проведения процесса, получали из карбоната кальция СаСО3 – мела или известняка – при прокаливании:
CaCO3 = CaO + CO2 ,
а оксид кальция CaO, который при этом получался, после обработки водой давал гидроксид кальция Ca (OH)2 :
CaO + H2 O = Ca(OH)2,
необходимый для получения аммиака NH3 из хлорида аммония NH4Cl :
2 NH4Cl + Ca(OH)2 = 2 NH3 + CaCl2 + 2 H2O
Таким образом, аммиак все время находился в обращении и не расходовался, отходом производства оставался только хлорид кальция CaCl2.
Эрнест Сольве не внес принципиальных новшеств в химическую основу содового процесса английских инженеров, он только технологически оформил производство, однако, это тоже непросто. В частности, он применил здесь аппараты колонного типа, которые позволили вести процесс непрерывно и достичь высокого выхода продукта. Схема получения соды по методу Сольве представлена на рисунке.
Особенности химии лития. Как и прочие щелочные металлы, литий активен, мягок (режется ножом), всегда и во всех случаях проявляет строго постоянную валентность 1+. Литий является щелочным металлом, однако относительно устойчив на воздухе. Литий является наименее активным щелочным металлом, с сухим воздухом (и даже с сухим кислородом) при комнатной температуре практически не реагирует. По этой причине литий является единственным щелочным металлом, который не хранится в керосине (к тому же плотность лития столь мала, что он будет в нём плавать) и может непродолжительное время храниться на воздухе. Литий отличается он тем, что значительно легче остальных щелочных металлов, реагирует с азотом, углеродом, водородом; зато с водой он взаимодействует менее активно: хотя и вытесняет из нее водород, но не воспламеняет его. Не только фторид, но и карбонат, и ортофосфат лития плохо растворяются в воде – соответствующие соединения прочих щелочным металлов очень хорошо растворимы. И еще: литий – единственный щелочной металл, способный к образованию комплексных соединений.
Литиевые соли галогеноводородных кислот (кроме LiF) очень хорошо растворяются в воде. Но не это их главное достоинство. Растворы этих солей способны поглощать из воздуха аммиак, амины и другие примеси и, кроме того, при изменении температуры они обратимо поглощают пары воды. Это свойство позволило применить хлорид и бромид лития в установках для кондиционирования воздуха.
Известны сплавы лития с алюминием, бериллием, медью, цинком, серебром и другими элементами. Особенно широкие перспективы открываются перед сплавами лития с другим металлом-легковесом - магнием, обладающим к тому же ценными конструкционными свойствами: ведь такой сплав, если в нем содержится не более 50% магния, легче воды. Уже удалось выплавить некоторые сплавы подобного состава. К сожалению, они не устойчивы - легко окисляются на воздухе. Ученые работают сейчас над созданием композиции и технологии получения сплава, которые обеспечили бы ему долговечность. На выставках уже были представлены образцы литиймагниевого сплава, не тускнеющего от времени.
Высокая реакционная способность лития, низкая температура плавления, малая плотность его соединений делают элемент прекрасным дегазатором, раскислителем и модификатором в черной и цветной металлургии.
В производстве алюминия литий успешно выступает в роли ускорителя процесса. Добавка его соединений к электролиту увеличивает производительность алюминиевого электролизера. При этом снижается необходимая температура ванны, сокращается расход электроэнергии.
Прежде электролит щелочных аккумуляторов состоял только из растворов едкого натра. При введении в него нескольких граммов гидроокиси лития LiOH срок службы аккумулятора возрастает втрое. Кроме того, значительно расширяется температурный диапазон его действия: он не разряжается даже при повышении температуры до 40°С и не замерзает при двадцатиградусных морозах. Безлитиевому электролиту эти испытания не под силу. В настоящее время литиевые батареи получили широкое распространение. Запас энергии у этих батарей в 6-7 раз больше, чем у их цинковых «предшественниц».
Некоторые органические соединения лития (стеарат, пальмиат и др.) сохраняют свои физические свойства в широком интервале температур. Это позволяет использовать их как основу для смазочных материалов, применяемых в военной технике. Смазка, в состав которой входит литий, помогает вездеходам, работающим в Антарктиде, совершать рейды в глубь континента, где морозы порой достигают - 60°С. Литиевая смазка - надежный помощник автомобилистов.
Применение металлов и их соединений. Натрий используют в качестве исходного продукта при производстве перекиси натрия (моющее средство), а также амида натрия и натрийцианамида. Его используют также в больших количествах в органических синтезах (например, в красильном производстве). В осветительной технике его применяют в натриевых газоразрядных лампах.
Калий и прежде всего цезий применяют в фотоэлементах. Помимо этого, рубидий и цезий в свободном состоянии мало применяются. Металлический литий, напротив, приобрел большое техническое значение. Его используют во все возрастающих количествах в сплавах, так как небольшие добавки этого металла существенно улучшают свойства многих сплавов. Преимущественно литий (и наряду с натрием и кальцием) применяют для свинцово-подшипниковых сплавов и при производстве склерона. Кроме того, он служит в качестве раскисляющего средства для меди и при рафинировании содержащего никеля.
Перекись натрия в больших количествах используется при производстве моющих средств. В лаборатории ее применяют как энергичный окислитель в водном растворе и в расплаве. Гидроксиды калия и натрия в технике и в лаборатории часто применяют в качестве сильных оснований.
Вследствие небольшой гигроскопичности оксида и гидроксида лития, их используют для приготовления фотографических проявителей в виде порошков.
