
- •Химическая связь и межмолекулярное взаимодействие
- •Пространственное расположение локализованных на связях С-Н орбиталей молекулы метана
- •Тип гибридизации АО диктуется:
- •Модель отталкивания электронных пар Гиллеспи
- •Лапласиан электронной плотности в молекулах BF3, CF4, SF6 и модель
- •Химическая связь в координационных соединениях переходных элементов
- •Расщепление d-уровней ЦА в полях различной симметрии
- •Спектрохимический ряд. Величина 10Dq для различных ЦА постоянна и возрастает в следующем ряду
- •Октаэдрическое поле лигандов:
- •Основные координационные полиэдры в комплексных соединениях переходных металлов с КЧ ЦА 2-8
- •Распределение электронов в октаэдрических комплексах для слабого и сильного поля лигандов
- •ЭСКП для комплексов центральных ионов с различными электронными конфигурациями (в единицах Dq) в
- •Теория поля лигандов
- •Полный базис валентных АО состоит из 15 орбиталей: 9 - металла, 6 -
- •Вывод: в октаэдрическом имеется шесть связывающих валентных МО (a1g, tu1, 1eg) и три
- •Системы, где волновая функция вырождена (например, октаэдрические и плоские комплексы d-элементов), структурно неустойчивы:
- •Основное электронное состояние дважды вырождено (2Eg) и эффект Яна-Теллера
- •Валентные орбитали ЦА и групповые орбитали лигандов октаэдрическом комплексе ML6 (связывающие комбинации)
- •В.Г. Цирельсон «Химическая связь и межмолекулярные взаимодействия».

Химическая связь и межмолекулярное взаимодействие
Анализ химической связи в многоатомных молекулах
Локализация и гибридизация орбиталей Локализованные молекулярные орбитали (ЛМО) – МО, построенные из
канонических МО j с помощью ортогонального преобразования i = Аij j,
при условии, что для каждой пары электронов i и j:i2 (1/4 0rij) j2 = min
Молекула метана СН4 (минимальный базис канонических МО) :
|
|
1= a(C2s) + b(1sH1+1s H2+1s H3+1s H4) |
|
|
2= a(C2px)+ b (1sH1+1sH2-1sH3-1sH4) |
|
3= a(C2py)+ b (1sH1-1sH2+1sH3-1sH4) |
|
|
|
4= a(C2pz)+ b (1sH1-1sH2-1sH3+1sH4) |
Локализованные на связях С-Н двухцентровые МО : |
|
1=(а/2)[ C2s+ C2px+ C2py+ C2pz]+ b1sH1 |
|
2=(а/2)[ C2s+ C2px - C2py - C2pz]+ b1sH1 |
|
3=(а/2)[ C2s - C2px + C2py- C2pz]+ b1sH1 |
1 |
=(а/2)[ C2s - C2p - C2p + C2p ]+ b1sH . |
|
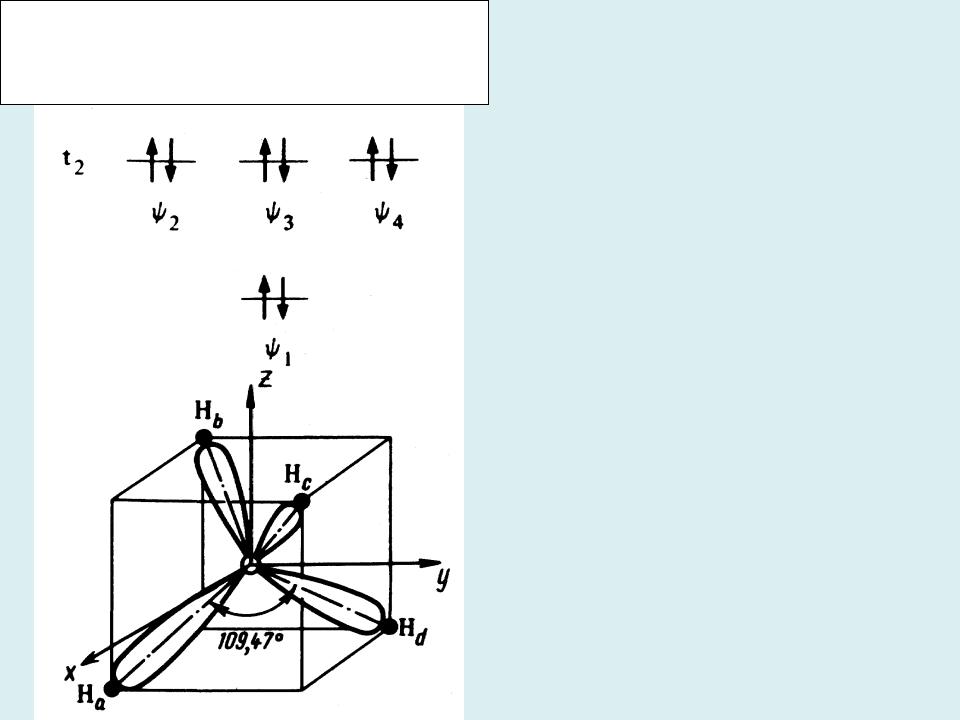
Пространственное расположение локализованных на связях С-Н орбиталей молекулы метана
Гибридные орбитали –линейные комбинации валентных АО. Молекула СН4: sp3-гибридные АО атома С, эквивалентны и направлены вдоль связей С-Н (а=1):
hа1=(1/2)[ C2s+ C2px+ C2py+ C2pz]
hа2=(1/2)[ C2s+ C2px - C2py - C2pz]
hа3=(1/2)[ C2s - C2px + C2py- C2pz]
2

Тип гибридизации АО диктуется:
1) геометрией молекулы; 2) принципом максимального перекрывания АО.
Конфигурация некоторых связей ЦА в зависимости от числа электронных
3

4

Модель отталкивания электронных пар Гиллеспи
приложима только к соединениям непереходных элементов. Основные идеи:
1.Конфигурация связей многовалентных атомов определяется числом электронных пар на связывающих и несвязывающих МО их валентных оболочек; 2.Ориентация облаков плотности электронных пар, описываемых
валентными орбиталями, определяется их максимальным взаимным отталкиванием.
Правила для модели Гиллеспи:
а) Неподеленная электронная пара занимает больший объем, чем связывающая пара ординарной связи.
б) Сила отталкивания электронных пар в данной валентной оболочке понижается в следующем порядке: Е-Е, Е-Х, Х-Х (Е - неподеленная электронная пара, Х - связывающая электронная пара).
в) В координационных соединениях объем связывающей электронной пары уменьшается с увеличением электроотрицательности лиганда.
г) Электронные пары двойной или тройной связей занимают больший
объем, чем электронная пара ординарной связи.
5
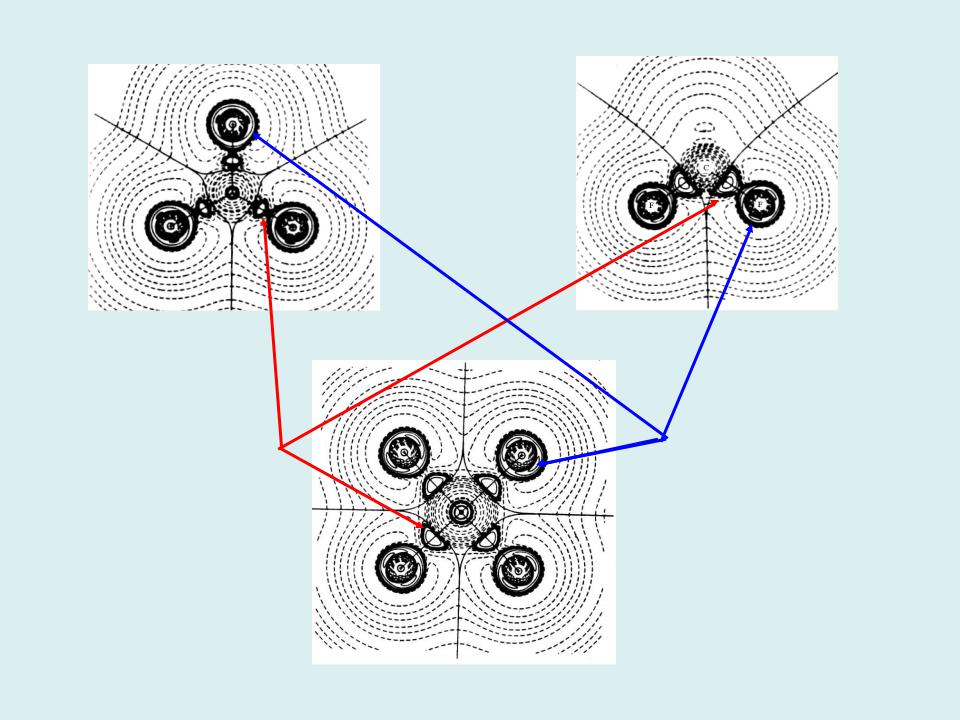
Лапласиан электронной плотности в молекулах BF3, CF4, SF6 и модель
Гиллеспи
|
BF3 |
|
CF4 |
|
Связывающие |
|
Неподеленные |
|
|
электронные пары |
|
электронные пары |
|
||
|
|
||
|
|
|
|
SF6 |
6 |
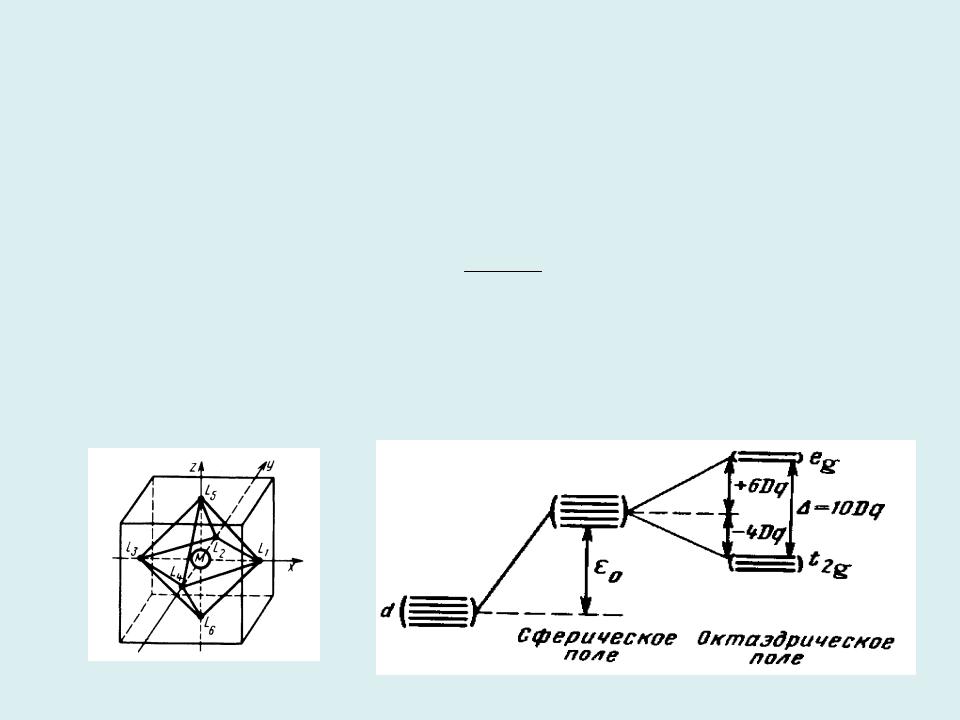
Химическая связь в координационных соединениях переходных элементов
Координационные соединения характеризуются наличием центрального комплексообразующего атома и окружающих его групп атомов (лигандов).
Координационное число - число лигандов окружающих центральный атом.
Теория кристаллического поля (ТКП)
– простейшая модель химической связи в координационных соединениях 1) электронная конфигурация центральногоZ q атома a рассматривается
явно; V i 4π a 0 riai
2) лиганды (точечные ионы) создают электростатическое поле, приводящее к возмущению АО ЦА:
,
rai – расстояние от ядра центрального атома а до лиганда i.
|
|
лигандов |
|
3+, |
V4+) |
расщеплением |
2g |
||
(dxy-, d |
|
|
|
|
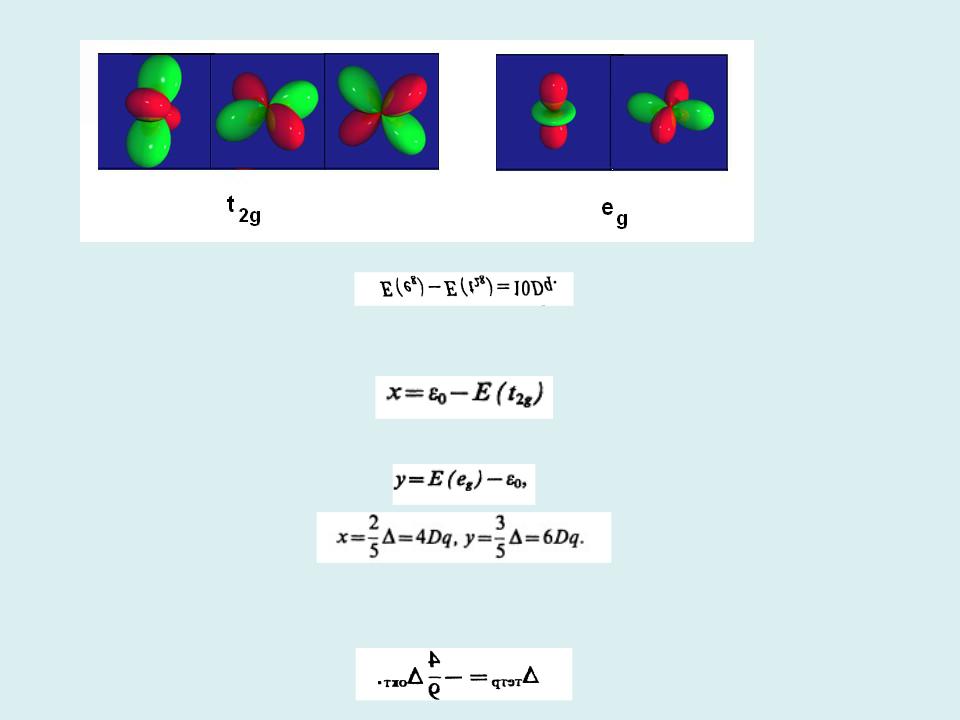
eg и t2g 3d –АО:
= 10Dq - эмпирический параметр расщепления энергетических уровней:
Воктаэдрическом комплексе энергия t2g АО ниже энергии еg АО. Энергия стабилизации уровней :
энергия дестабилизации уровней :
Тетраэдрическое поле лигандов: d-уровень ЦА тоже расщепляется на eg и t2g уровни, но теперь e-уровень энергетически более выгоден
8
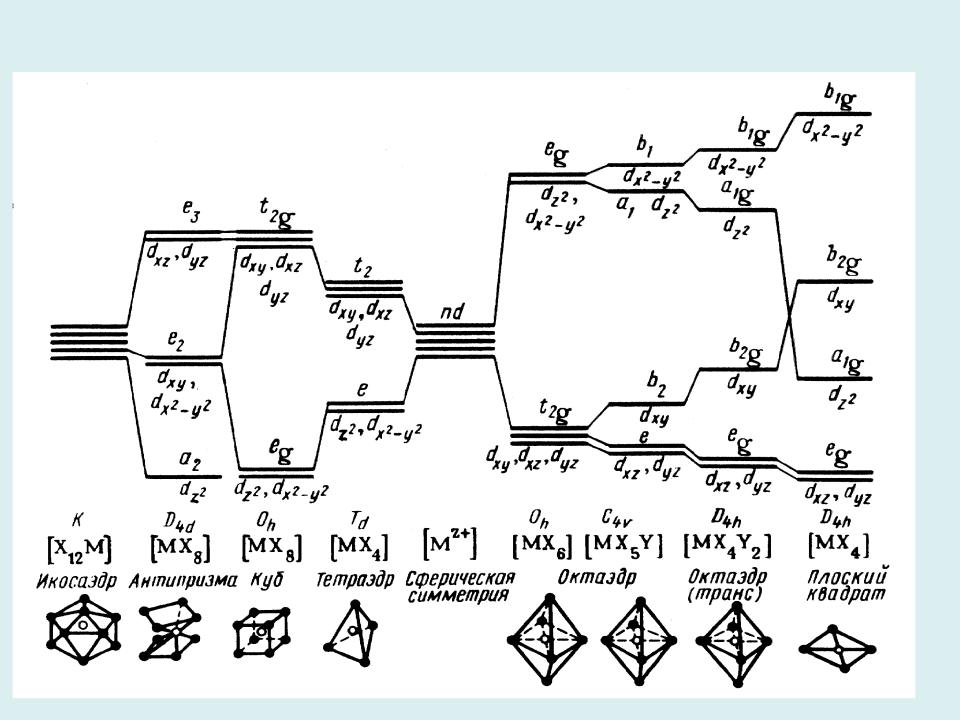
Расщепление d-уровней ЦА в полях различной симметрии

Спектрохимический ряд. Величина 10Dq для различных ЦА постоянна и возрастает в следующем ряду лигандов:
Ру - пиридин; En - этилендиамин.
Комплексы сильного и слабого полей лигандов Оптимальная электронная конфигурация комплекса зависит от величины
электростатического поля лигандов и определяется двумя тенденциями:
1)стремлением электронов образовать полностью заполненную оболочку;
2)тенденцией к образованию электронной конфигурации с максимальной мультиплетностью
Численно величина поля лигандов характеризуется значением параметра 10Dq. Сильное поле лигандов - высокое значение 10Dq образование низкоспиновых
комплексов (энергией электрон-электронного отталкивания можно пренебречь). Слабое поле лигандов - низкое значение 10Dq образование высокоспиновых
комплексов (энергия электрон-электронного отталкивания велика).
10
