
Рапечатки с сайта / 3_tabl
.pdf
Таблица 2. Характеристики основного состояния гомоядерных молекул
Моле- |
Кратность |
De, |
Re, |
кула |
связи Р |
эВ |
Å |
|
|
|
|
Н+ |
1/2 |
2.8 |
1.06 |
|
|||
|
|
|
|
Н2 |
1 |
4.75 |
0.74 |
|
|
|
|
Не2+ |
1/2 |
3.0 |
1.08 |
Не2 |
0 |
— |
— |
Li2 |
1 |
1.13 |
2.67 |
Ве2 |
0 |
— |
— |
Моле- |
Кратность |
De, |
Re, |
кула |
связи Р |
эВ |
Å |
|
|
|
|
С2 |
2 |
6.4 |
1.24 |
|
|
|
|
N2+ |
2 1/2 |
8.9 |
1.12 |
N2 |
3 |
9.9 |
1.10 |
О2+ |
2 1/2 |
6.6 |
1.12 |
О2 |
2 |
5.2 |
1.21 |
F2 |
1 |
1.4 |
1.42 |
В2 |
1 |
3.0 |
1.59 |
Ne2 |
0 |
- |
- |
|
|
|
|
|
|
|
|
Таблица 3. Электронные конфигурации и характеристики связи некоторых
гетероядерных молекул
Моле- |
Валентная электронная |
Длина |
Кратность |
De*, |
|||||||||||
кула |
|
конфигурация |
|
cвязи, |
связи |
эВ |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Å |
|
|
|
|
|
|
|
|
|
|
|
|
||||||
LiH |
|
|
(2sLi1sH)2 |
|
|
|
1,595 |
1 |
1,5 |
||||||
HF |
(2sF)2(2pyF)2(2pzF)2(σsН-2pxF)2 |
0,917 |
1 |
4,4 |
|||||||||||
|
|
|
|
|
|||||||||||
LiF |
(1sLi)2(1sF)2(2sF)2(2pF)2(2pF)2(σsLi-pxF)2 |
1,564 |
1 |
4,1 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CN |
|
π |
2 |
π |
|
|
2 |
( |
σ |
2рx) |
1 |
1,172 |
2,5 |
8,2 |
|
|
|
( 2рy) |
( 2рz) |
|
|
|
|
|
|||||||
CO |
|
π |
2 |
π |
|
|
2 |
( |
σ |
2рx) |
2 |
1,128 |
3 |
11,1 |
|
|
|
( 2рy) |
( 2рz) |
|
|
|
|
|
|||||||
NO |
π |
2 |
π |
2 |
( |
σ |
|
|
|
2 |
π |
|
1,151 |
2,5 |
7,0 |
|
( 2рy) |
( 2рz) |
|
2рx) |
( *2р) |
|
|
|
|||||||
Заряды на атомах в топологической теории определяются интегрированием Э в пределах бассейнов.
Пример: Заряды на атомах в молекуле Н2О, вычисленные разными способами и в разных базисах
Метод/ Базис |
Малликен |
Левдин |
Бейдер |
|
|
|
|
|
|
HF/STO-3G |
O |
-0.366 |
-0.253 |
-0.821 |
|
|
|
|
|
|
H |
0.183 |
0.127 |
0.411 |
|
|
|
|
|
|
|
HF/4-31G |
O |
-0.785 |
-0.569 |
-0.998 |
|
|
|
|
|
||
H |
0.393 |
0.284 |
0.499 |
||
|
|||||
|
|
|
|
|
|
HF/6-31G** |
O |
-0.674 |
-0.454 |
-1.226 |
|
|
|
|
|
||
H |
0.337 |
0.227 |
0.613 |
||
|
|||||
|
|
|
|
|
|
MP2/6-31G** |
O |
-0.647 |
-0.438 |
-1.162 |
|
|
|
|
|
||
H |
0.323 |
0.219 |
0.581 |
||
|
|||||
|
|
|
|
|
Вывод: величины атомных зарядов зависят от способа их определения
Таблица 5 Топологические характеристики связей в критических точках (3, -1) для молекул этана, этилена и ацетилена
Связь |
Re, Å |
ρ, э·Å-3 |
2ρ, э·Å-5 |
λ1, э·Å-5 |
λ2, э·Å- |
λ3, э·Å- |
ε |
|
|
|
|
|
|
|
|
С-С |
1.530 |
1.52 |
-9.94 |
-9.11 |
-9.11 |
8.28 |
0.00 |
|
|
|
|
|
|
|
|
С=С |
1.322 |
2.25 |
-22.30 |
-16.12 |
-13.23 |
7.04 |
0.22 |
|
|
|
|
|
|
|
|
≡ |
1.194 |
2.69 |
-30.46 |
-15.46 |
-15.46 |
0.46 |
0.00 |
C C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
С-Н (С2Н6) |
0.960 |
1.55 |
-8.78 |
-13.01 |
-13.01 |
16.24 |
0.00 |
С-Н (С2Н4) |
1.071 |
1.40 |
-5.47 |
-13.22 |
-5.24 |
12.99 |
1.52 |
С-Н (С2Н2) |
1.043 |
1.42 |
-7.12 |
-10.26 |
-10.24 |
13.38 |
0.00 |
|
|
|
|
|
|
|
|
Таблица 6. Характеристики атомных взаимодействий в терминах свойств электронной плотности и плотности кинетической энергии в критической точке связи

|
Характеристики ЭП в критической точке гb |
|
Характеристики |
|||||||
|
|
кинетической энергии (а.е.) |
||||||||
|
|
|
|
|
|
|
||||
|
ρ(rb) |
2ρ(rb) |
λ1 |
λ2 |
λ3 |
λ1/λ3 |
g (rb)/g (rb) |
g(rb)/ ρ(rb) |
|
|
|
|
|
|
|
|
|
|
|
|
|
ствия ковалентного типа |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
0.2728 |
-1.3784 |
-0.9917 |
-0.9917 |
0.6049 |
1.64 |
- |
0.06 |
|
|
|
0.1250 |
-0.1983 |
-0.0998 |
-0.0998 |
0.0014 |
71.3 |
4.65 |
0.40 |
|
|
|
0.7219 |
-3.0500 |
-1.9337 |
-1.9337 |
0.8175 |
2.37 |
17.89 |
0.87 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0.5933 |
-2.0353 |
-1.6460 |
-1.6460 |
1.2568 |
1.31 |
5.11 |
0.88 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0.5513 |
-1.0127 |
-1.4730 |
-1.4730 |
1.9333 |
0.76 |
2.85 |
0.88 |
|
|
|
|
|
|
|
|
|
|
|
|
|
ствия по типу замкнутых оболочек |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
0.0367 |
0.2501 |
-0.0774 |
-0.0774 |
0.4049 |
0.19 |
0.000 |
1.47 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0.0543 |
0.4655 |
-0.0897 |
-0.0897 |
0.6449 |
0.14 |
0.090 |
1.94 |
|
|
|
|
|
|
|
|
|
|
|
|
|
я |
0.0198 |
0.0623 |
-0.0247 |
-0.0240 |
0.1110 |
0.223 |
0.415 |
0.81 |
|
|
)2 |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
Таблица 7. Топологические и энергетические характеристики ковалентных связей в терминах локальных свойств электронной плотности и плотности и
энергии |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
g (rb) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
молекула |
связь |
ρ(rb) |
2ρ(rb) |
|
|
v (rb) |
he(rb) |
||
|
|
э·Å-3 |
э·Å-3 |
|
|
а. |
е. |
а.е. |
|
|
|
|
|
|
|
|
|
|
|
LiH |
Li—H |
0.274 |
3.786 |
|
0.041 |
|
-0.043 |
-0.002 |
|
|
|
|
|
|
|
|
|
|
|
ВеН2 |
Ве—Н |
0.604 |
4.138 |
|
0.606 |
|
|
-0.890 |
-0.284 |
СН4 |
С—Н |
1.870 |
-23.579 |
|
0.039 |
|
|
-0.245 |
-0.206 |
H2О |
О—Н |
2.639 |
-58.842 |
|
0.082 |
|
|
-0.528 |
-0.446 |
HF |
Н—F |
2.729 |
-92.607 |
|
0.099 |
|
|
-0.862 |
-0.763 |
F2 |
F—F |
2.606 |
-0.045 |
|
0.353 |
|
|
-0.717 |
-0.364 |
|
|
|
|
|
|
|
|
|
|
СО |
≡ |
3.421 |
23.608 |
|
1.159 |
|
|
-2.074 |
-0.915 |
|
С O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 8. Гибридные орбитали для разных случаев строения молекул
Гибридная |
Форма молекулы |
Пример |
орбиталь |
|
|
|
|
|
sp |
Линейная |
ВеН2 |
sp2 |
Плоская тригональная |
BCl3 |
sp3 |
Тетраэдрическая |
CH4 |
dsp2 |
Плоский квадрат |
K2PtCl4 |
d2sp3 |
Октаэдрическая |
SF6 |
dsp3 |
Тригональная бипирамида |
PCl5 |
d4sp3 |
Додекаэдр |
K4Mo(CN)8 |
|
|
|
Таблица 9. Конфигурация связей центрального атома А в зависимости от числа
электронных пар q на его валентных орбиталях
q |
Конфигурация |
q |
Конфигурация |
|
|
|
|
|
|
2 |
Линейная или уголковая |
8 |
Квадратная антипризма |
|
|
|
|
|
|
3 |
Равносторонний треугольник |
9 |
Треугольная призма с тремя |
|
4 |
Тетраэдр |
|
дополнительными вершинами |
|
|
|
|
|
|
5 |
Тригональная бипирамида, |
10 |
Квадратная антипризма с двумя |
|
|
квадратная пирамида |
|
дополнительными вершинами |
|
|
|
|
|
|
6 |
Октаэдр |
|
|
|
|
|
|
|
|
|
Октаэдр с дополнительной |
11 |
Икосаэдр без одной вершин |
|
7 |
вершиной; |
|||
|
|
|||
|
Пентагональная бипирамида |
|
|
|
|
|
|
|

Тригональная призма с |
|
дополнительной вершиной |
12 Икосаэдр |
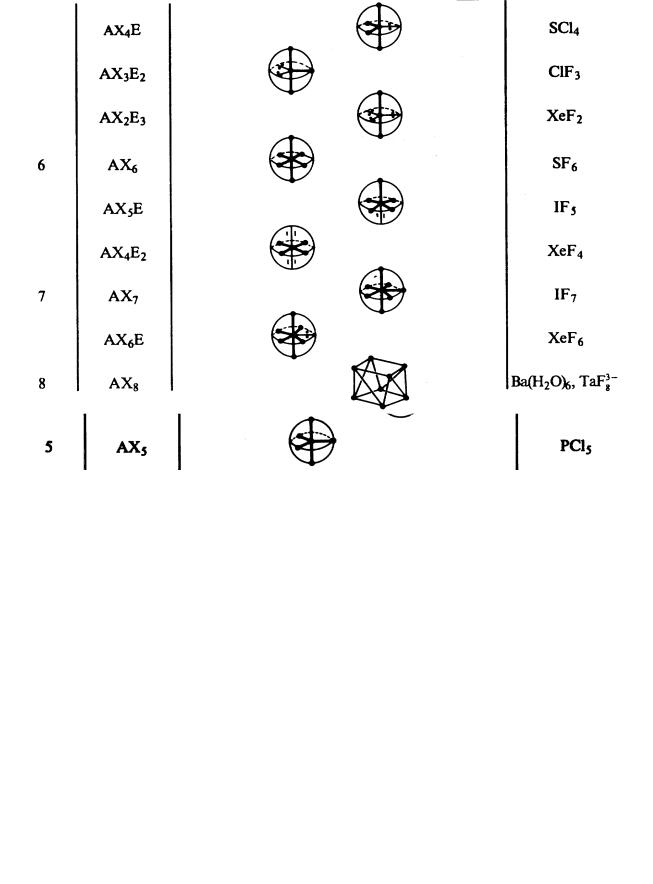
Таблица 11. Гибридные орбитали для разных случаев строения молекул
Гибридная |
Форма молекулы |
|
|
Пример |
|
|||
орбиталь |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
sp |
|
Линейная |
|
|
|
ВеН2 |
|
|
sp2 |
|
Плоская тригональная |
|
|
BCl3 |
|
|
|
|
|
(равносторонний треугольник) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
sp3 |
|
Тетраэдрическая |
|
CH4, CF4 |
|
||
|
dsp2 |
|
Плоский квадрат |
|
K2PtCl4 |
|
||
|
d2sp3 |
Октаэдрическая |
|
|
SF6 |
|
||
|
dsp3 |
|
Тригональная бипирамида |
|
|
PCl5 |
|
|
|
|
|
|
|
|
|
|
|
|
d4sp3 |
Додекаэдр |
|
|
K4Mo(CN)8 |
|
||
|
|
|
|
|
|
|
Таблица 12. |
|
|
Основные типы полиэдров в координационных соединениях |
|||||||
|
|
переходных металлов с КЧ центрального атома от 2 до 8 |
||||||
|
|
|
|
|
||||
|
КЧ |
Конфигурация связей |
Тип гибридизации |
Пример молекулы |
||||
|
|
|
|
|
|
|||
|
2 |
Линейная |
sp, dp |
|
[Ag(NH3)2]+; |
|||
|
|
Угловая |
ds |
|
|
|
||
|
3 |
Треугольная |
sp2, ds2. dp2 |
|
Fe[N(SiMe3)2]3; |
|||
|
|
Пирамидальная |
d2p |
|
Мо(СО)з |
|||
|
4 |
Тетраэдрическая |
sp3, d3s |
|
Ni(CO)4; |
|||
|
|
Плоская |
dsp2 |
|
[Ni(CN)4]2- |
|||
|
5 |
Тригональная |
dz2sp3, d3sp |
|
Fe(CO)5 |
|||
|
бипирамида |
|
||||||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|||
|
|
Квадратная пирамида |
dx2-y2sp3, d3sp, d4s |
|
[MnCI5]2- |
|||
6 |
Октаэдрическая |
d2sp3 |
Cг(CO)6; |
|
Тригональная призма |
d4sp, d5p, d3p3 |
Re[(Ph2C2S2)]3 |
|
Пентагональная |
d3sp3 |
[Mo(CN)7]5-; |
|
бипирамида |
[UO2F5]3- |
|
|
|
||
|
|
|
|
7 |
Одношапочный октаэдр |
d5sp, d4sp2 |
Mo[(CN(трет- |
8 |
Додекаэдр |
d4sp3 |
[Mo(CN)8]4- |
|
Квадратная антипризма |
d5p3 |
[TaF8]3- |
Таблица 13 Представления симметрии для d-орбиталей при различных случаях симметрии
Координа |
|
|
|
d-АО и их |
|
|
|||
|
Точечная |
симметрийные обозначения |
|||||||
ционное |
Конфигурация |
||||||||
симметрия |
|
|
|
|
|
|
|||
число |
|
dz2 |
dx2-y2 |
dxy |
|
dxz |
dyz |
||
|
|
|
|
|
|
|
|
|
|
4 |
Тетраэдр |
Td |
е |
е |
t2 |
|
t2 |
t2 |
|
|
|
|
|
|
|
|
|
|
|
4 |
Квадрат |
D4h |
a1g |
b1g |
b2g |
|
e |
e |
|
|
|
|
|
|
|
|
|
|
|
5 |
Квадратная |
С4V |
a1 |
b1 |
b2 |
|
е |
е |
|
пирамида |
|
||||||||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
5 |
Тригональная |
D3h |
a1 |
е' |
е' |
|
е" |
е" |
|
|
бипирамида |
|
|||||||
|
|
|
|
|
|
|
|
||
6 |
Октаэдр |
Oh |
eg |
eg |
t2g |
|
t2g |
t2g |
|
|
|
|
|
|
|
|
|
|
|
Таблица 14. Распределение электронов в октаэдрических комплексах для слабого и сильного поля лигандов,
рассчитанные экспериментальные значения магнитных моментов комплексов.
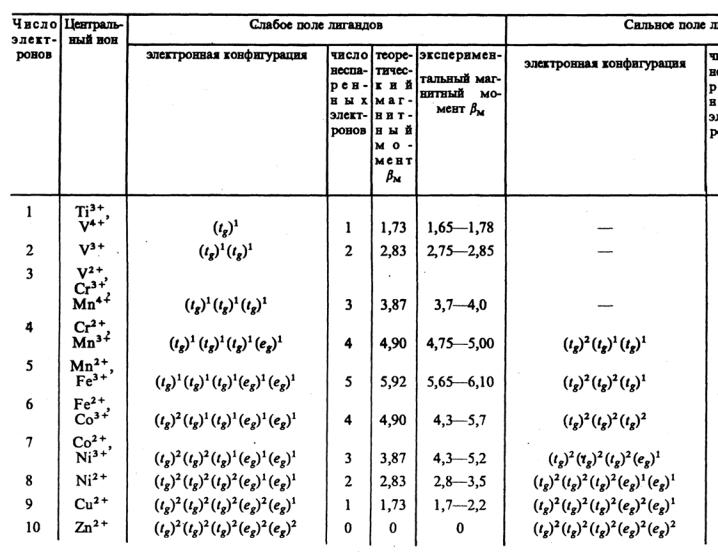
Таблица 15. ЭСКП для комплексов центральных ионов с различными электронными конфигурациями (в единицах Dq) в различных полях лнгаидов
