
Семестр 1 / 311_О-2Б12_Бочкарев В.Д
..docxМинистерство образования и науки Российской Федерации
Федеральное государственное автономное образовательное учреждение высшего образования
«Национальный исследовательский Томский политехнический Университет»

Центр цифровых
образовательных технологий
«Нефтегазовое дело»
Индивидуальное домашнее задание
№3
Вариант – 311
по дисциплине:
Химия 1.6
Исполнитель:
|
|
||||
студент группы |
О-2Б12 |
|
Бочкарев Вячеслав Дмитриевич |
|
30.12.2021 |
|
|
|
|
|
|
Руководитель:
|
|
||||
преподаватель |
|
|
Вайтулевич Елена Анатольевна, |
|
|
|
|
|
|
|
|
Томск - 2021
Практическое задание 3. Закономерности протекания химических процессов.
Вычислите DH
 ,
DS
и DG
реакции, протекающей по уравнению:
,
DS
и DG
реакции, протекающей по уравнению:
Fе2O3(к) + 3H2 = 2Fe(к) + 3H2O(г).
Запишите закон действующих масс. Возможна ли реакция восстановления Fe2O3 водородом при температурах 500 и 2000 K?
Константа равновесия реакции АВ(г)
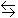 А(г)
+ В(г) равна 0,04, а равновесная концентрация
В составляет 0,02 моль/л. Найдите исходную
концентрацию АВ. Сколько процентов
вещества АВ разложилось? Как изменится
состояние равновесия, если: а) увеличить
давление, б) понизить температуру
(H0х.р.
<0) , в) ввести в систему поглотитель
вещества В?
А(г)
+ В(г) равна 0,04, а равновесная концентрация
В составляет 0,02 моль/л. Найдите исходную
концентрацию АВ. Сколько процентов
вещества АВ разложилось? Как изменится
состояние равновесия, если: а) увеличить
давление, б) понизить температуру
(H0х.р.
<0) , в) ввести в систему поглотитель
вещества В?
Скорость реакции 2NO + Cl2 = 2NOCl в трех опытах имела следующие значения:
P (NO) 10-5 Па |
0,5 |
1,0 |
0,5 |
P (Cl2) 10-5 Па |
0,5 |
1,0 |
1,0 |
V10-5, Па c-1 |
5 |
40 |
10 |
Может ли быть эта реакция простой (элементарной)? Выведите кинетическое уравнение скорости, определите константу скорости, порядки реакции в целом и по обоим компонентам.
Как влияет температура на скорость реакций? Температурный коэффициент некоторой реакции равен 3. Как изменится скорость этой реакции при повышении температуры от 80 °С до 130 °С?
Таблица 1
Термодинамические константы некоторых веществ
Вещество |
DНof,298кДж/ моль |
So298, Дж/ моль.K |
DGof,298 кДж/ моль |
Вещество |
DНof,298 кДж/ моль |
So298, Дж/ моль.K |
DGof,298 кДж/ моль |
Al2O3(кр) |
–1676,0 |
50,9 |
–1582,0 |
CuO(кр) |
–162 |
42,6 |
–129,4 |
BaO(кр) |
–558,1 |
70,3 |
–528,4 |
CuCl2(ж) |
–227,6 |
210,9 |
–244,6 |
BaCO3(кр) |
–1219,0 |
112,0 |
–1138,8 |
H2O(г) |
–241,8 |
188,7 |
–228,6 |
ВеО(кр) |
–598 |
14,1 |
–581,6 |
H2O(ж) |
–285,8 |
70,08 |
–237,3 |
BeCO3(кр) |
–982,0 |
67,3 |
–944,8 |
H2SO4(ж) |
–814,2 |
156,9 |
–690,3 |
C(граф) |
0 |
5,7 |
0 |
HCl(ж) |
–166,9 |
56,5 |
–131,2 |
CaO(кр) |
–635,5 |
39,7 |
–604,2 |
HCl(г) |
–91,8 |
186,7 |
–94,8 |
О2(г) |
0 |
205,0 |
0 |
H2 |
0 |
130,5 |
0 |
Ca(OH)2 |
–986,6 |
76,1 |
–896,8 |
H2S(г) |
–21,0 |
205,6 |
–33,8 |
CH4 |
–74,9 |
186,2 |
–50,8 |
NH3(г) |
–46,2 |
192,5 |
–16,7 |
C2H4 |
52,3 |
219,4 |
68,1 |
NO |
90,3 |
210,6 |
86,6 |
C2H6 |
–89,7 |
229,5 |
–32,9 |
NO2 |
33,0 |
240,5 |
51,5 |
C6H6(ж) |
82,9 |
269,2 |
129,7 |
NH4Cl(к) |
–314,2 |
94,5 |
–203,2 |
C2H2 |
226,8 |
200,8 |
209,2 |
P2O5(кр) |
–1492 |
114,5 |
–1348,8 |
CH3OHж |
– |
126,8 |
– |
SO3(ж) |
–439,0 |
122,1 |
–368,1 |
Cl2(г) |
0 |
222,9 |
0 |
Fe |
0 |
27,2 |
0 |
C2H5OHг |
–235,3 |
– |
– |
FeO(кр) |
–264,8 |
60,7 |
–244,3 |
CO |
–110,5 |
197,5 |
–137,1 |
Fe3O4(к) |
–1117,1 |
146,2 |
–1014,2 |
CO2 |
–393,5 |
213,6 |
–394,3 |
Fe2O3(к) |
–822,2 |
89,9 |
–740,3 |
CS2(г) |
115,3 |
– |
– |
Ti(кр) |
0 |
30,6 |
0 |
Cr2O3(кр) |
–1140,6 |
81,2 |
–1059 |
TiO2(кр) |
–943,9 |
50,3 |
888,5 |
Решение:
Fе2O3(к) + 3H2 = 2Fe(к) + 3H2O(г)
DH0, DS0 и DG0
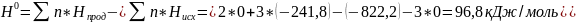
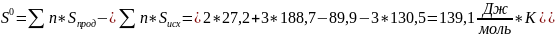
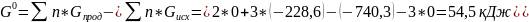

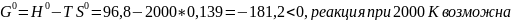
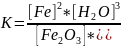
1 моль вещества АВ превращается в 1 моль вещества А и 1 моль вещества В, тогда
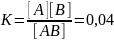 ,
так как было получено В= 0,02 моль/л, А
будет так же 0,02 моль/л и израсходовано
АВ тоже 0,02 моль/л, то тогда
,
так как было получено В= 0,02 моль/л, А
будет так же 0,02 моль/л и израсходовано
АВ тоже 0,02 моль/л, то тогда
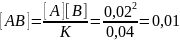 моль/л =>[AB0]=[AB]+AB=0,03
моль/л
моль/л =>[AB0]=[AB]+AB=0,03
моль/л
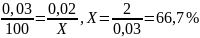
При увеличении давления равновесие сместится в сторону меньшего давления, вправо.
При понижении температуры равновесие сместится в сторону, противоположную типу реакции, то есть влево.
При введении поглотителя В равновесие сместится в сторону отсутствующего вещества, то есть вправо.
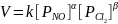 анализируем
таблицу опытов, видим, что некоторые
входные параметры повторяются, будем
это использовать.
анализируем
таблицу опытов, видим, что некоторые
входные параметры повторяются, будем
это использовать.
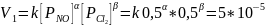
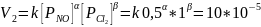
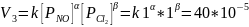
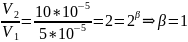

Полученные порядки совпадают со стехиометрическими коэффициентами, реакция может быть простой.

Порядок
реакции (общий)
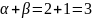
Порядок реакции по NO = 2
Порядок реакции по Cl2=1
=3,
тогда

Реакция ускорится в 243 раза

