Семестр 2 / IDZ1_Bochkarev
.docxМинистерство образования и науки Российской Федерации
Федеральное государственное автономное образовательное учреждение высшего образования
«Национальный исследовательский Томский политехнический Университет»

Институт
электронного обучения
Практическое задание № 1
Номер варианта |
Номера заданий, относящихся к данному варианту |
|
|||||
Вариант- 5 |
5 |
30 |
55 |
80 |
105 |
130 |
|
по дисциплине:
Химия 2.6
Исполнитель:
|
|
||||
студент группы |
О-2Б12 |
|
Бочкарев Вячеслав Дмитриевич |
|
04.06.22 |
|
|
|
|
|
|
Руководитель:
|
Абрамова Полина Владимировна |
||||
преподаватель |
|
|
|
|
|
|
|
|
|
|
|
Томск – 2022
5. Подобрать коэффициенты в уравнениях реакций, в которых степень окисления атомов не изменяется:
а) Ca3P2 + H2O = Ca(OH)2 + PH3;
б) B2O3 + CaF2 + H2SO4 = BF3 + CaSO4 + H2O;
в) Al2(SO4)3 + Na2CO3 + H2O = Al(OH)3 + Na2SO4 + CO2.
Решение:
Ca+23P-32 + 6H+12O-2 = 3Ca+2(OH)-12 + 2P-3H+13
B+32O-23 + 3Ca+2F-12 + 3H+12S+6O-24 = 2B+3F-13 + 3Ca+2S+6O-24 + 3H+12O-2
Al+32(S+6O-24)3+3Na+12C+4O-23+H+12O-2 =2Al+3(O-2H+1)3 + 3Na+12S+6O-24 + 3C+4O-22
30. Смесь меди и алюминия массой 20 г обработали 96 %-ным раствором азотной кислоты, при этом выделилось 8,96 л газа (н. у.). Определить массовую долю алюминия в смеси.
Решение:
Так как кислота концентрированная, то алюминий пассивизируется, поэтому реакция пойдет с медью
Cu+4HNO3=Cu(NO3)2+2NO2+2H2O
Определим сколько моль газа выделится:
n(NO2)=V/Vm=8,96/22,4=0,4 моль.
Из уравнения реакции выделилось в 2 раза больше газа, чем затрачено меди, тогда n(Cu)=0,2 моль.
m(Cu)= n*M=0,2*63,6=12,72 г.
Тогда m(Al)=mсмеси-mCu=20-12,72=7,28 г. Следовательно концентрация
w=mAl/mсмеси=7,28/20=36,4%
55. Составить таблицу электродных потенциалов алюминия в растворах с концентрацией Al3+: 1; 0,1; 0,01; 0,001; 0,0001 моль/л и начертить кривую зависимости электродного потенциала от концентрации ионов.
Решение:
Для определения воспользуемся уравнением Нернста
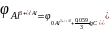
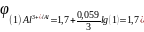 В
В
 В
В
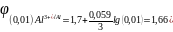 В
В
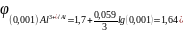 В
В
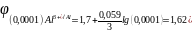 В
В
C (Al3+) |
0,0001 |
0,001 |
0,01 |
0,1 |
1 |
|
1,62 |
1,64 |
1,66 |
1,68 |
1,7 |














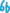
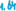



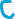

80. Какие три ценных продукта получают посредством электролиза водного раствора хлорида натрия? Запишите электронно-ионные уравнения реакций.
Решение:
Натрий- активный металл, стоящий до алюминия в ряду напряжений, следовательно на катоде будет восстанавливаться водород Н2. Хлор является простым анионом, поэтому на аноде будет восстановление именно молекул газа хлора Cl2. И третьим составляющим электролиза будет гидроксид натрия, образованный остатками разложения воды и хлорида натрия.
2H2O+2e=H2+2OH-
2Cl--2e=Cl2
2NaCl+2H2O=H2+2NaOH+Cl2
105. Составить уравнения процессов, протекающих при электролизе расплавов NaOH и NiCl2 с инертными электродами.
Решение:
NaOH=Na++OH-
4Na++4OH-=4Na+2H2O+O2 Металл у катода, вода и кислород у анода
NiCl2=Ni2++2Cl-
Ni2++2Cl-=Ni+Cl2, Металл у катода, хлор у анода.
130. Железное изделие покрыто никелем. Какое это покрытие – анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в соляной кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
Решение:
Сравнивая электродные потенциалы железа и никеля, делаем выводы, что анодом будет железо, катодом никель, так как у последнего электродный потенциал выше, чем у железа, покрытие катодное.
Во влажном воздухе будут процессы:
А(-) Fe-2e=Fe2+
K(+) 2H2O+O2+2e=4OH-
2Fe+2H2O+O2=2Fe(OH)2 (с последующим окислением до Fe(OH)3)
В соляной кислоте:
A(-) Fe-2e=Fe2+
K(+) 2H++2e=H2
Fe+HCl=FeCl2+H2