
Семестр 2 / IDZ2_Bochkarev
.docxМинистерство образования и науки Российской Федерации
Федеральное государственное автономное образовательное учреждение высшего образования
«Национальный исследовательский Томский политехнический Университет»

Институт
электронного обучения
Практическое задание № 2
Номер варианта |
Номера заданий, относящихся к данному варианту |
|
|||||
Вариант- 5 |
5 |
30 |
55 |
80 |
105 |
130 |
|
по дисциплине:
Химия 2.6
Исполнитель:
|
|
||||
студент группы |
О-2Б12 |
|
Бочкарев Вячеслав Дмитриевич |
|
05.06.22 |
|
|
|
|
|
|
Руководитель:
|
Абрамова Полина Владимировна |
||||
преподаватель |
|
|
|
|
|
|
|
|
|
|
|
Томск – 2022
5. Напишите формулы перечисленных комплексных соединений: тетрахлордигидроксоплатинат (IV) аммония, бромид гексаамминкобальта (III).
Решение
тетрахлордигидроксоплатинат (IV) аммония
(NH4)2[Pt(OH)2Cl4]
бромид гексаамминкобальта (III)
[Co(NH3)6]Br2
30. Константы нестойкости комплексных ионов [Co(NH3)6]3+; [Fe(CN)6]4-, [Fe(CN)6]3- соответственно равны 6,2.10-36; 1,0.10-37; 1,0.10-44. Какой из этих ионов является более прочным? Напишите выражения для констант нестойкости указанных комплексных ионов и формулы соединений, содержащих эти ионы.
Решение
Частица тем прочнее, чем меньше константа нестойкости, следовательно [Fe(CN)6]3- наиболее прочный.
[Co(NH3)6]Cl3
[Co(NH3)6]3+ Co3++6NH3-
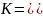
K4[Fe(CN)6]
[Fe(CN)6]4-Fe2++6CN-
K3[Fe(CN)6]
[Fe(CN)6]3-Fe3++6CN-
55. Используя метод ВС, объяснить изменение энергии связи в молекулах галогенов (кДж/моль): F2 (155), CI2 (239), Br2 (190), I2 (149), At (117). Почему при переходе от фтора к хлору энергия связи увеличивается, а в дальнейшем уменьшается?
Решение
В представленных молекулах галогенов применяется донорно-акцепторный механизм образования связей. Ковалентная связь образуется за счет перекрытия p-орбиталей электронов, но помимо фтора, у остальных присутствуют еще свободные d-орбитали, за счет которых и образуются дополнительные связи, отсюда энергия связи выше. Если посмотреть на представленный ряд молекул, то их энергия впоследствии уменьшается, это связано с увеличением радиуса самих атомов и увеличения длины связи.
80. Энергия связи в молекуле О2 равна 493 кДж/моль. Почему в частице О2+ она выше (628 кДж/моль), а в частице О2- - ниже (407 кДж/моль) этой величины?
Решение
12 валентных электронов размещаются в молекуле O2 в следубщем порядке (согласно теории Молекулярных орбиталей МО): 8 на связывающих орбиталях (2s, 2p, 2p) 4 на разрыхляющих (2s, 2p), порядок связи будет рассчитываться как половина разности числа электронов на связывающих и разрыхляющих орбиталях, для молекулы O2=(8-4)/2. Разрыхляющие орбитали расположены находятся дальше от атомной орбитали, поэтому ее энергия уменьшает энергию связи всей молекулы. В ионе, где удалены 2 электрона, энергия связи будет выше, за счет того, что будут удалены два самых «дальних» неспаренных электрона с разрыхляющей орбитали, тогда общий порядок связи повысится. И наоборот, с ионом с дополнительными электронами.
105. Какую геометрическую конфигурацию имеют молекулы PСl3, PCl5 и ион PСl6- ? Чем обусловлено различие строения этих частиц?
Решение
Фосфор имеет электронную конфигурацию 3s23p3 в невозбужденном состоянии, поэтому он способен формировать 3 -связи (неспаренные электроны). В возбужденном состоянии конфигурация уже будет 3s13p33d1, получаются 5 неспаренных электронов и 5 -связей. Взаимное отталкивание орбиталей фосфора дают следующие гибридизации:
PCl3 – sp3, Тетраэдрическая струтура
PCl5 – sp3d1, Тригональная бипирамида
PCl6- – sp3d2, Октаэдрическая струтура
130. Используя метод ВС, объяснить химические связи и геометрическое строение молекул СН4, СО2, СS2, С2Н2. Сколько - и -связей образует атом углерода в каждой из этих молекул?
Решение:
В гибридизации всегда участвует только -связь (связь вдоль оси).
Углерод имеет электронную конфигурацию 2s22p2, в возбужденном состоянии 2s12p3
CH4 – sp3, тетраэдрическая форма, 4 связи, одинарные, все
Кислород имеет электронную конфигурацию 2s22p4
CO2 – sp, линейная форма, 2 двойные связи, по 2 и
Сера имеет электронную конфигурацию 3s23p4
CS2 – sp, линейная форма, 2 двойные связи, по 2 и
C2H2 – sp, линейная форма, но имеется по одинарной связи с атомами водорода и тройная связь углерод-углерод, тогда общее число связей 3 -связей и 2 -связи
