
ПАБВ
.pdfЛабораторна робота № 1.
Тема: Основні технологічні етапи виробництва мікробних ферментних препаратів.
В залежності від джерела отримання ферментних препаратів технологічний процес має ряд особливостей. При виробництві ферментних препаратів з рослинної сировини та тканин тварин технологія зводиться до екстрагування ферментів та очищення їх від відповідних баластних речовин. Технологія мікробних ферментних препаратів є більш складною, так як вона включає в себе ще культивування мікроорганізмів – продуцентів ферментів. Тому розглянемо уважно виробництво мікробних ферментних препаратів.
Цей технологічний процес можна поділити на три етапи: 1). Отримання посівного матеріалу; 2). Отримання виробничої культури методами поверхневого або глибинного культивування; 3) Отримання з готової виробничої культури продуценту технічних або очищених ферментних препаратів.
1.1 Отримання посівного матеріалу.
Для виробництва посівного матеріалу використовують вихідний штам продуцентів, які отримують з лабораторії чистих культур.
Для приготування необхідної кількості посівного матеріалу на виробництві створюється цех чистої культури, який по стадійно веде вирощування посівного матеріалу в асептичних умовах, які гарантують розвиток тільки продуценту та повну відсутність інших мікроорганізмів. Технологія отримання посівного матеріалу залежить від виду продуценту та способу його культивування.
Зберігання вихідних штамів продуцентів. Це відповідальна та важка задача. Особливі труднощі виникають у випадках, коли вихідним штамом є мутант, так як при його тривалому зберіганні не виключається можливість спонтанної зміни цієї культури. Для попередження цього необхідно періодично проводити розсів культури і перевірку її однорідності як по морфологічним, так і по фізіологічним ознакам. При цьому з колонії, яка дає найкращі результати, роблять нове розсіювання у 30-40 пробірок і потім перевіряють на 5-6 пробірках здатність відібраної культури продукувати ферменти.
Ні один з багато чисельних способів зберігання живих культур мікроорганізмів не дає повної гарантії стабільності штаму і зберігання його продуктивності. Найбільш розповсюдженим способом підтримання вихідної сировини продуцента є висівання мікроорганізмів в пробірки у живильні середовища з оптимальним для кожної культури складом і вирощування їх до певного часу в оптимальних умовах.
Готову культуру в пробірках поміщують в холодильник і зберігають при температурі 3-4 0С. Пересівання культур проводять через певні проміжки часу з таким розрахунком, щоб найкращим образом зберігати фізіолого-біохімічні властивості штаму.
Більш тривалий час можна зберігати культуру під шаром вазелінового масла, яке призначене для медичних потреб. Воно не повинно містити токсинів та продуктів окислення. Шар масла повинен бути тільки на 1 см вище агарового зрізу, бо можлива загибель культури від нехватки кисню. Попередньо масло стерилізують при 0,15 МПа на протязі 1,5 години. Культуру заливають стерильним маслом після того, як вона досягне повної фізіологічної зрілості. Для цього способу зберігання найкращим середовищем є картопляно-мальтозний агар.
Відомі способи зберігання культур при температурах від -11 до -140С. В цих умовах культури зберігають активність на протязі 10-14 місяців.
Вихідний штам може зберігатися на зерні або грунті. Для цього грунт стерилізують і вносять в нього культуру продуценту. Штам в таких умовах може зберігатися довго. При відновленні культури змив з грунту висівають в чашки Петрі. Якщо продуцент зберігають на пшоні, то для цього пшоно, очищене від домі шків, кип’ятять в мінімальній кількості води (0,8 л на 1 кг пшона), розпарюють 30 хвилин, видаляють грудки, які утворилися, охолоджують і засипають по 15-16 г в стерильні флакони місткістю 250 мл, які потім стерилізують при 0,1 МПа на протязі 40 хвилин. Потім на стерилізоване пшоно висівають культуру продуцента. Культуру вирощують при температурі 25-300С. Вирощену культуру висушують до вологості 7-8% у вакуумі при температурі 250С на протязі 60-70 годин і в такому вигляді зберігають від 1 до 3-5 років.
Підготовка посівного матеріалу для поверхневого культивування. Цей спосіб застосовують в основному для культивування мікроскопічних грибів. Посівний матеріал в цьому випадку може бути приготований двох видів: у вигляді культури, яка вирощена на твердому живильному середовищі, та міцеліальної маси продуценту, яка вирощена на рідкому середовищі глибинним способом. Незалежно від виду посівного матеріалу послідовність операцій однакова: 1) Приготування живильного середовища; 2) Стерилізація живильного середовища та апаратури; 3)Охолодження середовища з дотриманням правил асептики до температури росту культури; 4) Засівання середовища вихідним штамом продуценту; 5) Вирощування культури продуценту до певного віку; 6) консервування посівного матеріалу.
Приготування поживного середовища зводиться до точного дозування окремих компонентів середовища та їх змішуванні в певній послідовності. Цей процес можна проводити в спеціальній ємності – змішувачі або ж в апараті, який призначений для стерилізації. Умови стерилізації залежать від складу середовища та його стану. Всю апаратуру та комунікації стерилізують гострим паром при надлишковому тиску 0,15-0,35 МПа. Охолоджувати середовище можна стерильним холодним повітрям або холодною водою крізь глухі поверхні теплообміну. Засів середовища ведуть водною суспезією продуценту з дотримання правли асептики.
Вирощування проводиться в спеціальному цеху. Готовий посівний матеріал консервують або висушуванням або зберіганням при низьких температурах. Термін зберігання встановлюється для кожного продуцента експериментально.
Посівну культуру на твердому поживному середовищі готовлять, вирощуючи мікроорганізмі у зростаючій кількості в три або чотири етапи. Склад поживного середовища визначається властивостями мікроорганізмів – продуцентів ферментів. Частіше всього для цієї мети використовують вологі пшеничні висівки. Іноді до середовища додають солодові ростки, стружку
деревини, жом з буряків. В залежності від продуценту вологість середовища після стерилізації складає 45-56%.
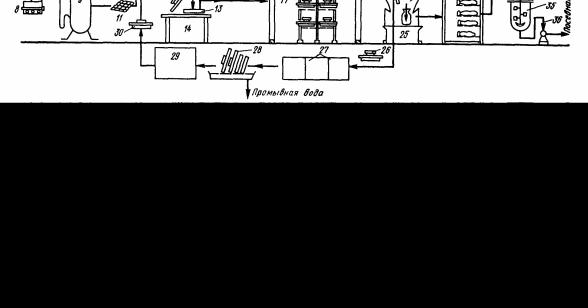
Рисунок 1. Технологічна схема отримання посівної культури для поверхневого способу культивування:
1-вихідна культура продуценту в пробірках; 2-культура в колбі на висівках; 3- культура на висівках в банці Протодьяконова; 4-ємність для підігрівання води; 5- стерилізатор; 6-ємність для зберігання висівок; 7-дозатор; 8-ємність з висівками; 9-автоклав; 10-ємність зі стерильними висівками; 11-ватно-марлева серветка; 12кришка для кювети; 13-кювета на завантаженні; 14-стіл; 15завантажена кювета; 16вирощувальна камера; 17-стелажі; 18-вихід повітря з калорифера в атмосферу; 19-фільтри для повітря; 20-вентилятор; 21-калорифер; 22-відбійники; 23-ручний маніпулятор для розвантаження кювет; 24готова посівна культура; 25стерильний флакон; 26брудна кювета; 27-ванни для мийки кювет; 28підсушування кювет; 29-шкаф для стерилізації кювет; 30стерильна кювета; 31холодна кімната; 32-ємність для стерилізації та охолодження води; 33-ємність для поверхнево-активної речовини; 34-дозатор; 35-ємність для приготування посівної суспензії; 36-насос.
Вихідну культуру продуцента на твердій аграризованому середовищі пересівають спочатку на 1-1,5 г вологих стерильних висівок в пробірку (рис.1). Пробірку розміщують в термостаті і вирощують культуру при оптимальній температурі. Вміст пробірки переносять у 3-4 колби місткістю 0,75-1 л, які містять 40-100 г рихлого стерильного середовища, і вирощують продуцент при тих же умовах.
Приготований в колбах в достатній кількості посівний матеріал використовують для засівання поживного середовища, яке попередньо стерилізують при 0,15 МПа на протязі 60 хвилин. Щасіяне середовище розміщується в стерильних кюветах. Ці кювети мають прямокутну форму, і виготовлені з неперфорованого заліза і мають кришки, в яких є одне або два отвори, які закриваються марлевими серветками. Трьох колб достатньо для засівання 20-25 кювет. Посіяне середовище розкладують в посівні кювети шаром 0,8-1,2 см; між кюветою і кришкою кладуть шар паперу для попередження утворення конденсату. Закриті кювети з середовищем розміщують в спеціальних рослинних камерах для посівної культури на стелажі. В камері підтримують певну вологу і температуру, які оптимальні для вирощування штаму. Камери заповнюють кюветами з розрахунку не більше ніж 1-2 кг засіяного середовища (за сухою масою) на 1м3 об’єму камери.
Готовий посівний матеріал знімають з кювет за допомогою ручного маніпулятора і у вологому стані розміщують в стерильні пакети, які відправляють на зберігання в камеру з температурою не вище 40С до закінчення мікробіологічної та хімічної перевірки. Тривалість зберігання посівного матеріалу не повинна перевищувати 5-6 днів, так як волога культура навіть при низькій температурі поступово стає малопристосованою для отримання активної культури.
Якщо посівний матеріал задовольняє усім вимогам, його передають з холодного приміщення у відділення приготування посівної суспензії. Посівний матеріал змішують в спеціальній посуді зі стерильною водою і невеликою кількістю поверхнево-активної речовини для підвищення змочування. Така суспензія і є готовим посівним матеріалом.
Підготовка посівного матеріалу до глибинного культивування. Для засівання виробничого середовища при глибинному способі культивування посівний матеріал готовлять також глибинним способом. Вид посівного матеріалу залежить від продуцента: для грибів та актиноміцетів – це міцеліальна маса, а для бактерій – молода спорова культура.
Етапи отримання посівної культури наступні: 1)Поновлення вихідної культури на поживному середовищі; 2) Вирощування молодої культури в рідкому середовищі; 3) Культивування продуценту в малому, а потім, якщо необхідно у великому інокуляторі;
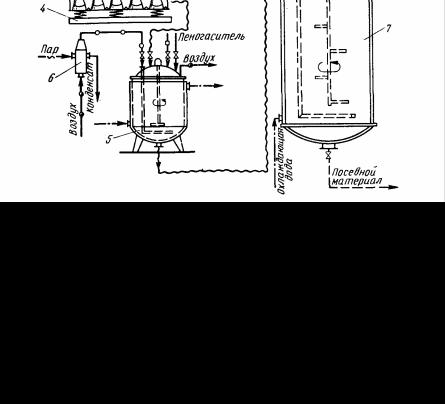
Технологічна схема приготування посівного матеріалу для глибинного культивування наведена на рис.2.
Рисунок 2 – Технологічна схема отримання глибинного посівного матеріалу.
Початковий продуцент з пробірки 1 пересівають на основу 2 на якій велика кількість поживного середовища. З основи культуру змивають стерильною водою і у вигляді суспензії використовують для засівання колб 3. Частіше всього засівання ведуть зразу з пробірки в колби. Колби закріплюють на качалці 4, яка перемішує рідину в колбах і сприяє розчиненню кисню в середовищі, що забезпечує нормальні умови життєдіяльності мікроорганізмів. Готову культуру з колб збирають в одну ємність при дотриманні правил асептики і переносять в малий інокулятор 5 зі стерильним охолодженим середовищем. В малий інокулятор крізь індивідуальний фільтр 6 подається стерильне повітря.
Підготовку, стерилізацію та охолодження поживного середовища проводять в малому інокуляторі.
Для великого інокулятора 7 середовище готують, як парвило, в спеціальних апаратах і подають її в стерильний, охолоджений до 60-700С інокулятор. Готову культуру з малого інокулятора передавлюють стерильним повітрям у великий інокулятор на свіже поживне середовище.
Культивування на всіх стадіях ведеться при оптимальній температурі і подачі повітря. Готову культуру зразу ж передають на виробництво.
1.2 Отримання виробничих культур.
Виробничу культуру продуцента можливо отримати, вирощуючи мікроорганізми як на поверхні твердих або рідких середовищ, так і в глибині рідкого поживного середовища. Спосіб культивування мікроорганізмів визначає і технологічну схему виробництва.
До основних факторів, як впливають на швидкий ріст мікроорганізмів і максимальний біосинтез ними ферментів, відносяться: склад поживного середовища, умови приготування та стерилізація середовища, кількість і спосіб підведення повітря, до культури, яка росте, правильний вибір умов вирощування продуцента та спосіб контролю за цим процесом.
Поживні середовища для культивування мікроорганізмів. Основною вимогою, яка висувається до складу поживного середовища, є її повноцінність для росту продуцента та забезпечення синтезу цільового продукту. Мікроорганізмам потрібні з’єднання які містять вуглець, нітроген, водень, кисень. У склад середовища повинні входити такі мінеральні речовини як магній, кальцій, фосфор, сірка, залізо, калій та деякі інші. Склад середовища для різних мікроорганізмів різний, але всі продуценти ферментів засвоюють вуглець переважно у вигляді органічних сполук, водень – у вигляді води і в складі органічних з’єднань, кисень – з основного складу середовища і в молекулярному виді. Поживні речовини використовуються мікроорганізмами не тільки на побудову клітини, яка росте, але і на забезпечення енергією основних процесів життєдіяльності.
Так як більшість продуцентів ферментів є аеробами, то майже всі вуглеводні, засвоюються ними шляхом окислення і основними продуктами метаболізму є діоксид вуглецю і вода. Якщо склад середовища підібраний правильно, то надлишкового накопичення проміжних продуктів немає.
Оптимальний склад середовища для кожного продуцента може бути визначений двома способами: методом емпіричного підбору та з використанням математичних методів планування експериментів. Перший метод був до недавнього часу широко розповсюджений у всіх галузях промисловості, які використовують мікроорганізми. Знання фізіологічних особливостей мікроорганізмів дозволяло біологам методом підбору та зміни деяких факторів при незмінних інших підібрати нормальну та продуктивну поживну сировину, але такий спосіб займає багато часу. Більш прогресивним є використання математичних методів планування експериментів, які дозволяють значно швидше знайти і обґрунтувати оптимальний склад поживного середовища.
Середовища, в залежності від складу поділяються на синтетичні та комплексні. Синтетичними є середовища, які складаються з певних визначених за кількісним складом індивідуальних речовин. Джерелами вуглецю в таких середовищах можуть бути вуглеводні, спирти, органічні кислоти; джерелами азоту – солі, які містять нітроген, амінокислоти, пептиди певного складу і т.п.
В комплексні середовища входять різні природні продукти, які містять органічні з’єднання, і відходи ряду виробництв. Комплексні середовища більш дешеві, більш доступні і тому частіше використовуються у виробництві. Їх компонентами можуть бути висівки, мука різних злаків, меляса, гідрол, вижимки плодів та овочів, барда спиртових заводів і т.п.
Особливості складу середовища для глибинного вирощування продуцентів. При створенні поживних середовищ для глибинного культивування продуцентів ферментів можна використовувати малорозчинні компоненти. Але їх кількість повинна бути обмеженою, так як високий вміст нерозчинних залишків приходить до погіршення реологічних властивостей середовища і ускладнює наступну обробку середовища та культуральної рідини. Поживні середовища
готовлять на воді з водопроводу, вміст сухої речовини в них від 2,5 до 20% в залежності від фізіологічних потреб продуцентів.
Приготування поживного середовища. Сухі компоненти для приготування поживного середовища зберігають в основному виробничому приміщенні або спеціальному складському приміщенні. Поживне середовище для поверхневого культивування готують в стерилізаторі або спеціальній ємності з пристроями для перемішування, куди дозують окремі компоненти і змішують їх з водою або водним розчином із збагачувачами (розварена маса, сіль, кислоти, кукурудзяний екстракт). При глибинному способі культивування приготування поживного середовища здійснюється в спеціальній ємності. Якщо виробництво невелике, то приготування середовища і його стерилізацію можна здійснювати в одному приміщенні.
Методи приготування поживних середовищ різні і залежать від складу компонентів, які в нього входять. Для одних компонентів необхідно робити попередню обробку: подрібнення, відварювання, екстрагування і т.п. Ці попередні операції проводять в спеціальних ємностях і в спеціальних апаратах. Попередньо оброблені компоненти поживного середовища подають при постійному перемішуванні через дозуючий пристрій в ємність для приготування середовища.
Ємності для приготування поживного середовища можуть бути відкритими або закритими, циліндричної форми зі сферичним дном, з мішалкою та барботажними пристроями для повітря та пару та з дозуючими пристроями. Ці апарати вимовляються з нержавіючої сталі або з матеріалів з антикорозійним покриттям.
Лабораторна робота №2 Тема. Стерилізація поживного середовища.
Мета: Ознайомитися з питаннями щодо стерилізації поживного середовища та обладнанням, яке для цього використовується.
1.1 Стерилізація сипучого поживного середовища
При поверхневому способі вирощування різних мікроорганізмів необхідний різний ступінь термічної обробки середовища. Якщо середовище в процесі культивування не перемішується і не переміщується то її абсолютна стерильність необов’язкова. Найбільше розповсюдження отримали горизонтальні двохциліндрові стерилізатори, де обробка зволожених висівок здійснюється при температурі 104-1100С впродовж 1,5-2 години. При цьому ефект стерилізації підсилюється додатковим введенням в середовище антибіотиків (фурациліну) з розрахунку 1,5 г на 100 кг сухого середовища та 0,2% розчину формаліну з концентрацією 40%. Тверде, зволожене до 35-40% середовище рухається в цьому апараті по замкнутому колу. Стерилізатор являє собою два з’єднаних циліндри, які мають по одному валу з закріпленими на них по гвинтовій лінії лопатями. Так як направлення руху валів різне, то маса, яка рухається по горизонталі, в кінці циліндру перекидується в сусідній, підхоплюється лопатями і направляється вздовж другого циліндра в протилежному напрямі. Така конструкція дозволяє перемішувати, рівномірно нагрівати і стерилізувати середовище любий необхідний за регламентом час. Є також двох степеневі стерилізатори. В першій вертикальній циліндроконічній ступені, яку обладнано мішалкою, проводиться нагрівання середовища гострим паром до температури 1200С та її витримування на протязі певного часу. Друга ступінь – це горизонтальний циліндр, де здійснюється охолодження стерильної маси, її дозволоження та засівання чистою культурою продуцента.
При невеликому виробництві можлива стерилізація твердого поживного середовища в спеціальних перфорованих металевих ємностях-біксах в автоклавах при температурі 1200С на протязі 1,5-2 г.
При режимах стерилізації, які прийняті для сипучих середовищ, повна стерильність середовища та жорсткі умови стерилізації необхідні у випадку, коли в процесі культивування середовище переміщується або перемішується. Не стерильність середовища, в цьому випадку може потягнути за собою інфікування усієї маси, особливо коли продуцент має низьку швидкість росту. Цю обставину необхідно мати на увазі при проектування великих виробництв з
