
23_Lektsii-STROENIE_ATOMA
.pdfСОДЕРЖАНИЕ |
|
|
Введение |
2 |
|
Строение атома |
3 |
|
Модель атома Бора |
4 |
|
Квантово-механическая модель атома. |
6 |
|
Квантовые числа |
8 |
|
Главное квантовое число. |
8 |
|
Орбитальное квантовое число |
8 |
|
Магнитное квантовое число |
9 |
|
Спиновое квантовое число |
11 |
|
Строение многоэлектронных атомов |
11 |
|
1. |
Принцип минимума энергии. |
11 |
2. |
Принцип Паули. |
12 |
3. |
Правило Гунда. |
12 |
Электронные формулы атомов и Периодическая система элементов (ПСЭ) 12
Большие периоды |
13 |
Изменение свойств элементов в свете Периодического закона |
16 |
Изменение атомных радиусов. |
16 |
Энергия ионизации |
16 |
Энергия сродства к электрону |
17 |
Электроотрицательность. |
18 |
Изменение химических свойств. |
18 |
Изменение химических свойств по группе |
19 |
Изменение химических свойств по периодам |
19 |
Список литературы |
20 |
Введение
Одной из важнейших химических теорий является атомная теория. В 1805 г. английский химик и физик Дж. Дальтон представил доказательства в поддержку гипотезы о том, что вещества состоят из маленьких частиц материи. Он назвал эти частицы атомами (atomos (греч.) – неделимый). Атомы представляют собой такие частицы, которые сохраняются при химических взаимодействиях. Эта гипотеза дала простое объяснение количественному соотношению веществ, участвующих в химических реакциях. Атомы являются структурными единицами всех твердых веществ, жидкостей и газов. В настоящее время имеются многочисленные доказательства существования атомов. Но если на начальных этапах разработки атомной теории аргументация основывалась на химических фактах, то, начиная с прошлого столетия, методы физики позволили получить множество непосредственных доказательств существования атомов и информацию об их свойствах.
Атом – наименьшая частица химического элемента, способная к самостоятельному существованию и являющаяся носителем его свойств.
Атом – система взаимодействующих элементарных частиц, состоящая из ядра, образованного протонами и нейтронами, и электронов. В ядре сосредоточена основная масса атома.
Название частицы |
масса, кг |
масса, а.е.м. |
заряд, усл.ед |
заряд, Кл |
|
|
|
|
|
Протон |
1,6726·10-27 |
1,00728 |
+1 |
1,6·10-19 |
|
|
|
|
|
Нейтрон |
1,6749·10-27 |
1,00867 |
0 |
0 |
|
|
|
|
|
Электрон |
9,109·10-31 |
5,468·10-4 |
-1 |
-1,6·10-19 |
|
|
|
|
|
А.е.м. – атомная единица массы – 1/12 часть массы наиболее распространенного естественного стабильного изотопа углерода 12С.
Химический элемент – совокупность атомов с одинаковым зарядом ядра.
ZA Э А – массовое число
Z – заряд ядра атома (число протонов в ядре),
соответствует порядковому номеру элемента в периодической системе
А = Z – N, где N – число нейтронов.
Изотопы – атомы с одинаковым зарядом ядра, но разным массовым числом (разное число нейтронов). В химическом отношении изотопы являются неразличимыми атомами. Например, 1735Cl, 1736Cl, 1737Cl .
Изобары – атомы с одинаковым массовым числом, но разным зарядом.
Например, 1840 Ar, 1940 K , 2040Ca .
Строение атома
Долгое время считалось, что атом это неделимая частица, но открытия конца XIX в – начала ХХ в, показали сложную структуру атомов.
Доказательством сложной структуры атомов послужило открытие явления радиоактивности. В 1896 г. Беккерель обнаружил радиоактивность урана, а в 1898 г. П. и М. Кюри определили, что такими же свойствами обладают радий и полоний. Атомы радиоактивных элементов неустойчивы и постепенно разрушаются, образуя новые атомы, новые химические элементы, отличные по своим свойствам от материнских элементов.
Вэто же время в 1897 г. Дж. Дж. Томсон в результате проведенных опытов по изучению прохождения электричества через газы пришел к выводу о существовании электрона и определил некоторые его свойства. Было установлено, что электроны могут быть выделены из атомов любого элемента, при этом отношение заряда электрона к его массе было одним и тем же. Это доказывало, что природа электрона одна и та же не зависимо от природы вещества, то есть электрон является структурной единицей атома любого химического элемента. Электрон является заряженной частицей, заряду электрона было приписано отрицательное значение, а атом не обладает электрическим зарядом, он электронейтрален. Следовательно, в атомах кроме электронов должны содержаться и положительно заряженные частицы. Таким образом, возник вопрос о строении атома, о его внутренней структуре.
В1903 г. Дж. Дж. Томсон предложил модель, согласно которой атом состоит из положительного заряда, равномерно распределенного по всему объему атома и электронов, колеблющихся внутри этого заряда.
Опыты Резерфорда по рассеянию -частиц тонкими металлическими пластинками позволили сделать выводы, что в очень малом объеме атома сконцентрирован положительный заряд. И в 1911 г. Резерфорд предложил планетарную модель атома, согласно которой электроны в атоме вращаются вокруг положительного ядра, в котором сосредоточена основная часть массы атома, и центробежная сила в точности уравновешивается кулоновским притяжением. Уже из опытов Резерфорда следовало, что заряд ядра численно равен порядковому номеру элемента в периодической системе.
Согласно такой модели атом должен был бы поглощать или излучать энергию любыми порциями, при этом изменялся бы только радиус орбиты электрона. Это противоречило экспериментальным данным известным к тому времени и реальным свойствам атома.
1.Из электродинамики известно, что вращающийся вокруг некоторого центра заряд является источником электромагнитных колебаний, поэтому электрон, излучая, должен был непрерывно терять энергию и в итоге упасть на ядро, в результате атом прекратит свое существование.
2.Наличие атомов водорода образующихся при электрическом разряде в газообразном водороде можно установить по испускаемому ими свету. В отличие от излучения нагретого источника свечение электрического разряда приводит к появлению только определенных цветов в виде линейчатого спектра (рис. 1). Это

означает, что атом водорода может излучать лишь некоторые определенные количества энергии.
а
б
Рис. 1. Видимая область спектра (а) и линейчатый спектр атома водорода в видимой области (б).
Модель атома Бора
В 1900 г. М. Планк для объяснения особенностей распределения энергии в спектрах нагретых тел предложил теорию, основанную на предположении, что энергия не излучается атомами непрерывно, а испускается отдельными мельчайшими неделимыми порциями – квантами, величина которых зависит от частоты излучаемого света:
E=h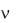
где Е – энергия кванта
– частота колебаний h – постоянная Планка.
Таким образом, энергия тела может меняться на величины, кратные h , подобно тому, как электрический заряд может меняться лишь на величину, кратную заряду электрона.
В 1913 г. Нильс Бор попытался обосновать планетарную модель атома, предложенную Резерфордом, с учетом квантовой природы излучения. Он рассматривал электрон как частицу с определенной массой и определенным зарядом, которая движется вокруг ядра по определенным траекториям и взаимодействует с ядром по законам классической электродинамики.
Бор выдвинул следующие постулаты (бездоказательные утверждения):
1.Электрон может вращаться вокруг ядра не по любым орбитам, а только по некоторым круговым орбитам. Эти орбиты получили название стационарных. Двигаясь по стационарной орбите, электрон не излучает электромагнитной энергии.
2.Излучение происходит при скачкообразном переходе электрона с одной стационарной орбиты на другую. При этом испускается или поглощается квант электромагнитного излучения, энергия которого равна разности энергий атома в конечном и исходном состояниях.
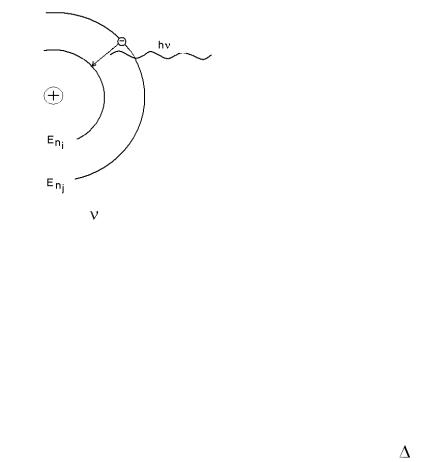
Enj – Eni = h
Достоинства модели атома по Бору
1.Бор вычислил уровни энергии электрона в атоме водорода.
En = -13,6/n2, где n – номер орбиты. Энергия электрона возрастает по мере удаленности орбиты от ядра. Отрицательный знак энергии означает устойчивость системы, которая тем более устойчива, чем ниже ее энергия.
2.Бор вычислил радиусы «дозволенных орбит».
r1 = 0,529 Å, 1 Å (1 ангстрем) = 10-10 м. rn = 0,529n2.
3. Рассчитанные частоты из соотношения E = h совпали с данными полученными из атомных спектров атома водорода и некоторых других частиц с одним электроном, например, Не+.
совпали с данными полученными из атомных спектров атома водорода и некоторых других частиц с одним электроном, например, Не+.
Недостатки модели атома по Бору
1.Модель не может объяснить, почему происходит квантование и почему электрон на орбите не излучает энергию, как того требует электродинамика. Оба эти свойства были постулированы.
2.Теоретические и экспериментальные данные совпадали для частиц, содержащих один электрон, но теория не могла объяснить спектральные характеристики многоэлектронных атомов, даже для самого простого случая – атома Не.
3.Теорию оказалось невозможным применить для объяснения химической связи.
На основе общепринятого сейчас квантовомеханического описания атома можно сказать, что данная теория имела внутренние противоречия – она ни последовательно классическая, ни квантовая. Несмотря на это теория Бора открыла дорогу квантовой механике, хотя впоследствии почти все детали данной модели были опровергнуты.

Квантово-механическая модель атома.
Воснове квантово-механической теории лежат следующие положения:
1.Энергия в микромире поглощается или излучается дискретно в виде квантов. Как уже упоминалось выше, данное представление о квантах было введено М. Планком.
2.Все микрочастицы имеют двойственный характер. В 1924 г. Луи де Бройль предположил, что электрон подобно фотону можно рассматривать и как частицу и как волну. Движение любой материальной частицы можно
рассматривать как волновой процесс, при этом справедливо соотношение = h/mv, где m и v – масса и скорость частицы. Эти волны получили название волн де Бройля. Предположение де Бройля в дальнейшем подтвердилось опытами по дифракции и интерференции электронов на кристаллах металлов.
3.Принцип неопределенности. Соотношение неопределенностей было установлено Гейзенбергом. Согласно этому соотношению невозможно одновременно точно определить местоположение частицы и ее импульс. Соотношение неопределенностей имеет вид:
x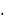 p h/2 , где x – неопределенность координаты, p – неопределенность импульса.
p h/2 , где x – неопределенность координаты, p – неопределенность импульса.
Чем точнее определяется координата частицы, тем более неопределенным становится ее импульс, и, наоборот, чем точнее известен импульс, тем более неопределенна координата.
Система понятий в квантовой механике резко отличается от классической. Квантовая механика дает вероятности нахождения частиц и ничего не говорит о траектории частицы, ее координатах и скорости в тот или иной момент времени – эти понятия в квантовой механике не имеют смысла. Однако в ней сохраняют свое значение понятия о величинах массы, заряда, энергии и момента импульса частицы.
Законы движения микрочастиц в квантовой механике выражаются уравнением Шредингера:
|
|
|
|
|
|
(x, y, z) |
2m |
(E U ) (x, y, z) 0 |
, |
|
|
|
|
2 |
|||||
|
|
|
|
|
|
|
|
|
|
|
2 |
2 |
2 |
|
|
|
|
||
где |
|
|
|
|
|
– оператор Лапласа, |
|
||
x2 |
|
y 2 |
z 2 |
|
|||||
– волновая функция (пси-функция), m – масса частицы,
U – потенциальная энергия, Е – полная энергия,
ħ = h/2 .
Уравнение Шредингера с математической точки зрения является дифференциальным уравнением второго порядка в частных производных. Волновая функция Ψ = Ψ(x,y,z) является решением этого уравнения. Подобные
уравнения чаще всего аналитически не решаются, поэтому в квантовой физике существует очень узкий круг задач, решаемых в аналитическом виде до конца.
Таким образом, состояние электрона в атоме водорода описывается с помощью волновой функции – (пси). Эта функция содержит информацию об энергии электрона и о вероятности его нахождения в различных областях пространства около ядра.
Величина Ψ2 называется плотностью вероятности обнаружения электрона вблизи заданной точки. Тогда W = Ψ2·dV – вероятность нахождения электрона в объеме dV.
Атом водорода устроен наиболее просто – он имеет только один электрон, движущийся в поле ядра. Решение уравнения Шредингера показывает, что это
уравнение имеет не одно, а набор решений – |
1, |
2, 3. |
Оказывается, что |
допустимые значения Е, соответствующие |
|||
решениям уравнения Шредингера, в точности |
|||
отвечают уровням |
энергии |
атома водорода. |
|
-функция |
основного |
энергетического |
|
состояния является экспонентой с максимумом в начале координат (рис. 2). В качестве элемента объема dV возьмем сферический слой
толщиной dr на расстоянии r от ядра: |
dV = |
|
4 r2dr |
|
|
W = Ψ24 r2dr. |
|
|
Функция W определяющая |
пространственное |
|
распределение электрона в |
невозбужденном |
|
атоме водорода, обращается в нуль вместе с r2 в начале координат и экспоненциально убывает
при больших r, при r1 |
эта функция достигает |
|||
максимума (рис. |
2). |
Для |
атома |
водорода |
r1 = 0,53 Å – эту |
величину |
принято |
называть |
|
радиусом первой боровской орбиты атома водорода. В действительности, никаких орбит у электронов в атоме, конечно, не существует, это название перешло в современную физику из полуклассической теории Бора.
Рис. 2.
Полный анализ уравнения Шредингера не возможен без решения соответствующего дифференциального уравнения, что выходит за рамки нашего курса, поэтому мы ограничимся общими выводами:
1.Из решения уравнения Шредингера автоматически вытекает существование дискретных уровней энергии, то есть квантованность энергетических состояний оказывается следствием присущих электрону волновых свойств.
2.Электрон может находиться в любой части пространства, окружающего ядро, но вероятность его пребывания в той или иной части неодинакова. Область пространства, в которой с вероятностью 90–95 % можно обнаружить электрон получила название атомной орбитали.
3.Решение уравнения Шредингера приводит непосредственно к трем квантовым числам, которые характеризуют энергетическое состояние и поведение электрона в атоме.
Квантовые числа
Энергетическое состояние электрона в атоме может быть полностью описано набором из четырех квантовых чисел: n – главное квантовое число
l – орбитальное квантовое число ml – магнитное квантовое число ms – спиновое квантовое число.
Первые три квантовых числа (n, l, ml) следуют из решения уравнения Шредингера и полностью описывают атомную орбиталь.
Главное квантовое число.
Главное квантовое число принимает целочисленные значения: n = 1, 2, 3… . Оно характеризует основной уровень энергии электрона и размер электронного облака. В многоэлектронных атомах совокупность электронов с одинаковым значением главного квантового числа называется электронным слоем. Каждому уровню энергии (n) соответствует буквенное обозначение электронного слоя.
Главное квантовое число n |
1 |
2 |
3 |
4 |
5 |
6 |
… |
(номер энергетического уровня) |
|
|
|
|
|
|
|
Буквенное обозначение электронного |
K |
L |
M |
N |
O |
P |
… |
слоя |
|
|
|
|
|
|
|
Орбитальное квантовое число
При размещении электрона вдали от ядра происходит расщепление уровня энергии на подуровни. Чем дальше электрон от ядра, тем сильнее расщепление, тем больше подуровней у данного энергетического уровня.
Орбитальное квантовое число зависит от n и может принимать целочисленные значения от 0 до (n – 1): l = 0, 1, …, (n-1). Сумма подуровней на уровне численно равна номеру уровня. В многоэлектронных атомах совокупность

электронов с одинаковым значением орбитального квантового числа называется электронной оболочкой. Каждому подуровню энергии соответствует буквенное обозначение подуровня.
Орбитальное квантовое число l |
0 |
1 |
2 |
3 |
4 |
5 |
… |
Буквенное обозначение подуровня |
s |
p |
d |
f |
g |
h |
… |
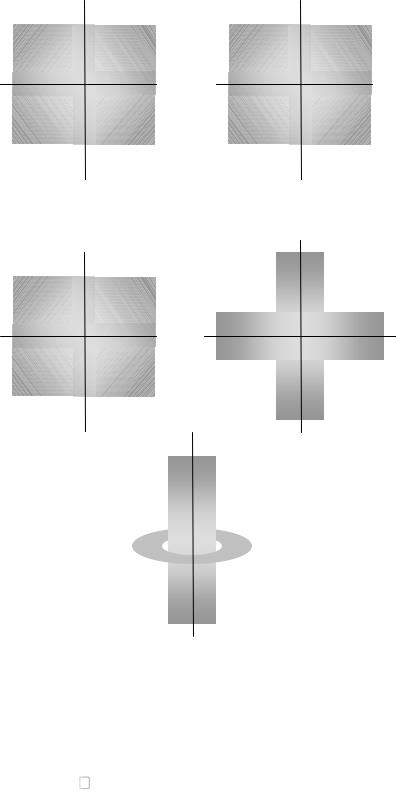
Орбитальное квантовое число определяет форму орбитали.
l = 0 |
l = 1 |
l = 2 |
s-орбиталь |
p-орбиталь |
d-орбиталь |
Магнитное квантовое число
Характеризует результат взаимодействия магнитного поля движущегося электрона с наложенным внешним магнитным полем. Экспериментально такое взаимодействие обнаруживается по расщеплению линий в спектре атома в магнитном поле. Тип взаимодействия определяется формой орбитали, поэтому ml зависит от l. Магнитное квантовое число определяет дискретные возможные ориентации атомных орбиталей в пространстве. Магнитное квантовое число принимает целочисленные значения от –l до +l: ml = –l, …, 0, …, +l . Число возможных значений ml при данном значении l соответствует числу способов ориентации орбиталей в пространстве.
l = 0, ml = 0
z
pz
l = 1, ml = -1, 0, +1
y
py
px
x
y |
z |
x |
x |
d xy d xz
y
z
l = 2, ml = -2, -1, 0, +1, +2
y |
x |
d yz |
z |
d x2 – y2 |
|
d z2
Таким образом, любой подуровень (кроме s-подуровня) может быть разбит на условные энергетические ячейки ( ), каждая из которых характеризуется определенным значением ml из указанного диапазона допустимых значений. Каждая ячейка представляет атомную орбиталь и описывается определенными значениями n, l, ml. Причем суммарное число значений ml определяет число атомных орбиталей на данном подуровне энергии.
