
6_kolligativnye_svoystva_rastvoro
.pdf
ЛЕКЦИЯ 6
КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ НЕЭЛЕКТРОЛИТОВ
ПЛАН ЛЕКЦИИ
 Основные понятия.
Основные понятия.
 Понижение давления насыщенного пара растворителя над раствором.
Понижение давления насыщенного пара растворителя над раствором.
Закон Рауля.
 Температуры кипения и кристаллизации растворов.
Температуры кипения и кристаллизации растворов.
 Осмотическое давление.
Осмотическое давление.
ОСНОВНЫЕ ПОНЯТИЯ
Свойства растворов, которые зависят от концентрации и практически не зависят от природы растворенных веществ, называют коллигативными. Общие свойства растворов изучают на примере разбавленных растворов, которые приближаются к идеальным.
Идеальным называют раствор, в котором химическое взаимодействие между компонентами отсутствует, а силы межмолекулярного взаимодействия между компонентами одинаковы.
Образование идеальных растворов не сопровождается тепловыми и объемными эффектами, и каждый компонент ведет себя независимо от других компонентов. Наиболее простые уравнения получены для описания свойств разбавленных растворов неэлектролитов. Характерной особенностью растворов неэлектролитов является отсутствие в них заряженных частиц – ионов и, как следствие, неэлектропроводность растворов.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

ПОНИЖЕНИЕ ДАВЛЕНИЯ НАСЫЩЕННОГО ПАРА РАСТВОРИТЕЛЯ НАД РАСТВОРОМ
Давление насыщенного пара любого чистого вещества при данной температуре постоянно и определяется природой этого вещества. Насыщенный пар находится в равновесии с жидкостью, на примере воды:
H2O(ж)  H2O(пар) .
H2O(пар) .
Растворение в воде какого-либо вещества приводит к уменьшению концентрации воды в жидкой фазе, смещению равновесия в сторону конденсации воды и понижению концентрации паров воды. Если растворенное вещество нелетучее, концентрацией паров воды определяется давление насыщенного пара над раствором. Таким образом, давление насыщенного пара над раствором снижается. Соответствующая количественная зависимость подчиняется закону Рауля:
относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного нелетучего вещества.
Математическое выражение закона Рауля:
p0 |
p |
|
|
, |
p0 |
|
0 |
||
|
|
|||
где p0 и p - давление насыщенного пара растворителя над чистым растворителем и раствором;
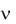 и 0 - количество растворенного вещества и растворителя.
и 0 - количество растворенного вещества и растворителя.
Пример. Рассчитайте давление насыщенного пара воды над раствором, в 450 г которого содержится 90 г глюкозы С6Н12О6, при 250С. Давление насыщенного пара воды при этой температуре равно 3167 Па.
Решение.
Из математического выражения закона Рауля следует, что давление насыщенного пара воды (растворителя) над раствором
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p |
p0 (1 |
|
|
|
|
|
) . |
||||
|
|
|
|
|
0 |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Значения молярных масс |
MH |
O |
18 г/моль; |
|
Mгл 180 г/моль . Рассчитываем |
|||||||
|
2 |
|
|
|
|
|
|
|
|
|
|
|
количество вещества воды и глюкозы: |
|
|
|
|
|
|
||||||
|
|
|
450 |
90 |
|
20 моль ; |
||||||
H 2 O |
0 |
|
|
|
|
|
|
|
|
|||
18 |
|
|
||||||||||
|
|
|
|
|||||||||
|
|
|
|
|
|
|
||||||
|
|
|
90 |
|
0,5 моль . |
|||||||
|
гл |
|
|
|
|
|
|
|||||
|
|
180 |
|
|||||||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
||||
Выполняем подстановку: |
|
|
|
|
|
|
|
|
|
|
|
|
p |
3167(1 |
0,5 |
) |
3090 Па . |
||||||||
|
|
|
||||||||||
20 |
0,5 |
|||||||||||
ТЕМПЕРАТУРЫ КИПЕНИЯ И КРИСТАЛЛИЗАЦИИ РАСТВОРОВ
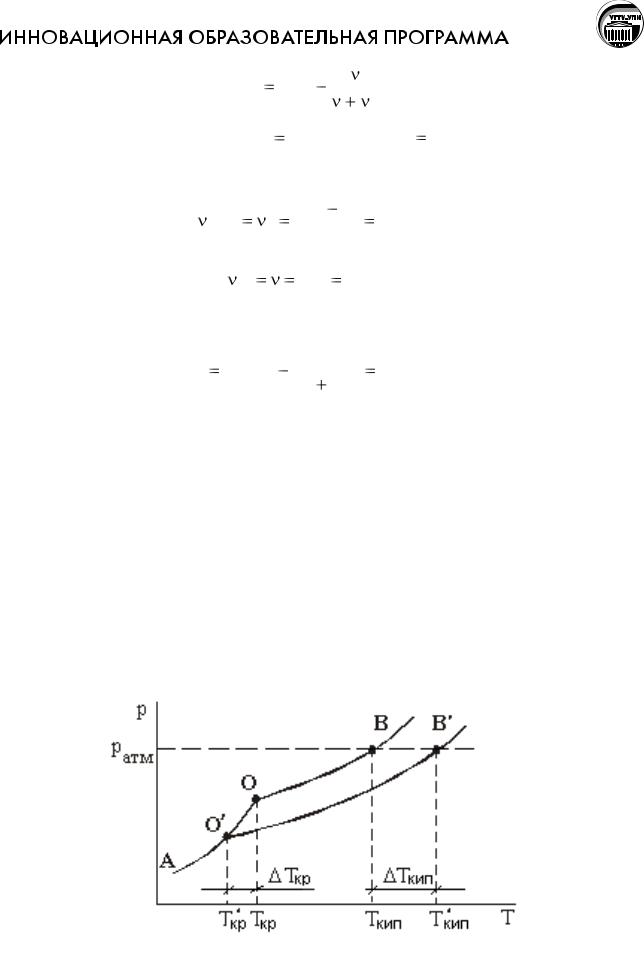
Понижение давления насыщенного пара раствора влияет на температуры кристаллизации и кипения. На рисунке представлены температурные зависимости давления насыщенного пара над чистым растворителем (кривая АОВ) и растворителя над раствором (кривая АО/В/). Растворенное вещество нелетучее и не образует твердых растворов с растворителем, т.е. в газовую и твердую фазы переходит только чистый растворитель.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Участок АО кривой АОB отражает температурную зависимость давления насыщенного пара над твердым растворителем, участок OB - температурную зависимость давления насыщенного пара над жидким растворителем. Участок О/B/ характеризует температурную зависимость давления насыщенного пара над раствором.
Жидкость кристаллизуется при температуре, которой соответствует одинаковое давление насыщенного пара над твердой и жидкой фазами. Для чистого растворителя это происходит при температуре, соответствующей точке О, т.е. Ткр - температура кристаллизации чистого растворителя.
Для раствора давление насыщенного пара над твердой и жидкой фазами становится равным в точке О/, т.е. Ткр/ - температура кристаллизации раствора.
Температура кристаллизации раствора ниже температуры кристаллизации чистого растворителя.
Жидкость кипит при той температуре, при которой давление насыщенного пара становится равным атмосферному давлению. При давлении pатм температура кипения чистого растворителя Ткип, температура кипения раствора Ткип/.
При постоянном атмосферном давлении температура кипения раствора выше температуры кипения чистого растворителя.
Количественные зависимости имеют вид:
Tкр |
KкCm , |
(1) |
Tкип |
K эCm , |
(2) |
где Tкр - понижение температуры замерзания раствора по
сравнению с температурой замерзания чистого растворителя;
Tкип - повышение температуры кипения раствора по
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

сравнению с температурой кипения чистого растворителя;
K к - криоскопическая постоянная;
K э - эбулиоскопическая постоянная;
Cm - моляльная концентрация (моляльность) раствора.
 Моляльная концентрация раствора (Cm ) – отношение количества растворенного вещества к массе растворителя (размерность – моль/кг).
Моляльная концентрация раствора (Cm ) – отношение количества растворенного вещества к массе растворителя (размерность – моль/кг).
m
Cm m0 Mm0 ,
где 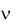 - количество растворенного вещества, моль; m 0 - масса растворителя, кг;
- количество растворенного вещества, моль; m 0 - масса растворителя, кг;
m - масса растворенного вещества, г;
M – молярная масса растворенного вещества, г/моль.
Криоскопическая и эбулиоскопическая постоянные показывают,
соответственно, на сколько градусов понижается температура кристаллизации
и повышается температура кипения одномоляльного раствора ( Cm =1 моль/кг).
Значения K к |
и K э определяются природой растворителя: |
||||
|
|
|
|
|
|
Постоянные |
|
Значения Кк и Кэ растворителей, кг.К.моль 1 |
|||
|
|
|
|
|
|
растворителей |
вода |
этанол |
бензол |
тетрахлорид |
|
|
|
углерода |
|||
|
|
|
|
|
|
Kк |
|
1,86 |
1,99 |
5,12 |
29,8 |
Кэ |
|
0,52 |
1,22 |
2,53 |
5,02 |
|
|
|
|
|
|
Если растворенное в жидкости вещество нелетучее и не образует твердого раствора, то в газовую и твердую фазу при кипении и кристаллизации раствора переходит только чистый растворитель. Это означает, что при
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

кипении и кристаллизации концентрация остающегося раствора увеличивается.
Поэтому температура кипения раствора по мере испарения растворителя повышается, а температура кристаллизации по мере кристаллизации растворителя понижается.
Используя уравнения (1), (2) и выражение для моляльной концентрации раствора, можно определить молярную массу вещества по уравнениям:
M |
Kк m |
, |
(3) |
||
m0 |
Tкр |
||||
|
|
|
|||
M |
Kэ m |
. |
(4) |
||
m0 |
Tкип |
||||
|
|
|
|||
На практике молярные массы чаще определяют криоскопическим |
|||||
методом, основанным на установлении |
Tкр и расчете по уравнению (3). Реже |
||||
применяют эбулиоскопический метод, основанный на измерении |
Tкип . |
||||
Эффект понижения температуры |
кристаллизации при |
образовании |
|||
растворов широко используют в технике для приготовления антифризов – жидкостей с пониженной температурой замерзания, применяющихся в системах охлаждения двигателей.
Пример 1. Рассчитайте массу глицерина С3Н8О3, которую следует растворить в 1,25 л воды для получения раствора с температурой кипения
100,1040С. Эбулиоскопическая постоянная воды 0,52 ( К  моль -1
моль -1  кг ).
кг ).
Решение.
В формулу (2) для расчета повышения температуры кипения при
образовании раствора подставляем выражение для моляльной концентрации раствора:
|
|
Tкип |
|
Кэ |
|
m |
|||||||||||||
|
|
|
|
. |
|||||||||||||||
|
|
|
Mm0 |
||||||||||||||||
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
2 |
7 |
1 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Выражаем массу глицерина (растворенного вещества):
|
|
|
m |
|
Tкип Mm0 |
. |
|
||
|
|
|
|
|
|
|
|||
|
|
|
|
|
Kэ |
|
|||
Выполняем подстановку, учитывая, |
что |
Tкип 0,104 K ; M Mгл 92 г/моль ; |
|||||||
m0 |
mH |
O 1,25 кг ; Кэ = 0,52 ( К моль -1 |
кг ): |
|
|||||
|
2 |
|
|
|
|
|
|
|
|
|
|
m |
0,104 |
92 1,25 |
|
23 г . |
|||
|
|
|
|
|
|
|
|
||
|
|
0,52 |
|
|
|
||||
|
|
|
|
|
|
|
|||
Пример 2. Температура кристаллизации раствора, содержащего 6,15 г
нитробензола в 400 г бензола, равна 4,86оС. Определите молярную массу нитробензола. Температура кристаллизации бензола 5,5оС; криоскопическая постоянная бензола 5,12 ( К  моль -1
моль -1  кг ).
кг ).
Решение.
Расчет молярной массы нитробензола выполняем по формуле
|
|
|
M |
Kк m |
, |
||
|
|
|
m0 Tкр |
||||
|
|
|
|
|
|
||
подставляя |
значения |
m = 6,15 г; |
|
Кк = 5,12 ( К моль -1 кг ); m0 = 0,4 кг; |
|||
Tкр tкр |
5,5 4,86 |
0,64 K . |
|
|
|
|
|
|
|
M |
5,12 |
6,15 |
123 г/моль . |
||
|
|
|
|
|
|||
|
|
0,4 |
0,64 |
||||
|
|
|
|
|
|||
Пример 3. Температура кипения 5%-го раствора бензойной кислоты в эфире равна 35,53оС. Определите молярную массу бензойной кислоты.
Температура кипения эфира 34,6оС, эбулиоскопическая постоянная эфира
2,16 ( К  моль -1
моль -1  кг ).
кг ).
Решение.
Расчет молярной массы бензойной кислоты выполняем по формуле
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

|
|
M |
|
|
K эm |
, |
|
|
|
|
m0 Tкип |
||||
|
|
|
|
|
|||
подставляя значения |
m = 5 г; |
m0 = 0,095 кг; Кэ = 2,16 ( К моль -1 кг ); |
|||||
Tкип 35,53 34,6 |
0,93 K . |
|
|
|
|
|
|
|
M |
2,16 |
5 |
|
122 г/моль . |
||
|
|
|
|
|
|||
|
|
|
|
|
|||
|
|
0,095 |
0,93 |
|
|||
ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ
Все растворы независимо от агрегатного состояния обладают способностью к диффузии. Диффузией называют свойство вещества равномерно распределяться по всему предоставленному ему объему.
Если в сосуд налить концентрированный раствор, а поверх него чистый растворитель, то диффузия будет протекать в обоих направлениях – растворенное вещество будет диффундировать в растворитель, а растворитель – в раствор. В итоге концентрация по всему объему становится одинаковой.
Можно создать условия, при которых диффузия идет только в одном направлении. Если раствор и растворитель (или два раствора с различной концентрацией растворенного вещества) разделить полупроницаемой мембраной, пропускающей только молекулы растворителя, возможна будет только диффузия растворителя. Самопроизвольный процесс перехода растворителя через полупроницаемую мембрану называют осмосом.
По мере перехода растворителя объем раствора возрастает, и давление на мембрану со стороны раствора увеличивается. Возникает сила,
препятствующая диффузии растворителя; сила, отнесенная к площади поверхности полупроницаемой мембраны – гидростатическое давление. При некотором давлении наступает равновесие: в раствор переходит столько же молекул растворителя, сколько выталкивается обратно.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Равновесное давление раствора, препятствующее диффузии растворителя через полупроницаемую мембрану, называют осмотическим давлением.
Вант-Гофф показал, что
осмотическое давление в растворе неэлектролита пропорционально молярной концентрации растворенного вещества:
pосм CRT ,
где С – молярная концентрация раствора,
R - универсальная газовая постоянная,
T - абсолютная температура.
Полная аналогия этого уравнения с уравнением состояния идеального газа позволила Вант-Гоффу сформулировать закон:
Осмотическое давление идеального раствора равно тому давлению, которое оказывало бы растворенное вещество, если бы оно, находясь в газообразном состоянии при данной температуре, занимало объем раствора.
Осмотическое давление раствора очень велико, при нормальных условия для раствора с концентрацией 1 моль/л оно в 22,4 раза больше атмосферного.
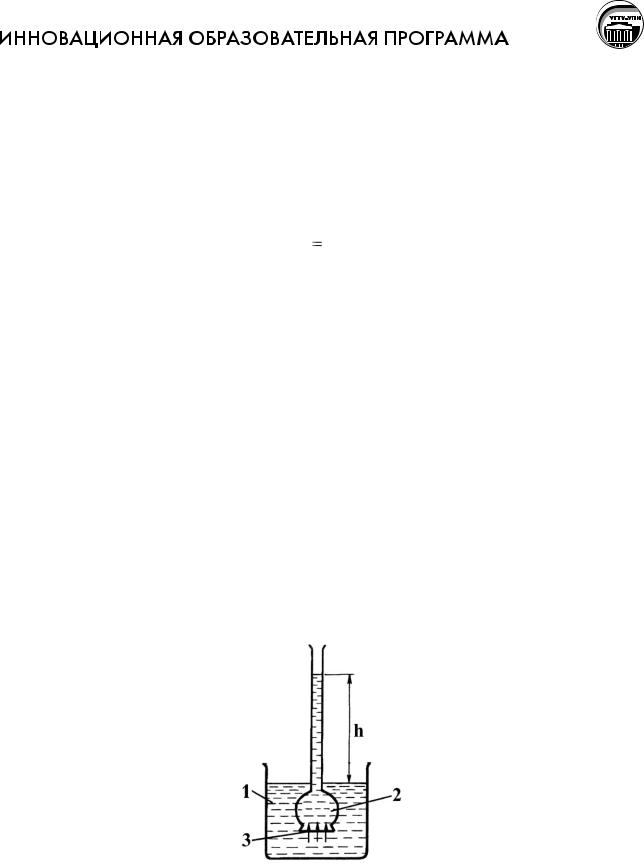
На рисунке приведена схема осмометра:
1 – растворитель; 2 – раствор; 3 – полупроницаемая мембрана.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Осмотическое давление равно давлению столба раствора высотой h в
осмометре. При равновесии внешнее давление уравновешивает осмотическое давление.
Осмос играет важнейшую роль в процессе жизнедеятельности животных и растений, поскольку клеточная мембрана является полупроницаемой. Осмос обусловливает поднятие воды по стеблю растений, рост клетки и многие другие явления.
Если внешнее давление, приложенное к более концентрированному раствору, больше осмотического, растворитель будет переходить из более концентрированного раствора в менее концентрированный (или чистый растворитель). Этот процесс, называемый обратным осмосом, используют для очистки природных и сточных вод, для получения питьевой воды из морской воды.
Пример. Рассчитайте осмотическое давление при 270С раствора сахара С12Н22О11, в 1,5 л которого содержится 136,5 г растворенного вещества.
Решение.
Осмотическое давление раствора
pосм CRT .
С учетом выражения для молярной концентрации раствора
C MVm ,
получаем расчетную формулу
mRT pосм MV .
Подставляем значения m = 136,5 г; R 8,31Дж/(моль  К) ; Т = 300 К;
К) ; Т = 300 К;
М = 342 г/моль; V |
1,5 л 1,5 10 3 м3 : |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
pосм |
136,5 |
8,31 300 |
|
|
663,3 103 |
Па |
663,3 кПа . |
|||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||
|
342 1,5 10 3 |
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Исполнитель: |
|
|
|
|
Дата: |
|
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
